浙江省宁波市2020-2021学年高一上学期化学期末考试试卷
试卷更新日期:2021-10-19 类型:期末考试
一、单选题
-
1. 下列属于酸性氧化物的是( )A、 B、 C、 D、2. 下列状态下能导电的电解质是( )A、 B、 C、 溶液 D、熔融3. 一些化学物质在其包装上应贴上相应的安全使用标识,下列物质贴错了标识的是( )
物质
浓
酒精
安全使用标识

腐蚀类物质

毒性物质

爆炸类物质

易燃类物质
选项
A
B
C
D
A、A B、B C、C D、D4. 下列化学用语正确的是( )A、金刚砂的化学式: B、原子核内有7个中子的碳原子: C、 的结构示意图: D、 分子的结构模型:
D、 分子的结构模型:  5. 下列说法正确的是( )A、C60和石墨互为同素异形体 B、H,D,T是同一种核素 C、14C与14N中含有相同的中子数 D、1H、2H2、3H+互为同位素6. 三氟化氮( )是微电子工业中优良的等离子刻蚀气体。它在潮湿的环境中能发生反应: 。下列有关该反应的说法正确的是( )A、 是氧化剂, 是还原剂 B、还原剂与氧化剂的分子数之比为 C、若生成 ,则转移 电子 D、 是还原产物, 是氧化产物7. 下列各组物质互相反应,生成物不随反应条件或反应物用量多少而变化的是( )A、 和 B、 和盐酸 C、 和氯气 D、 和 溶液8. 下列说法符合化学史实的是( )A、门捷列夫将元素按质子数由小到大依次排列得到了第一张元素周期表 B、舍勒发现了一种黄绿色气体,并命名它为氯气 C、汤姆孙发现了电子,并提出了电子云模型 D、侯德榜创立的“侯氏制碱法”缩短了生产流程,降低了制碱的成本9. 下列操作中正确的是( )A、用水扑灭金属 、 的燃烧 B、焰色试验中用过的铂丝可以用稀硫酸洗净 C、丁达尔效应可被用来区分食盐水和淀粉溶液 D、若不慎将酸沾到皮肤上,用大量水冲洗后再用 溶液冲洗10. 化学与我们的生活密不可分,下列说法错误的是( )A、 、 、 等可用于自来水的杀菌消毒 B、 广泛用于制作光导纤维和硅太阳能电池 C、液氨、干冰等可用作制冷剂 D、 可用于肠胃 射线造影检查11. 下列关于材料的说法错误的是( )A、钢是用量最大的合金材料,钢中加入稀土元素可改善钢的性能 B、储氢合金是一类通过物理方法吸附 的新型合金材料 C、中国天眼 用到的碳化硅是一种新型陶瓷材料 D、石墨烯是一种具有优异性能的新型材料12. 下列说法正确的是( )A、为方便运输可用干燥的钢瓶储存液氯 B、 氧化性强,稳定性好,常用于杀菌消毒 C、氯水呈酸性,可用 试纸准确测得其 D、溶液中加入 溶液有白色沉淀生成,则原溶液中一定有13. 下列关于硫的化合物说法正确的是( )A、 能使品红、溴水等物质褪色,体现了漂白性 B、常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应 C、浓硫酸能干燥 、 等气体,体现了浓硫酸的吸水性 D、硫化氢水溶液有还原性,暴露在空气中往往会产生浑浊的现象14. 下列说法正确的是( )A、 , 均属于氮的固定 B、硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中 C、 很稳定,不支持任何物质的燃烧 D、所有的铵盐受热分解都会产生15. 下列有关工业生产的说法正确的是( )A、电子工业上使用 溶液腐蚀铜箔制作印刷电路板 B、水泥、玻璃的生产都需用到石灰石为原料 C、工业制漂白粉的原料为氯气和澄清石灰水 D、工业上用焦炭还原二氧化硅即可制得高纯硅16. 下列离子方程式错误的是( )A、石灰石与高氯酸反应: B、 溶于氢碘酸中: C、少量 溶液滴入 溶液中: D、向饱和的 溶液中通入过量 :17. 下列各组化合物中化学键类型完全相同的是( )A、NaCl和HCl B、NaOH和Na2O C、H2和H2SO4 D、NH3和H2O18. 下列说法正确的是( )A、 溶于水能导电,所以 为离子化合物 B、熔融状态下不能导电的物质一定是共价化合物 C、化学物质都由共价键或离子键结合而成 D、 溶于水既有极性共价键的断裂又有极性共价键的形成19. 下列说法正确的是( )A、 、 、 、 单质的颜色逐渐加深,沸点逐渐降低 B、金属和非金属分界线附近可以寻找制作优良的催化剂的元素 C、同一周期中,ⅡA与ⅢA族元素原子的核电荷数可以相差25 D、在多电子原子中,离核近的区域内运动的电子能量较高20. X、Y、Z、M为四种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L。下列说法正确的是( )A、原子半径比较:Z>Y>X>M B、元素的氧化物对应的水化物的酸性比较:Z>Y>X C、由Y、Z、M三种元素可形成一 种常见的离子化合物 D、M2Z较稳定是由于分子间存在氢键21. 设 是阿伏加德罗常数的值。下列说法正确的是( )A、 的 溶液中含有 个 B、标准状况下, 中有 个原子 C、常温下 和 的混合气体含有电子数为 D、 固体中含有的离子总数为22. 无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用Al和氯气通过下装置制备。已知A中产生的氯气混有少许HCl和水蒸气。则下列说法正确的是( )
5. 下列说法正确的是( )A、C60和石墨互为同素异形体 B、H,D,T是同一种核素 C、14C与14N中含有相同的中子数 D、1H、2H2、3H+互为同位素6. 三氟化氮( )是微电子工业中优良的等离子刻蚀气体。它在潮湿的环境中能发生反应: 。下列有关该反应的说法正确的是( )A、 是氧化剂, 是还原剂 B、还原剂与氧化剂的分子数之比为 C、若生成 ,则转移 电子 D、 是还原产物, 是氧化产物7. 下列各组物质互相反应,生成物不随反应条件或反应物用量多少而变化的是( )A、 和 B、 和盐酸 C、 和氯气 D、 和 溶液8. 下列说法符合化学史实的是( )A、门捷列夫将元素按质子数由小到大依次排列得到了第一张元素周期表 B、舍勒发现了一种黄绿色气体,并命名它为氯气 C、汤姆孙发现了电子,并提出了电子云模型 D、侯德榜创立的“侯氏制碱法”缩短了生产流程,降低了制碱的成本9. 下列操作中正确的是( )A、用水扑灭金属 、 的燃烧 B、焰色试验中用过的铂丝可以用稀硫酸洗净 C、丁达尔效应可被用来区分食盐水和淀粉溶液 D、若不慎将酸沾到皮肤上,用大量水冲洗后再用 溶液冲洗10. 化学与我们的生活密不可分,下列说法错误的是( )A、 、 、 等可用于自来水的杀菌消毒 B、 广泛用于制作光导纤维和硅太阳能电池 C、液氨、干冰等可用作制冷剂 D、 可用于肠胃 射线造影检查11. 下列关于材料的说法错误的是( )A、钢是用量最大的合金材料,钢中加入稀土元素可改善钢的性能 B、储氢合金是一类通过物理方法吸附 的新型合金材料 C、中国天眼 用到的碳化硅是一种新型陶瓷材料 D、石墨烯是一种具有优异性能的新型材料12. 下列说法正确的是( )A、为方便运输可用干燥的钢瓶储存液氯 B、 氧化性强,稳定性好,常用于杀菌消毒 C、氯水呈酸性,可用 试纸准确测得其 D、溶液中加入 溶液有白色沉淀生成,则原溶液中一定有13. 下列关于硫的化合物说法正确的是( )A、 能使品红、溴水等物质褪色,体现了漂白性 B、常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应 C、浓硫酸能干燥 、 等气体,体现了浓硫酸的吸水性 D、硫化氢水溶液有还原性,暴露在空气中往往会产生浑浊的现象14. 下列说法正确的是( )A、 , 均属于氮的固定 B、硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中 C、 很稳定,不支持任何物质的燃烧 D、所有的铵盐受热分解都会产生15. 下列有关工业生产的说法正确的是( )A、电子工业上使用 溶液腐蚀铜箔制作印刷电路板 B、水泥、玻璃的生产都需用到石灰石为原料 C、工业制漂白粉的原料为氯气和澄清石灰水 D、工业上用焦炭还原二氧化硅即可制得高纯硅16. 下列离子方程式错误的是( )A、石灰石与高氯酸反应: B、 溶于氢碘酸中: C、少量 溶液滴入 溶液中: D、向饱和的 溶液中通入过量 :17. 下列各组化合物中化学键类型完全相同的是( )A、NaCl和HCl B、NaOH和Na2O C、H2和H2SO4 D、NH3和H2O18. 下列说法正确的是( )A、 溶于水能导电,所以 为离子化合物 B、熔融状态下不能导电的物质一定是共价化合物 C、化学物质都由共价键或离子键结合而成 D、 溶于水既有极性共价键的断裂又有极性共价键的形成19. 下列说法正确的是( )A、 、 、 、 单质的颜色逐渐加深,沸点逐渐降低 B、金属和非金属分界线附近可以寻找制作优良的催化剂的元素 C、同一周期中,ⅡA与ⅢA族元素原子的核电荷数可以相差25 D、在多电子原子中,离核近的区域内运动的电子能量较高20. X、Y、Z、M为四种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L。下列说法正确的是( )A、原子半径比较:Z>Y>X>M B、元素的氧化物对应的水化物的酸性比较:Z>Y>X C、由Y、Z、M三种元素可形成一 种常见的离子化合物 D、M2Z较稳定是由于分子间存在氢键21. 设 是阿伏加德罗常数的值。下列说法正确的是( )A、 的 溶液中含有 个 B、标准状况下, 中有 个原子 C、常温下 和 的混合气体含有电子数为 D、 固体中含有的离子总数为22. 无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用Al和氯气通过下装置制备。已知A中产生的氯气混有少许HCl和水蒸气。则下列说法正确的是( )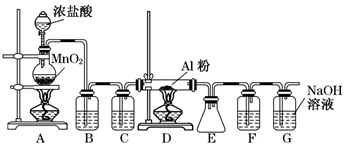 A、试剂瓶B,C,F中分别盛饱和NaHCO3、浓硫酸、浓硫酸 B、氯化铝产品最后在装置E中收集 C、实验开始时应先点燃D处酒精灯 D、装置F和G可用盛无水CaCl2的干燥管替换23. 将一定质量的 合金投入 稀 溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的 溶液,生成沉淀的质量与所加 溶液的体积关系如图所示。下列说法正确的是( )
A、试剂瓶B,C,F中分别盛饱和NaHCO3、浓硫酸、浓硫酸 B、氯化铝产品最后在装置E中收集 C、实验开始时应先点燃D处酒精灯 D、装置F和G可用盛无水CaCl2的干燥管替换23. 将一定质量的 合金投入 稀 溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的 溶液,生成沉淀的质量与所加 溶液的体积关系如图所示。下列说法正确的是( ) A、合金中 的质量比为 B、生成的气体体积为 C、 ; D、合金充分反应后,剩余硫酸的物质的量为24. 过氧化铬的化学式为 ,从其结构发现含有2个过氧键,结构如图所示,下列说法错误的是( )
A、合金中 的质量比为 B、生成的气体体积为 C、 ; D、合金充分反应后,剩余硫酸的物质的量为24. 过氧化铬的化学式为 ,从其结构发现含有2个过氧键,结构如图所示,下列说法错误的是( ) A、 可能具有强氧化性 B、 溶于水可能放出氧气 C、 结构中含有非极性键 D、 中 的化合价为+1025. 某溶液可能含有 、 、 、 、 、 、 中的若干种,且各离子浓度均相等。往该溶液中逐滴加入稀盐酸至过量,无明显现象,并得溶液 ,对溶液 进行如下实验,下列说法正确的是( )
A、 可能具有强氧化性 B、 溶于水可能放出氧气 C、 结构中含有非极性键 D、 中 的化合价为+1025. 某溶液可能含有 、 、 、 、 、 、 中的若干种,且各离子浓度均相等。往该溶液中逐滴加入稀盐酸至过量,无明显现象,并得溶液 ,对溶液 进行如下实验,下列说法正确的是( ) A、气体 可以用湿润的蓝色石蕊试纸检验 B、原溶液中是否含有 只能通过焰色试验确定 C、原溶液中一定含有 、 、 、 D、往溶液 中通入过量 可以得到白色沉淀
A、气体 可以用湿润的蓝色石蕊试纸检验 B、原溶液中是否含有 只能通过焰色试验确定 C、原溶液中一定含有 、 、 、 D、往溶液 中通入过量 可以得到白色沉淀二、填空题
-
26. 按要求回答下列问题:(1)、写出 的电子式;(2)、用电子式表示 的形成过程;(3)、写出 的结构式 , 它的空间构型为;(4)、写出铜和浓硫酸反应的化学方程式;(5)、写出实验室用 代替 制氯气的离子方程式。
三、综合题
-
27. 化合物 由两种常见的元素组成,难溶于水,为探究其组成和性质,设计并完成如下实验(气体体积均为标准状况下测得):
 (1)、 中含有的元素是;其中非金属元素在周期表中的位置是;(2)、写出白色沉淀转化为红褐色沉淀的化学方程式;(3)、写出 与足量 反应的离子方程式。28. 某实验室用 固体配制 的 溶液,请回答:(1)、配制过程中除了用到托盘天平、药匙,还必需用到的玻璃仪器有玻璃棒、烧杯、、;(2)、需称取的 固体的质量为 ;(3)、将称得的 固体溶解于烧杯,后续的操作步骤正确的排序为;(洗涤操作只需考虑一次)
(1)、 中含有的元素是;其中非金属元素在周期表中的位置是;(2)、写出白色沉淀转化为红褐色沉淀的化学方程式;(3)、写出 与足量 反应的离子方程式。28. 某实验室用 固体配制 的 溶液,请回答:(1)、配制过程中除了用到托盘天平、药匙,还必需用到的玻璃仪器有玻璃棒、烧杯、、;(2)、需称取的 固体的质量为 ;(3)、将称得的 固体溶解于烧杯,后续的操作步骤正确的排序为;(洗涤操作只需考虑一次) (4)、下列说法正确的是______;A、容量瓶用后洗净、晾干,磨口玻璃瓶塞与瓶口处应垫一张纸条 B、 固体在烧杯中溶解后立即转移到容量瓶中 C、定容加水时俯视刻度线,会导致所配溶液浓度偏大 D、摇匀后发现液面低于刻度线,继续补加水至刻度线(5)、取 配制好的溶液加水稀释到 ,稀释后 溶液浓度为 。(保留两位有效数字)29. (NH4)2Fe(SO4)2·6H2O俗称“摩尔盐”,是一种 重要的化学试剂。当隔绝空气加热至500℃时,摩尔盐可完全分解,某小组欲探究其分解产物,设计实验如下,请回答:(1)、该小组认为分解产物可能有以下几种情况:A、Fe2O3、SO3、NH3、H2O B、FeO、SO3、NH3、H2O C、FeO、SO2、NH3、H2O
(4)、下列说法正确的是______;A、容量瓶用后洗净、晾干,磨口玻璃瓶塞与瓶口处应垫一张纸条 B、 固体在烧杯中溶解后立即转移到容量瓶中 C、定容加水时俯视刻度线,会导致所配溶液浓度偏大 D、摇匀后发现液面低于刻度线,继续补加水至刻度线(5)、取 配制好的溶液加水稀释到 ,稀释后 溶液浓度为 。(保留两位有效数字)29. (NH4)2Fe(SO4)2·6H2O俗称“摩尔盐”,是一种 重要的化学试剂。当隔绝空气加热至500℃时,摩尔盐可完全分解,某小组欲探究其分解产物,设计实验如下,请回答:(1)、该小组认为分解产物可能有以下几种情况:A、Fe2O3、SO3、NH3、H2O B、FeO、SO3、NH3、H2O C、FeO、SO2、NH3、H2OD Fe2O3、SO2、NH3、H2O
E. Fe2O3、SO2、SO3、NH3、H2O
经认真分析,确定猜想_______不成立 (填序号)。
(2)、为进一步确认分解产物,该小组设计了如下实验装置探究:
①加热前先通一段时间N2 , 加热至完全分解后再通入过量N2 , 两次通入氮气的目的是。
②实验过程中观察到装置D始终无明显现象,装置C和E均产生白色沉淀。写出E中发生反应的离子方程式。
③甲同学根据装置C产生白色沉淀的现象,判断产物中一定含有SO3 , 你认为甲同学的判断是否合理(填“合理”或“不合理”) , 若不合理请说明理由:。
(3)、实验结束后,A中的固体变为红棕色,请设计实验验证残留固体中只含有Fe2O3而不含FeO。四、计算题
-
30. 为测定某一混合铵盐的成分(主要含有 和 ),将不同质量的样品分别加入到 浓度相同的 溶液中,沸水浴加热至气体全部逸出(此温度下该铵盐不分解)。气体干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量如下表所示:
实验次数
1
2
3
4
铵盐质量/
9.05
18.10
27.15
36.2
浓硫酸增重/
1.7
1.7
0
(1)、 和 的物质的量之比;(2)、 溶液的物质的量浓度为 ;(3)、第三次实验时浓硫酸增加的质量a的值为。
-