吉林省长春市农安县五校联考2020-2021学年高二上学期化学期末考试试卷
试卷更新日期:2021-10-19 类型:期末考试
一、单选题
-
1. 下列设备工作时,将化学能转化为热能的是( )
A
B
C
D




燃气灶
太阳能热水器
纽扣电池
太阳能电池
A、A B、B C、C D、D2. 已知3.0g乙烷在常温下完全燃烧放出的热量为155.98kJ,则下列表示乙烷标准燃烧热的热化学方程式书写正确的是( )A、2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3119.6kJ·mol-1 B、C2H6(g)+ O2(g)=2CO(g)+3H2O(l) ΔH=-1559.8kJ·mol-1 C、C2H6(g)+ O2(g)=2CO2(g)+3H2O(g) ΔH=-1559.8kJ·mol-1 D、C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH=-1559.8kJ·mol-13. 反应:A(g)+3B(g)=C(g)+2D(g),在4种不同情况下的反应速率分别为:①v(A)=0.5mol·L-1·min-1;②v(B)=0.45mol·L-1·s-1;③v(C)=0.3mol·L-1·s-1;④v(D)=0.45mol·L-1·s-1。下列有关反应速率的比较中正确的是( )A、①<②<④<③ B、①<②=③<④ C、①>②=③>④ D、①>②>③>④4. 下列物质的电离方程式错误的是( )A、水溶液中:NaHCO3=Na++H++CO B、水溶液中:Ca(OH)2=Ca2++2OH- C、水溶液中:H2SO4=2H++SO D、熔融状态下:Na2O=2Na++O2-5. 已知反应:2H2O2=2H2O+O2↑,下列措施不能加快该反应的速率的是( )A、升高温度 B、加入少量MnO2固体 C、加水稀释 D、加入几滴FeCl3溶液6. 研究化学反应进行的方向对于反应设计等具有重要意义,下列说法正确的是( )A、△H <0、△S >0的反应在温度低时不能自发进行 B、在其他外界条件不变的情况下,汽车排气管中使用催化剂,可以改变产生尾气的反应方向 C、反应 CaCO3(s) = CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H <0 D、一定温度下,反应 MgCl2(l) =Mg(l)+Cl2(g)的 △H >0、△S >07. 下列变化与盐类水解平衡无关的是( )A、浓硫化钠溶液有臭味 B、将饱和氯化铁溶液加入沸水制胶体 C、盐酸与碳酸钙反应生成二氧化碳 D、配制硫酸亚铁溶液时加少量硫酸8. 测定中和反应的反应热的装置如图所示,下列有关该实验的说法中错误的是( ) A、测定中和反应的反应热时,不能选用NaOH溶液和浓硫酸 B、相同条件下,NaOH溶液与盐酸、硝酸反应的反应热不相同 C、实验需要记录反应前初始温度及反应后溶液达到的最高温度 D、环形玻璃搅拌棒上下搅拌有助于反应充分,泡沫塑料起保温作用9. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是( )
A、测定中和反应的反应热时,不能选用NaOH溶液和浓硫酸 B、相同条件下,NaOH溶液与盐酸、硝酸反应的反应热不相同 C、实验需要记录反应前初始温度及反应后溶液达到的最高温度 D、环形玻璃搅拌棒上下搅拌有助于反应充分,泡沫塑料起保温作用9. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是( ) A、该电池中电极b是正极,发生还原反应 B、外电路中电流由电极a通过导线流向电极b C、该电池的总反应为2H2O=2H2+O2 D、该电池工作时电能转化为化学能10. 能影响水的电离平衡,并使溶液中c(OH-)>c(H+)操作是( )A、加入Na2CO3固体 B、加入NaNO3固体 C、加入NaHSO4固体 D、加入(NH4)2SO4固体11. 某小组用如图装置模拟电镀铜和精炼铜。下列说法错误的是( )
A、该电池中电极b是正极,发生还原反应 B、外电路中电流由电极a通过导线流向电极b C、该电池的总反应为2H2O=2H2+O2 D、该电池工作时电能转化为化学能10. 能影响水的电离平衡,并使溶液中c(OH-)>c(H+)操作是( )A、加入Na2CO3固体 B、加入NaNO3固体 C、加入NaHSO4固体 D、加入(NH4)2SO4固体11. 某小组用如图装置模拟电镀铜和精炼铜。下列说法错误的是( ) A、电镀铜和精炼铜时,Y上的电极反应都是:Cu2++2e-=Cu B、电镀铜时,Y 电极为待镀的金属制品 C、精炼铜时,X 电极是粗铜,比铜活泼的金属最终变成阳极泥 D、电镀铜时,X 电极是铜,溶液中的Cu2+浓度保持不变12. 将a mol N2和3a mol H2充入绝热的固定容积密闭容器中,发生合成氨反应N2(g)+3H2(g)⇌2NH3(g)。下列选项中说明反应已经达到平衡状态的是( )
A、电镀铜和精炼铜时,Y上的电极反应都是:Cu2++2e-=Cu B、电镀铜时,Y 电极为待镀的金属制品 C、精炼铜时,X 电极是粗铜,比铜活泼的金属最终变成阳极泥 D、电镀铜时,X 电极是铜,溶液中的Cu2+浓度保持不变12. 将a mol N2和3a mol H2充入绝热的固定容积密闭容器中,发生合成氨反应N2(g)+3H2(g)⇌2NH3(g)。下列选项中说明反应已经达到平衡状态的是( )①体系的温度不再改变; ②体系的压强不再改变;
③混合气体密度不再改变; ④混合气体的平均摩尔质量不再改变;
⑤N2和H2的浓度之比达到1:3; ⑥v(N2)正反应=3v(H2)逆反应;
⑦2v(H2)正反应=3v(NH3)逆反应; ⑧每有一根N≡N键断裂就有6根N-H键形成。
A、②④⑤⑥ B、②③⑥⑧ C、①②④⑥ D、①②④⑦13. 下列说法正确的是( )A、强酸的水溶液中不存在OH- B、pH=0的溶液是酸性最强的溶液 C、25℃时溶液中由水电离出的c(H+)=1×10-11mol·L-1 , 该溶液显碱性 D、温度不变时,加水稀释氢氧化钠溶液,溶液中离子浓度不能都减小14. 我国科学家研发了一种水系可逆Zn-CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH- , 在外加电场中可透过相应的离子膜定向移动。当闭合K1时,Zn-CO2电池工作原理如图所示: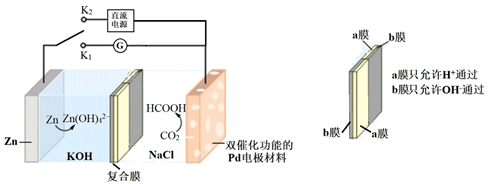
下列说法错误的是( )
A、闭合K1时,Zn表面的电极反应式为Zn + 4OH− - 2e− = Zn(OH) B、闭合K1时,反应一段时间后,NaCl溶液的pH减小 C、闭合K2时,Pd电极与直流电源正极相连 D、闭合K2时,H+通过a膜向Pd电极方向移动15. 一定条件下,在恒容密闭容器中,一定量的CO和一定量的H2反应生产工业原料甲醇(CH3OH),测得CO、CH3OH的浓度随时间的变化如图所示(反应混合物均呈气态)。下列说法错误的是( ) A、0~10min,H2的平均反应速率为0.15mol·L-1·min-1 B、t=3min时,反应速率:v正(CO)>v逆(CH3OH) C、CO的平衡转化率为75% D、达到平衡时,CO的物质的量浓度一定是H2的二分之一16. 已知溶解度也可用物质的量浓度表示,25℃时,Ag2SO4在不同浓度 溶液中的溶解度如图所示。下列说法正确的是( )
A、0~10min,H2的平均反应速率为0.15mol·L-1·min-1 B、t=3min时,反应速率:v正(CO)>v逆(CH3OH) C、CO的平衡转化率为75% D、达到平衡时,CO的物质的量浓度一定是H2的二分之一16. 已知溶解度也可用物质的量浓度表示,25℃时,Ag2SO4在不同浓度 溶液中的溶解度如图所示。下列说法正确的是( ) A、图中a、b两点c(Ag+)相同 B、在c点的溶液中加入少量Na2SO4固体,溶液可变为a点 C、该温度下,Ag2SO4溶度积为10-5 D、Ag2SO4溶于水形成的饱和溶液中,c(Ag+)=c( )17. 下列图示与对应的叙述相符的是( )
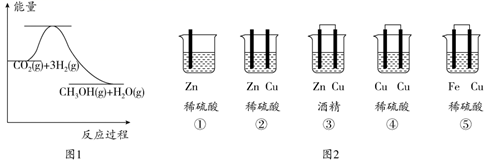
A、图中a、b两点c(Ag+)相同 B、在c点的溶液中加入少量Na2SO4固体,溶液可变为a点 C、该温度下,Ag2SO4溶度积为10-5 D、Ag2SO4溶于水形成的饱和溶液中,c(Ag+)=c( )17. 下列图示与对应的叙述相符的是( ) A、图1表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为吸热反应 B、图2中a、b曲线均表示反应CO(g)+2H2(g) CH3OH(g)的物质能量与反应过程的变化关系,b曲线可能使用了催化剂 C、图3表示25 ℃时用0.100 0 mol·L−1醋酸滴定40.00 mL 0.100 0 mol·L−1NaOH溶液得到的滴定曲线 D、图4表示向2 mL 5%的H2O2溶液中分别滴加0.1 mol·L−1 Fe3+和Cu2+(两溶液的阴离子相同)各1 mL,生成氧气的体积随时间的变化,表明Cu2+能使反应更快18. 关于小苏打(NaHCO3)水溶液的表述正确的是( )A、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) C、HCO3-的电离程度大于HCO3-的水解程度 D、c(Na+)> c(HCO3-)> c(CO32-) > c(OH-) > c(H+)19. 室温下,向0.01mol/L的醋酸溶液中滴入pH=7的醋酸铵稀溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如下图所示,下列分析正确的是( )
A、图1表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为吸热反应 B、图2中a、b曲线均表示反应CO(g)+2H2(g) CH3OH(g)的物质能量与反应过程的变化关系,b曲线可能使用了催化剂 C、图3表示25 ℃时用0.100 0 mol·L−1醋酸滴定40.00 mL 0.100 0 mol·L−1NaOH溶液得到的滴定曲线 D、图4表示向2 mL 5%的H2O2溶液中分别滴加0.1 mol·L−1 Fe3+和Cu2+(两溶液的阴离子相同)各1 mL,生成氧气的体积随时间的变化,表明Cu2+能使反应更快18. 关于小苏打(NaHCO3)水溶液的表述正确的是( )A、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) C、HCO3-的电离程度大于HCO3-的水解程度 D、c(Na+)> c(HCO3-)> c(CO32-) > c(OH-) > c(H+)19. 室温下,向0.01mol/L的醋酸溶液中滴入pH=7的醋酸铵稀溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如下图所示,下列分析正确的是( ) A、ac段,溶液pH增大是CH3COOH=CH3COO-+H+逆向移动的结果 B、a点,pH=2 C、b点,c(CH3COO-)>c( ) D、c点,pH可能大于720. 用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是( )
A、ac段,溶液pH增大是CH3COOH=CH3COO-+H+逆向移动的结果 B、a点,pH=2 C、b点,c(CH3COO-)>c( ) D、c点,pH可能大于720. 用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是( ) A、该反应的ΔH<0,且p1<p2 B、反应速率:v逆(状态A)>v逆(状态B) C、在C点时,CO转化率为75% D、其他条件均相同时,该反应恒压下平衡时CH3OH的体积分数小于恒容时的体积分数
A、该反应的ΔH<0,且p1<p2 B、反应速率:v逆(状态A)>v逆(状态B) C、在C点时,CO转化率为75% D、其他条件均相同时,该反应恒压下平衡时CH3OH的体积分数小于恒容时的体积分数二、综合题
-
21.(1)、下列说法正确的是_______(填字母序号)。A、化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化 B、钢铁生锈腐蚀时,铁被氧化 C、放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生(2)、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气完全燃烧的热化学方程式表示为。(3)、目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。如图1表示该反应进行过程中能量的变化(单位为:kJ·mol-1),该反应是△H0(选填“>”“=”或“<”)。
 (4)、图2装置属于原电池的是(填序号)。在选出的原电池中,是负极,发生(选填“氧化”或“还原”)反应,正极的现象。此原电池反应的化学方程式为。22.(1)、研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
(4)、图2装置属于原电池的是(填序号)。在选出的原电池中,是负极,发生(选填“氧化”或“还原”)反应,正极的现象。此原电池反应的化学方程式为。22.(1)、研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=-49.6 kJ/mol
反应II:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4 kJ/mol
反应III:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
△H3=kJ/mol。
(2)、反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如表:物质
CH3OCH3(g)
H2O(g)
CH3OH(g)
浓度/mol∙L-1
1.8
1.8
0.4
此时v正v逆(选填“>”“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=%。
(3)、在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。
①反应温度T1T2(选填“>”“<”或“=”),说明原因:;
②T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=;KA、KB、KC三者之间的大小关系为。
23. 长春市某中学高二学生为了测定某生理盐水中Cl-的含量,准确量取待测并用AgNO3标准溶液滴定,根据下列信息回答问题。(1)、用酸式滴定管量取20.00 mL生理盐水于锥形瓶中,并滴加1~2滴指示剂用0.5 mol·L-1 AgNO3标准溶液进行滴定。为了减小实验误差,该同学一共进行了四次实验,假设每次所取生理盐水体积均为20.00 mL,四次实验结果记录如下:实验次数
第一次
第二次
第三次
第四次
消耗AgNO3溶液体积/mL
19.00
19.98
20.02
20.00
该生理盐水的浓度为mol·L-1.(保留两位有效数字)
(2)、在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_____(填字母序号)。A、滴定终点读数时俯视读数 B、锥形瓶水洗后未干燥 C、进行滴定操作时,有1滴AgNO3溶液滴到了锥形瓶外面 D、配制AgNO3标准溶液时,定容时仰视容量瓶的刻度线(3)、AgCl沉淀易吸附Cl-。为减少AgCl沉淀对Cl-的吸附,从而减小实验的误差,实验时应采取的措施是。24. 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如图1.通过控制开关连接K1或K2 , 可交替得到H2和O2。 (1)、①制H2时,连接 , 产生H2的电极反应式是;
(1)、①制H2时,连接 , 产生H2的电极反应式是;②改变开关连接方式,可得O2.结合①和②中电极3的电极反应式,说明电极3的作用:。
(2)、用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一、Fe还原水体中 的反应原理如图2所示。作负极的物质是 , 正极的电极反应式是。