江苏省无锡市和桥联盟2021-2022学年九年级上学期化学10月月考试卷
试卷更新日期:2021-10-18 类型:月考试卷
一、单选题
-
1. 我们生活在绚丽多彩的物质世界里,下列色彩是由化学变化呈现出来的是( )A、夜晚霓虹灯 B、雨后彩虹 C、节日的焰火礼花 D、五彩色粉笔2. 科技发展日新月异。以下研究领域,不属于化学学科研究范畴的是( )A、合成药物 B、生产化肥 C、探索材料 D、测定气温3. 下列仪器在实验时,不宜用作反应容器的是( )A、烧杯 B、集气瓶 C、试管 D、量筒4. 最早用实验的方法测定空气中氧气含量的科学家是( )A、牛顿 B、拉瓦锡 C、道尔顿 D、屠呦呦5. 下列物质在氧气中燃烧,火星四射,有黑色固体生成的是( )A、铁丝 B、硫 C、红磷 D、木炭6. 下列物质是由原子构成的是( )A、汞 B、氧气 C、氧化汞 D、水7. 空气的下列成分中,常用作食品包装袋内的保护气的是( )A、氮气 B、水蒸气 C、氧气 D、稀有气体8. 下列图示操作正确的( )A、
 液体读数
B、
液体读数
B、 滴加液体
C、
滴加液体
C、 取用粉末固体
D、
取用粉末固体
D、 倾倒液体
9. 在化学实验中,用剩下的药品应该( )A、放入指定的容器内 B、带出实验室 C、倒入下水道 D、放入原试剂瓶10. 人呼出的气体和吸入的空气相比,明显增加的是( )A、O2 B、CO2和H2O C、N2 D、O2和CO211. 下列不属于缓慢氧化的一项是( )A、酿酒 B、金属器皿锈蚀 C、有机肥腐熟 D、白磷燃烧12. 下列物质中,含有氧气分子的是( )A、氯酸钾 B、空气 C、二氧化碳 D、过氧化氢13. 下列物质鉴别方法错误的一组是( )A、N2和CO2——燃着的木条 B、空气和氧气——带火星的木条 C、氯酸钾和二氧化锰——观察颜色 D、白酒和白醋——闻气味14. 下列物质的用途主要由化学性质决定的是( )A、用铜丝做导线 B、用液氮冷冻麻醉 C、用天然气做燃料 D、用铁锅炒菜15. 下图是某反应的微观过程,下列说法正确的是( )
倾倒液体
9. 在化学实验中,用剩下的药品应该( )A、放入指定的容器内 B、带出实验室 C、倒入下水道 D、放入原试剂瓶10. 人呼出的气体和吸入的空气相比,明显增加的是( )A、O2 B、CO2和H2O C、N2 D、O2和CO211. 下列不属于缓慢氧化的一项是( )A、酿酒 B、金属器皿锈蚀 C、有机肥腐熟 D、白磷燃烧12. 下列物质中,含有氧气分子的是( )A、氯酸钾 B、空气 C、二氧化碳 D、过氧化氢13. 下列物质鉴别方法错误的一组是( )A、N2和CO2——燃着的木条 B、空气和氧气——带火星的木条 C、氯酸钾和二氧化锰——观察颜色 D、白酒和白醋——闻气味14. 下列物质的用途主要由化学性质决定的是( )A、用铜丝做导线 B、用液氮冷冻麻醉 C、用天然气做燃料 D、用铁锅炒菜15. 下图是某反应的微观过程,下列说法正确的是( ) A、反应物属于混合物 B、该反应属于化合反应 C、氧分子由氧原子构成,氧原子是保持氧气化学性质的最小粒子 D、化学反应过程的实质是分子破裂、原子重新组合16. 关于催化剂,下列说法正确的是( )A、在化学反应前后化学性质发生了改变 B、一定能加快反应速率 C、反应前后质量一定不变 D、二氧化锰是所有反应的催化剂17. 用托盘天平称量5.2克药品,天平调平后,在称量过程中,发现指针向左偏移,此时应( )A、增加砝码 B、添加药品 C、减少药品 D、调节平衡螺丝18. 化学反应之间、化学物质之间具有包含、并列、交叉等关系。下表中X、Y符合下图所示关系的是( )
A、反应物属于混合物 B、该反应属于化合反应 C、氧分子由氧原子构成,氧原子是保持氧气化学性质的最小粒子 D、化学反应过程的实质是分子破裂、原子重新组合16. 关于催化剂,下列说法正确的是( )A、在化学反应前后化学性质发生了改变 B、一定能加快反应速率 C、反应前后质量一定不变 D、二氧化锰是所有反应的催化剂17. 用托盘天平称量5.2克药品,天平调平后,在称量过程中,发现指针向左偏移,此时应( )A、增加砝码 B、添加药品 C、减少药品 D、调节平衡螺丝18. 化学反应之间、化学物质之间具有包含、并列、交叉等关系。下表中X、Y符合下图所示关系的是( ) A、X是氦气,Y是稀有气体 B、X是纯净物,Y是混合物 C、X是化合反应,Y是分解反应 D、X是化合反应,Y是氧化反应19. 化学实验操作中常常有许多“先后”之分,否则就会出现事故或者使实验失败,下列实验操作的先后顺序错误的( )A、实验室制取氧气时,先检查装置的气密性,后装入药品 B、用排水法收集氧气时,先熄灭酒精灯,后移出导气管 C、实验室制取氧气,加热时应先使试管底部均匀受热,后固定在药品部位加热 D、用滴管吸取液体时,先在空气中挤捏胶帽排出空气,后伸入液体中吸取20. 下列各图所示装置的气密性检查中,漏气的是( )A、
A、X是氦气,Y是稀有气体 B、X是纯净物,Y是混合物 C、X是化合反应,Y是分解反应 D、X是化合反应,Y是氧化反应19. 化学实验操作中常常有许多“先后”之分,否则就会出现事故或者使实验失败,下列实验操作的先后顺序错误的( )A、实验室制取氧气时,先检查装置的气密性,后装入药品 B、用排水法收集氧气时,先熄灭酒精灯,后移出导气管 C、实验室制取氧气,加热时应先使试管底部均匀受热,后固定在药品部位加热 D、用滴管吸取液体时,先在空气中挤捏胶帽排出空气,后伸入液体中吸取20. 下列各图所示装置的气密性检查中,漏气的是( )A、 B、
B、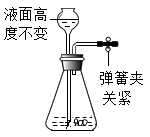 C、
C、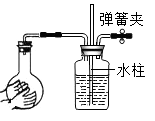 D、
D、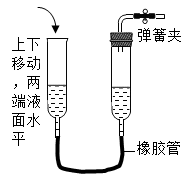
二、填空题
-
21. 空气是宝贵的自然资源。(1)、空气的成分中能用于制取硝酸和氮肥的是。(填序号)
a.氧气 b.氮气 c.稀有气体
(2)、下列气体最适宜用于节日中填充大量气球的是。(填序号)a.氦气 b.二氧化碳 c.氧气
(3)、下列物质不属于空气污染物的是。(填序号)a.二氧化硫 b.二氧化碳 c.二氧化氮
22. 请沿用科学家认识事物的方式认识“空气”,并完成下列问题。(1)、微观角度,用“ ”表示氮原子,“
”表示氮原子,“  ”表示氧原子。同温同压下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,可表示空气微观模型的是______(填字母标号)。 A、
”表示氧原子。同温同压下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,可表示空气微观模型的是______(填字母标号)。 A、 B、
B、 C、
C、 (2)、变化角度。硫在空气中燃烧能生成一种有刺激性气味的气体,该反应的文字表达式为。(3)、应用角度。
(2)、变化角度。硫在空气中燃烧能生成一种有刺激性气味的气体,该反应的文字表达式为。(3)、应用角度。①PM2.5是指大气中小于或等于2.5微米的颗粒物。使用下列交通工具不会增加PM2.5的是(填序号)。
A.共享单车 B.柴油汽车 C.摩托车 D.电动汽车
②“人造空气”帮助人类实现了“太空漫步”的梦想,其中含有70%的N2、20%以上的O2、还有CO2等。下列说法正确的是(填字母)。
A.“人造空气”比空气中的氮气含量高
B.燃着的蜡烛在“人造空气”中会熄灭
C.可以采用测定空气里氧气含量的方法,测定“人造空气”中氧气的含量
D.“人造空气”若只含有O2会更有益于人的呼吸
23. 学好化学,科学防疫,根据所学知识回答下列问题。(1)、到校后消毒,过氧乙酸是一种有效的新型冠状病毒消毒试剂,教室里喷洒后,同学们能够闻到特殊气味,说明分子具有的性质是。(2)、用于手部消毒的医用酒精是体积分数为75%的酒精溶液。①酒精在空气中燃烧生成水和二氧化碳气体。用酒精消毒时,要注意安全,远离火源,酒精燃烧的文字表达式为。
②储存酒精的仓库,要张贴的安全标志是(填字母序号)。
 24. 小华同学在准备“对蜡烛及其燃烧的探究活动”时,发现实验室有许多用剩下的小蜡烛头,感觉浪费了太可惜。于是带领实验小组的同学自己动手用小蜡烛头为原料制造蜡烛,过程如下:
24. 小华同学在准备“对蜡烛及其燃烧的探究活动”时,发现实验室有许多用剩下的小蜡烛头,感觉浪费了太可惜。于是带领实验小组的同学自己动手用小蜡烛头为原料制造蜡烛,过程如下: (1)、蜡烛能用小刀切割成型,说明蜡烛具有物理性质是:硬度。(2)、切下的小蜡烛块放入水中,发现它浮于水面,说明蜡烛的密度比水。(3)、用一个干而冷的烧杯罩在蜡烛火焰的上方(如图),观察到的现象是:烧杯内壁出现;若将烧杯内壁用澄清的石灰水润湿后罩在火焰上方,观察到的现象是:。
(1)、蜡烛能用小刀切割成型,说明蜡烛具有物理性质是:硬度。(2)、切下的小蜡烛块放入水中,发现它浮于水面,说明蜡烛的密度比水。(3)、用一个干而冷的烧杯罩在蜡烛火焰的上方(如图),观察到的现象是:烧杯内壁出现;若将烧杯内壁用澄清的石灰水润湿后罩在火焰上方,观察到的现象是:。 (4)、吹灭蜡烛时,看到从烛芯处飘出一缕 , 用带火苗的小木条迅速去点,发现它能燃烧且蜡烛被重新点燃,据此判断烛芯处飘出的物质具有性。25. 工业上制取氧气常见的有“深冷法”和“变压吸附法”。
(4)、吹灭蜡烛时,看到从烛芯处飘出一缕 , 用带火苗的小木条迅速去点,发现它能燃烧且蜡烛被重新点燃,据此判断烛芯处飘出的物质具有性。25. 工业上制取氧气常见的有“深冷法”和“变压吸附法”。
 (1)、“深冷法”(如图1)是先将空气在一定条件下液化,再利用氮气和氧气的不同将其气化分离。(2)、将燃着的木条置于盛满液态空气的集气瓶口,观察到的现象是。将该集气瓶放置一段时间后,液态物质剩余约1/10体积时,其主要成分是。(3)、“变压吸附法”(如图2)是利用分子筛吸附氮气和氧气能力的差异,通过增压与减压的交替循环,实现氮气和氧气的分离。
(1)、“深冷法”(如图1)是先将空气在一定条件下液化,再利用氮气和氧气的不同将其气化分离。(2)、将燃着的木条置于盛满液态空气的集气瓶口,观察到的现象是。将该集气瓶放置一段时间后,液态物质剩余约1/10体积时,其主要成分是。(3)、“变压吸附法”(如图2)是利用分子筛吸附氮气和氧气能力的差异,通过增压与减压的交替循环,实现氮气和氧气的分离。①变压吸附法制取的氧气是(填“混合物”或“纯净物”)。
②用分子筛吸附氮气发生的是(填“物理”或“化学”)变化。
③分子筛对氮气的吸附能力与吸附塔内气体的有关。
④分子筛(填“可以”或“不可以”)重复使用。
(4)、工业上不用过氧化氢或高锰酸钾分解制取氧气的原因是。三、综合题
-
26. 阅读下列科普短文,回答问题
碳捕捉与封存技术
“碳捕捉与封存”是我国的一项先进技术(如图所示)。

我国能源消耗的70%来自于煤炭。每秒有100吨煤在燃烧,年消耗量超过30亿吨。
如果任由煤炭资源在诸多领域利用,将对大气、河流、土地产生污染,温室效应增强。实现节能减排、绿色环保,我国政府举全国之力,积极倡导并大力发展新的绿色经济。比如:电厂中的煤在极高的温度下充分燃烧,会产生大量的CO2 , 每年的排放量大约1600万吨,运用“碳捕捉与封存”技术,这些CO2将不会进入大气。被封存的CO2有许多用途,如用于食品保鲜、气体肥料、冷藏食物、物品灭火等,以此来消除资源的巨大浪费。我国正以超世界一流的目光发展经济,完善环保体制。
阅读文本,完成下列任务:
(1)、二氧化碳由(填微粒的名称)构成。(2)、“碳捕捉与封存”技术有利于控制的增强。(3)、煤(主要成分是碳)在高温下充分燃烧,发生反应的文字表达为。(4)、将分离聚集的CO2压入地下的过程中,分子间隔会。(5)、将CO2封入蓄水层中发生反应的表达式为:CO2+H2O→H2CO3 , 该反应的基本反应类型是。(6)、干冰是固态的CO2 , 在空气中易升华,常用于冷藏食物。干冰用于冷藏食物的原理是。(7)、“碳捕捉与封存”技术的先进之处是。27. 化学兴趣小组对氧气的制取进行了如下探究。(1)、实验室制取氧气。
①写出上图所示装置中标号仪器的名称:a。
②实验室中用过氧化氢制取氧气,发生反应的文字表达式为;选择的发生装置是 , 若要收集较纯净的氧气,收集装置是。
(2)、探究影响过氧化氢溶液分解速率的因素。实验装置如下图所示,夹持仪器已略,实验数据见下表。
实验序号
1
2
3
4
5
6
过氧化氢溶液的浓度
30%
30%
15%
30%
30%
30%
过氧化氢溶液的体积(mL)
6
x
6
6
6
6
水槽中水的温度(C)
20
90
70
70
20
20
锥形瓶中的物质
0.5gNaCl
05gFeCl3
60分内产生氧气(mL)
0.0
41.0
4.5
12.1
2.0
650.0
①实验2中应加入过氧化氢溶液的体积x是mL。
②实验1~6通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定来比较过氧化氢的分解速率。
③得出“过氧化氢溶液的浓度越大,分解速率越大”结论所依据的实验是(填序号)。
④通过实验1、2、4可得出的结论是。
⑤向实验2收集的氧气中插入带火星木条,木条没有复燃,你认为可能的原因是。
28. “富氧空气”是指氧气含量高于普通空气的气体,可用于航天、医疗、炼钢等。“新型肺炎”重症患者的治疗上有一个重要环节为“高流氧呼吸”,其本质也和“富氧空气”差不多,化学兴趣小组欲混制“富氧空气”并开展相关探究,进行以下实验。(1)、实验一:混制“富氧空气”。用高锰酸钾制取氧气,反应的文字表达式为。
(2)、如图1,用纯氮气及上述实验制取的氧气,混制一瓶(集气瓶容积为250mL)氧气体积分数为40%的“富氧空气”,气体应从装置中的管(选“a”或“b”)通入,先通入氮气排出120 mL水,再通入氧气排出mL水。 (3)、实验二:测定“富氧空气”中氧气的含量。
(3)、实验二:测定“富氧空气”中氧气的含量。用图2装置测定“富氧空气”中氧气的含量(集气瓶中“富氧空气”体积为100 mL,底部残留少量水,燃烧匙内有足量红磷),操作如下。
①往量筒内加入适量水,读出量筒内水的体积为80 mL;
②用电点火装置点燃红磷,充分反应;
③打开止水夹,待右侧量筒内液面不再变化时,排出气球中的气体,调节两边液面在同一水平面上,读出量筒内水的体积为38 mL。
回答问题:
实验前,检查装置气密性的方法:。
(4)、操作②中可观察到现象:。(5)、本次实验测得“富氧空气”中氧气的含量为。(6)、若操作①量筒读数时仰视,操作③量筒读数时俯视,则测得实验结果(选填“偏大”“偏小”或“无影响”)。(7)、实验三:研究“富氧空气”的应用通过重油、褐煤在氧气含量不同的空气中燃烧的实验,得到有关数据如下图:

结合图3,说明空气中氧气含量与燃烧产生的温度的关系:。
(8)、结合图4,简述减少燃料燃烧尾气污染的措施:。(9)、实验四:空气中氧气含量的再探究化学兴趣小组想探究用不同物质在空气中燃烧测定氧气含量方法的优劣。他们用足量的蜡烛、红磷和白磷分别在相同体积与状态的空气中燃烧,用氧气探测器测定容器中剩余氧气与时间的关系如图5。下列说法正确的是______。

 A、测定空气中氧气含量效果最好的是蜡烛,因为它反应速率快 B、该实验证明氧气的浓度较低时,红磷与白磷还能与之发生反应 C、三个均为氧气过量 D、若用这三种物质做实验,测得空气中氧气含量偏高
A、测定空气中氧气含量效果最好的是蜡烛,因为它反应速率快 B、该实验证明氧气的浓度较低时,红磷与白磷还能与之发生反应 C、三个均为氧气过量 D、若用这三种物质做实验,测得空气中氧气含量偏高