浙教版科学九年级上册第二章 物质转化与材料利用 夯实基础练习题
试卷更新日期:2021-10-18 类型:单元试卷
一、单选题
-
1. 如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
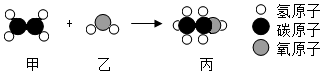 A、该反应属于化合反应 B、甲、乙、丙都是有机物 C、该反应中参加反应的甲和乙质量比为1:1 D、该反应在反应前后原子的种类发生了改变2. 铕(Eu)是非常活泼的金属,能与冷水反应,应保存在氩气中。铕与水反应的化学方程式为:Eu+2H2O=Eu(OH)2↓+H2↑。该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应3. 下列各组物质中,前一种是混合物,后一种是化合物的是( )。A、石灰水和氯化钠 B、硫酸和氧气 C、铁粉和氢氧化钠 D、红磷和干冰4. 读碳和碳的化合物间的转化关系图,下列有关说法正确的是( )
A、该反应属于化合反应 B、甲、乙、丙都是有机物 C、该反应中参加反应的甲和乙质量比为1:1 D、该反应在反应前后原子的种类发生了改变2. 铕(Eu)是非常活泼的金属,能与冷水反应,应保存在氩气中。铕与水反应的化学方程式为:Eu+2H2O=Eu(OH)2↓+H2↑。该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应3. 下列各组物质中,前一种是混合物,后一种是化合物的是( )。A、石灰水和氯化钠 B、硫酸和氧气 C、铁粉和氢氧化钠 D、红磷和干冰4. 读碳和碳的化合物间的转化关系图,下列有关说法正确的是( )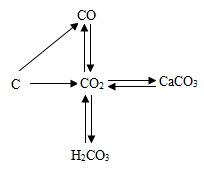 A、“C→CO”的反应中碳发生还原反应 B、“CO→CO2“的反应类型为置换反应 C、“CO2→CaCO3"的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试液验证5. 用下列试剂中的一种试剂就能将 AgNO3、Na2CO3和NaCl这三种无色溶液一一区别开来,这种试剂是( )。A、稀盐酸 B、NaOH溶液 C、BaCl2溶液 D、KNO3溶液6. 下列实验 ,不能达到实验目的的是( )。A、用酚酞试液鉴别稀硫酸和氯化钠溶液 B、用燃着的木条置于集气瓶口检验CO2是否集满 C、检验未知溶液是否含有Cl- , 先加AgNO3溶液,再加稀硝酸 D、用锌粒和稀硫酸反应制取氢气7. 现代社会生产的新型陶瓷材料层出不穷,如用氧化铝等原料生产的陶瓷已被应用于制造发动机。下列有关氧化铝陶瓷的说法,错误的是( )。A、该陶瓷属于有机合成材料 B、该陶瓷耐高温,强度高 C、该陶瓷中的原料氧化铝属于金属氧化物 D、该陶瓷由于含有氧化铝,所以耐酸碱性不强8. 下列制:备物质的方案中,正确的是( )。A、CaO Ca(OH)2溶液 NaOH溶液 B、Cu CuO CuSO4溶液 C、Fe FeCl3溶液 Fe(OH)3沉淀 D、H2 HCl NaCl溶液9. 下列物质之间的转化不能一步实现的是( ) 。A、Fe2O3→Fe B、CuO→Cu(OH)2 C、CaO→Ca(OH)2 D、MgO→MgCl210. 溶质质量分数为75%的酒精溶液是常用的消毒用品,下列关于该酒精溶液的说法中,错误的是( )A、是一种混合物 B、100克的该溶液中有酒精75克 C、是由氢元素和氧元素组成的 D、不密封保存,溶液的溶质质量分数会变小11. 下列各组物质的鉴别方法错误的是( )A、CaCl2、CaCO3: 加水,观察能否被水溶解 B、CO2、O2:用燃着的木条检验,观察木条的燃烧情况 C、浓H2SO4、稀H2SO4:打开瓶盖,观察是否有白雾 D、CaO、NH4NO3:向分别装有两种药品的烧杯中加水,用手感知烧杯外壁的温度12. 下列各组物质鉴别方案的描述,错误的是( )A、KNO3、Na2SO4、Ba(OH)2、MgCl2四种溶液,需另加试剂方可鉴别, B、FeCl2、HCl、KOH、NaCl 四种溶液,利用组内物质即可鉴别 C、Na2CO3、NH4NO3、Ba(OH)2、NaCl四种固体,利用水及组内物质都无法鉴别 D、NaCl、NaOH、CaO、CuSO4四种固体,只用适量水即可鉴别13. 如图为一氧化碳还原氧化铜的实验装置。下列说法正确的是( )
A、“C→CO”的反应中碳发生还原反应 B、“CO→CO2“的反应类型为置换反应 C、“CO2→CaCO3"的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试液验证5. 用下列试剂中的一种试剂就能将 AgNO3、Na2CO3和NaCl这三种无色溶液一一区别开来,这种试剂是( )。A、稀盐酸 B、NaOH溶液 C、BaCl2溶液 D、KNO3溶液6. 下列实验 ,不能达到实验目的的是( )。A、用酚酞试液鉴别稀硫酸和氯化钠溶液 B、用燃着的木条置于集气瓶口检验CO2是否集满 C、检验未知溶液是否含有Cl- , 先加AgNO3溶液,再加稀硝酸 D、用锌粒和稀硫酸反应制取氢气7. 现代社会生产的新型陶瓷材料层出不穷,如用氧化铝等原料生产的陶瓷已被应用于制造发动机。下列有关氧化铝陶瓷的说法,错误的是( )。A、该陶瓷属于有机合成材料 B、该陶瓷耐高温,强度高 C、该陶瓷中的原料氧化铝属于金属氧化物 D、该陶瓷由于含有氧化铝,所以耐酸碱性不强8. 下列制:备物质的方案中,正确的是( )。A、CaO Ca(OH)2溶液 NaOH溶液 B、Cu CuO CuSO4溶液 C、Fe FeCl3溶液 Fe(OH)3沉淀 D、H2 HCl NaCl溶液9. 下列物质之间的转化不能一步实现的是( ) 。A、Fe2O3→Fe B、CuO→Cu(OH)2 C、CaO→Ca(OH)2 D、MgO→MgCl210. 溶质质量分数为75%的酒精溶液是常用的消毒用品,下列关于该酒精溶液的说法中,错误的是( )A、是一种混合物 B、100克的该溶液中有酒精75克 C、是由氢元素和氧元素组成的 D、不密封保存,溶液的溶质质量分数会变小11. 下列各组物质的鉴别方法错误的是( )A、CaCl2、CaCO3: 加水,观察能否被水溶解 B、CO2、O2:用燃着的木条检验,观察木条的燃烧情况 C、浓H2SO4、稀H2SO4:打开瓶盖,观察是否有白雾 D、CaO、NH4NO3:向分别装有两种药品的烧杯中加水,用手感知烧杯外壁的温度12. 下列各组物质鉴别方案的描述,错误的是( )A、KNO3、Na2SO4、Ba(OH)2、MgCl2四种溶液,需另加试剂方可鉴别, B、FeCl2、HCl、KOH、NaCl 四种溶液,利用组内物质即可鉴别 C、Na2CO3、NH4NO3、Ba(OH)2、NaCl四种固体,利用水及组内物质都无法鉴别 D、NaCl、NaOH、CaO、CuSO4四种固体,只用适量水即可鉴别13. 如图为一氧化碳还原氧化铜的实验装置。下列说法正确的是( ) A、实验中可观察到玻璃管中的黑色固体变红色 B、该实验说明一氧化碳具有还原性,没有可燃性 C、该实验只能通过澄清石灰水是否变浑浊来判断反应是否发生 D、为防止发生爆炸,实验前应先加热玻璃管,再通入CO气体14. 物质的鉴别是重要的实验技能,下列实验方案正确的是( )
A、实验中可观察到玻璃管中的黑色固体变红色 B、该实验说明一氧化碳具有还原性,没有可燃性 C、该实验只能通过澄清石灰水是否变浑浊来判断反应是否发生 D、为防止发生爆炸,实验前应先加热玻璃管,再通入CO气体14. 物质的鉴别是重要的实验技能,下列实验方案正确的是( )选项
实验目的
实验方案
A
鉴别AgNO3和K2CO3固体
取样,加水溶解,滴加BaCl2溶液,观察是否有白色沉淀
B
鉴别NH4HCO3和尿素
取样,加入熟石灰粉末、研磨、闻气味
C
鉴别酒精和水
分别用玻璃棒蘸取少量放在嘴尝味道
D
鉴别CuO粉末和炭粉
观察颜色
A、A B、B C、C D、D15. 某同学利用如图装置测定CuO样品中氧化铜的质量分数,已知实验中CuO样品的质量为15g,样品中CuO反应完全,杂质不参与反应,U形管中干燥剂足量且吸收完全,该小组经过规范的实验操作后得到了如表所示的实验数据:
反应前
反应后
①B装置的质量/g
45.5
43.9
②C装置的质量/g
100.5
103.2
有关该实验的说法中正确的是( )
A、实验时应先点燃酒精灯,再通入H2 B、该实验缺少尾气处理装置 C、完全反应后B中减少的质量等于反应生成水的质量 D、选用第①组数据计算氧化铜的质量分数得到的结果更准确16. 向一定质量的Na2CO3和Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法符合反应事实的是( ) A、在0~a段发生3个化学反应 B、c点的沉淀是BaSO4 C、图中m点的值是2.33 D、取d点对应的溶液,滴加硝酸银溶液,有白色沉淀,说明加入的盐酸已过量17. 萨罗(Salon)是一种重要的消毒剂,其分子的微观结构模型如图。下列关于萨罗的说法错误的是( )
A、在0~a段发生3个化学反应 B、c点的沉淀是BaSO4 C、图中m点的值是2.33 D、取d点对应的溶液,滴加硝酸银溶液,有白色沉淀,说明加入的盐酸已过量17. 萨罗(Salon)是一种重要的消毒剂,其分子的微观结构模型如图。下列关于萨罗的说法错误的是( )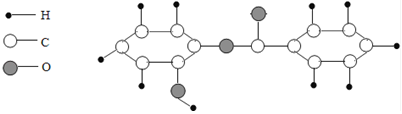
①该物质的一个分子由二十六个原子构成 ②该物质是氧化物
③该物质中碳、氧元素的质量比是156:48 ④该物质的相对分子质量是214g
⑤该物质是有机高分子化合物 ⑥该物质由碳、氢、氧三个元素组成
⑦该物质的化学式为C13H10O3
A、①②④⑤ B、④⑤⑥⑦ C、①②③⑦ D、②④⑤⑥18. 氢气和一氧化碳还原氧化铜的实验装置如图所示,下列说法不正确的是( ) A、实验时都应该先通入气体一段时间后再加热,防止发生爆炸 B、甲试管口略向下倾斜,乙玻璃管保持水平,主要是因为两种气体的密度不同 C、两者都可以通过观察黑色固体颜色的变化判断反应是否发生 D、乙中有尾气处理装置,是因为一氧化碳有毒19. 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )A、
A、实验时都应该先通入气体一段时间后再加热,防止发生爆炸 B、甲试管口略向下倾斜,乙玻璃管保持水平,主要是因为两种气体的密度不同 C、两者都可以通过观察黑色固体颜色的变化判断反应是否发生 D、乙中有尾气处理装置,是因为一氧化碳有毒19. 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )A、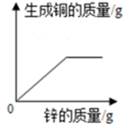 B、
B、 C、
C、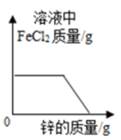 D、
D、 20. 某固体由Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5g白色沉淀。
20. 某固体由Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5g白色沉淀。②在沉淀中加入过量稀硝酸,仍有3g白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有( )
A、Na+、 、 B、Cu2+、 、 C、Cl-、 、 D、Na+、Ba2+、Cl-二、填空题
-
21. 有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。

则:
(1)、无色溶液A中一定含有的溶质是。(2)、白色粉末的成分是。22. 有一包白色固体,可能由硫酸钾、氢氧化钾、碳酸钙.氯化钡中的一种或几种物质组成。为探究该白色固体的组成,某小组取适量样品按图示流程进行实验。请回答下列问题。 (1)、白色沉淀Ⅰ与稀盐酸反应的化学方程式:。(2)、白色沉淀Ⅱ的化学式:。(3)、原白色固体中含有的物质:。23. 有甲、乙、丙、丁四种物质,已知乙为黑色固体,丁为一种蓝色不溶于水的固体。四种物质之间能发生如图所示的转化,据此做出推断。
(1)、白色沉淀Ⅰ与稀盐酸反应的化学方程式:。(2)、白色沉淀Ⅱ的化学式:。(3)、原白色固体中含有的物质:。23. 有甲、乙、丙、丁四种物质,已知乙为黑色固体,丁为一种蓝色不溶于水的固体。四种物质之间能发生如图所示的转化,据此做出推断。 (1)、甲、乙、丙、丁这四种物质,分别是甲 , 乙 , 丙 , 丁。(2)、Y物质可能是。24. 现有4瓶固体药品,标签上贴着A、B、C、D的编号,已知每瓶中放有硫酸铜、碳酸钠、硝酸钾和氯化钠中的某一种物质,各取少量放在4支试管中,分别加入水后,A溶液呈蓝色;再在另3支试管中分别加入盐酸,发现B溶液中产生气泡;另取2支试管分别加入C和D瓶中的物质,加水溶解后滴入硝酸银溶液,发现C溶液中出现白色沉淀。根据上述实验现象,请判断并写出4瓶药品的物质名称。
(1)、甲、乙、丙、丁这四种物质,分别是甲 , 乙 , 丙 , 丁。(2)、Y物质可能是。24. 现有4瓶固体药品,标签上贴着A、B、C、D的编号,已知每瓶中放有硫酸铜、碳酸钠、硝酸钾和氯化钠中的某一种物质,各取少量放在4支试管中,分别加入水后,A溶液呈蓝色;再在另3支试管中分别加入盐酸,发现B溶液中产生气泡;另取2支试管分别加入C和D瓶中的物质,加水溶解后滴入硝酸银溶液,发现C溶液中出现白色沉淀。根据上述实验现象,请判断并写出4瓶药品的物质名称。A;B;C;D。
25. 某兴趣小组利用如图所示装置进行实验,探究炼铁的化学原理。 (1)、在点燃酒精喷灯前,先通入一氧化碳的目的是(2)、观察到的现象是。写出一氧化碳和氧化铁反应的化学方程式: .(3)、装置中导管末端加一点燃的酒精灯的目的是26. 请完成下列炼铁的化学方程式。(1)、C+Fe2O3——(2)、C+Fe3O4——(3)、CO+Fe3O4——
(1)、在点燃酒精喷灯前,先通入一氧化碳的目的是(2)、观察到的现象是。写出一氧化碳和氧化铁反应的化学方程式: .(3)、装置中导管末端加一点燃的酒精灯的目的是26. 请完成下列炼铁的化学方程式。(1)、C+Fe2O3——(2)、C+Fe3O4——(3)、CO+Fe3O4——三、实验探究题
-
27. 思维模型的建构既方便于问题的解决,又能促进深度学习。某科学研究小组同学,在研究了气体检验专题内容后,认为气体检验的关键是干扰气体的界定,判断标准是对后续实验是否会产生干扰。于是在老师的指导下对解决“气体检验”类问题建构了如下思维模型:

【模型应用】同学们为检验天然气燃烧后的气体产物成分,应用思维模型设计了如图甲实验方案(固定装置未画出),将天然气在氧气中燃烧后得到的混合气体通过该方案进行实验。
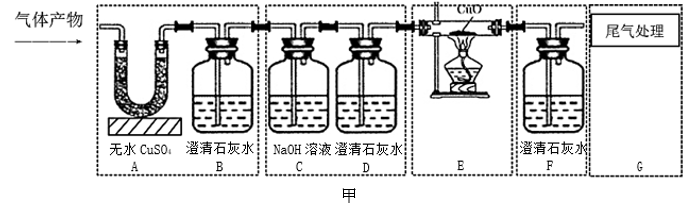 (1)、实验过程中观察到A装置中的无水硫酸铜变蓝,B、F装置中的澄清石灰水均变浑浊,D装置中的澄清石灰水不变浑浊,由此可得出该气体产物的成分为;(2)、图甲实验方案中,装置C和D归属于上述思维模型中的环节;(3)、【改进创新】小金同学认为,原气体产物中的CO2对CO的检验不会产生干扰,于是从简约装置、节约实验药品的角度出发,对图甲方案进行了改进与创新,去掉B、C、D装置,替换F、G装置,改用图乙所示的装置对该气体产物的成分进行探究。在实验中,小金先从A处通一段时间混合气体,再点燃E处酒精灯加热,观察现象,也实现了气体产物成分的检验。
(1)、实验过程中观察到A装置中的无水硫酸铜变蓝,B、F装置中的澄清石灰水均变浑浊,D装置中的澄清石灰水不变浑浊,由此可得出该气体产物的成分为;(2)、图甲实验方案中,装置C和D归属于上述思维模型中的环节;(3)、【改进创新】小金同学认为,原气体产物中的CO2对CO的检验不会产生干扰,于是从简约装置、节约实验药品的角度出发,对图甲方案进行了改进与创新,去掉B、C、D装置,替换F、G装置,改用图乙所示的装置对该气体产物的成分进行探究。在实验中,小金先从A处通一段时间混合气体,再点燃E处酒精灯加热,观察现象,也实现了气体产物成分的检验。
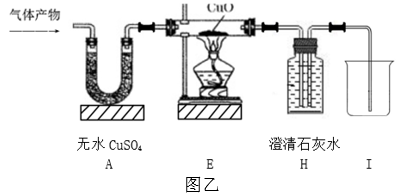
实验中,小金在加热前先通一段时间的混合气体,其目的是;(4)、实验中,判断E中玻璃管内空气已排净的实验现象是。28. 废旧金属可以回收利用,用合金废料(含Fe、Cu)制取FeSO4和CusO4溶液的实验流程如下(部分生成物省略): (1)、合金属于(填“纯净物“或“混合物”)。(2)、由Cu制取CuSO4溶液有以下两种途径:
(1)、合金属于(填“纯净物“或“混合物”)。(2)、由Cu制取CuSO4溶液有以下两种途径:Ⅰ.Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
Ⅱ.2Cu+O2 2CuO CuO+H2SO4=CuSO4+H2O
从两种途径可以看出,通常情况下不反应的两种物质,在改变和后,也可以发生反应。相对于第二种方法,第一种方法的不足之处是 , (写两点)。
29. 铁在自然界中以铁矿石形式分布很广。资料显示:在炼铁过程中,Fe2O3是在一定温度下逐步失去其中的氧,依次生成Fe3O4、FeO和Fe。小科在实验室找到一些铁锈样品进行实验探究,他所用的实验装置如图甲所示。 (1)、实验时先点燃的酒精灯是。(选填“A”或“B”)(2)、待反应完成后,将所得黑色固体物质放入足量的稀硫酸中,小金认为该物质中并不含铁,他的依据是。(3)、为了解释这一反常现象,他查到某炼铁厂对氧化铁和一氧化碳进行的热反应分析,根据相关的数据绘制图像如图乙,通过分析确定实验没有得到铁的主要原因可能是。30. 某同学偶然发现,将高锰酸钾溶液和过氧化氢溶液混合,会有大量气泡产生,静置一段时间后观察到有黑色沉淀生成。该同学为了探究反应后生成物的成分,进行了如下实验:
(1)、实验时先点燃的酒精灯是。(选填“A”或“B”)(2)、待反应完成后,将所得黑色固体物质放入足量的稀硫酸中,小金认为该物质中并不含铁,他的依据是。(3)、为了解释这一反常现象,他查到某炼铁厂对氧化铁和一氧化碳进行的热反应分析,根据相关的数据绘制图像如图乙,通过分析确定实验没有得到铁的主要原因可能是。30. 某同学偶然发现,将高锰酸钾溶液和过氧化氢溶液混合,会有大量气泡产生,静置一段时间后观察到有黑色沉淀生成。该同学为了探究反应后生成物的成分,进行了如下实验: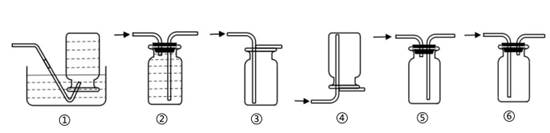 (1)、该同学用集气瓶收集实验产生的气体,然后用带火星的木条靠近瓶口,木条复燃。可用于收集该气体的装置有 。(2)、待两种溶液恰好完全反应后,过滤出沉淀得到黑色粉末和无色滤液,经检测这种黑色粉末是二氧化锰。
(1)、该同学用集气瓶收集实验产生的气体,然后用带火星的木条靠近瓶口,木条复燃。可用于收集该气体的装置有 。(2)、待两种溶液恰好完全反应后,过滤出沉淀得到黑色粉末和无色滤液,经检测这种黑色粉末是二氧化锰。为研究上述实验后滤液中的成分,查阅资料后得知:锰酸钾溶液呈墨绿色,含有钾离子的溶液在无色火焰上灼烧呈紫色,含有锰离子的溶液在无色火焰上灼烧呈黄绿色。该同学又设计了如下步骤:
①取少量滤液于试管中,滴加硫酸铜溶液,有蓝色絮状沉淀生成。
②用洁净的铂丝蘸取剩余溶液,在无色火焰上灼烧,观察到火焰颜色为紫色。设计步骤①的作用是 , 由此推测出滤液中一定含有的溶质是。
31. 某小组学生发现有一包固体粉末,可能由CaCO3、CuCl2、Na2SO4、NaOH、Na2CO3中的几种组成。为确定其组成,该小组进行了如图实验: (1)、上述实验中,操作Ⅰ是。(2)、A物质的化学式为。(3)、该固体粉末中一定含有的物质。(4)、该固体粉末中一定不含有的物质32. 用氢气还原氧化铜的方法测定某氧化铜样品中氧化铜的含量(杂质不与氢气反应),同学们设计了以下实验装置,取一定量干燥样品进行实验。
(1)、上述实验中,操作Ⅰ是。(2)、A物质的化学式为。(3)、该固体粉末中一定含有的物质。(4)、该固体粉末中一定不含有的物质32. 用氢气还原氧化铜的方法测定某氧化铜样品中氧化铜的含量(杂质不与氢气反应),同学们设计了以下实验装置,取一定量干燥样品进行实验。
请根据题目回答:
(1)、在实验中,乙装置的作用是 , 丙中的现象是。(2)、要得出氧化铜样品中氧化铜的含量,需要准确称取的数据是。(3)、根据以下原因计算,可能导致结果偏大的是____(填字母)。A、装置的气密性不好 B、空气中的水分被丁处浓硫酸吸收 C、通入的氢气量不足 D、氧化铜没有完全被还原四、解答题
-
33. 实验室以氧化铜、铁粉和稀硫酸为原料制备铜。
方法一:氧化铜 硫酸铜溶液 铜
方法二:用铁粉与稀硫酸制得氢气进行如右图的还原氧化铜实验。
(1)、方法一中步骤Ⅱ利用了铁的金属活动性比铜(选填“强”或“弱”)(2)、方法二中实验结束时,先熄灭酒精灯,过一会儿再停止通氢气,其目的是。(3)、通过比较分析,你会采用方法一还是方法二,并说明理由。34. 某些食品包装袋内常放入还原性铁粉作“双吸剂”以防止食品腐败。某课外兴趣小组在实验室发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应。测得部分数据如表,请根据有关信息回答问题实验次数
1
3
4
5
6
取样品质量(g)
31.0
31.0
31.0
31.0
31.0
取稀硫酸质量(g)
30.0
90.0
120.0
150.0
180.0
产生气体质量(g)
0
a
0.3
0.5
0.6
(1)、“双吸剂”的原理是(2)、a的数值为(3)、计算该稀硫酸的溶质质量分数?35. 金属是现代生活和工业生产中应用极为普遍的一类材料。已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究。小金查阅资料得Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应。(1)、请完成证明金属粉末中存在Fe和Cu的实验设计:实验操作
实验现象
结论
Ⅰ取少量的金属粉末于试管中,加入足量的
有气泡产生
仅除去铝
Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸
证明含有铁
Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体
剩余固体呈紫红色
证明含有铜
(2)、为探究该金属粉末中Al的质量分数,取20g该金属粉末,加入氢氧化钠溶液反应,剩余固体质量与所加氢氧化钠溶液的质量关系如图所示,则该金属粉末中Al的质量分数为 多少? 36. 某科学兴趣小组对一份含铁的固体样品进行探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了17.6克固体样品,用图甲所示的装置进行实验,测定的数据如图乙所示。
36. 某科学兴趣小组对一份含铁的固体样品进行探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了17.6克固体样品,用图甲所示的装置进行实验,测定的数据如图乙所示。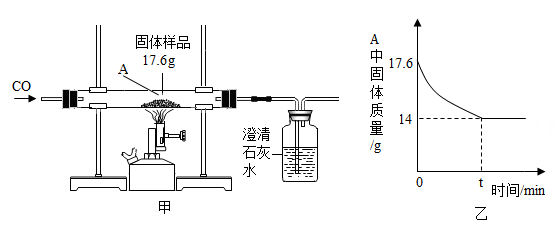 (1)、目前世界上已有50%以上的废钢铁得到回收利用,其目的是。
(1)、目前世界上已有50%以上的废钢铁得到回收利用,其目的是。A.节约金属资源 B.加大矿物开采 C.保护环境
(2)、该实验有明显的不足,应该如何改进。(3)、乙图可知,原样品中含氧元素的质量为g。(4)、某钢铁厂每天消耗5000t含氧化铁84%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?37. 有一包固体粉末,可能是BaCO3 , K2SO4、CuSO4、K2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动。【资料查阅】K2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
【活动与探究】取一定量上述固体粉末,加足量水溶解。
(1)、【现象与结论】经上述操作,得到蓝色澄清溶液,则原固体粉末中一定没有和(填化学式)。(2)、【探索与拓展】为进一步确定原固体粉末的组成,该实验小组同学先用托盘天平称取80g该粉末,溶于水配成300g溶液, 再往其中加入溶质质量分数为8%的NaOH溶液,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。据图回答:
①计算刚好停止产生沉淀时所加NaOH溶液的质量。
②通过计算确定80g固体粉末的组成。(回答出物质组成及其质量)