初中科学浙教版九年级上册专题复习:常见的酸
试卷更新日期:2021-10-17 类型:复习试卷
一、单选题
-
1. 一辆满载浓硫酸的槽罐车在路上因车祸翻倒,浓硫酸大量泄漏,为了不污染旁边的水源,下列采取的措施适宜的是( )A、用水冲洗泄漏的浓硫酸 B、将熟石灰撒在泄漏出的浓硫酸上 C、将氯化钡撒在泄漏出的浓硫酸上 D、用土将泄漏的浓硫酸掩埋2. 小乐完成了图示甲、乙实验后,依次将反应后的溶液缓慢倒入同一洁净的废液缸中,观察到废液缸中先有气泡产生,然后又出现白色沉淀。则下列说法中,正确的是( )
 A、甲实验结束后,试管中的溶液含稀盐酸和CaCl2 B、乙实验结束后,试管中的溶液含稀盐酸和NaCl C、最终,废液缸中一定含NaCl,CaCl2两种溶质 D、最终,废液缸中一定含NaCl,Na2CO3两种溶质3. 下列物质的性质与用途的对应关系正确的是( )
A、甲实验结束后,试管中的溶液含稀盐酸和CaCl2 B、乙实验结束后,试管中的溶液含稀盐酸和NaCl C、最终,废液缸中一定含NaCl,CaCl2两种溶质 D、最终,废液缸中一定含NaCl,Na2CO3两种溶质3. 下列物质的性质与用途的对应关系正确的是( )选项
性质
用途
A
白色硫酸铜粉末遇水会变蓝色
检验水
B
浓硫酸具有脱水性
干燥氧气
C
稀盐酸能与某些金属反应
除铁锈
D
氢氢化钠能与某些金属氧化物反应
吸收二氧化碳
A、A B、B C、C D、D4. 向盛有酚酞和NaOH溶液的烧杯中滴加稀硫酸,直至液体呈无色。为探究反应后溶液中溶质的组成,所选试剂不正确的是( )A、锌粒 B、稀盐酸 C、碳酸钾溶液 D、氧化铜粉末5. 盛石灰水的试剂瓶存放久了,内壁常附有一层白膜,除去这层白膜最合适的试剂是( )A、蒸馏水 B、稀盐酸 C、硫酸铜溶液 D、氢氧化钠溶液6. 用①表示Fe,用②表示Fe2O3用③表示Fe(OH)3。在X+HCl→FeCl3+Y花的反应中(X、Y分别代表一种物质),X可能是( )。A、①② B、②③ C、①③ D、①②③7. 将浓硫酸、浓盐酸敞口放置一段时间,它们的共同变化是( )。A、颜色发生改变 B、发生化学变化 C、质量减少 D、溶质的质量分数变小8. 鉴别稀盐酸和稀硫酸,最佳的试剂是( )。A、紫色石蕊 B、无色酚酞 C、硝酸银溶液 D、氯化钡溶液9. 某品牌爽肤水为蓝色溶液,小明怀疑其含有硫酸铜,欲通过检测硫酸根离子进行初步判断,应选用的试剂是( )A、Ba(NO3)2溶液和稀HNO3 B、紫色石蕊试液 C、NaOH溶液 D、NaCl溶液和稀HNO310. 下列物质中,既不溶于水也不溶于稀硝酸的一组是( )A、CuO、Fe2O3 B、AgCl、BaSO4 C、Cu(OH)2、Fe(OH)3 D、CaCO3、BaCO311. 有一小球(不与接触物反应)悬浮在稀硫酸中,现逐滴加入密度比稀硫酸大得多的氢氧化钡溶液,则小球的运动状况是( ) A、仅上浮 B、仍悬浮 C、仅下沉 D、先下沉后上浮12. 食醋是生活中常用的调味剂,其主要成分是醋酸。由于醋酸的许多化学性质与稀盐酸和稀硫酸相似,在生活中常有许多妙用。食醋在下列应用中,肯定无法实现的是( )A、除去菜刀上的铁锈 B、除去水壶壁上的水垢 C、清除溅到皮肤上的碱液 D、除去铁粉中混有的少量锌粉13. 对如图实验现象分析正确的是( )
A、仅上浮 B、仍悬浮 C、仅下沉 D、先下沉后上浮12. 食醋是生活中常用的调味剂,其主要成分是醋酸。由于醋酸的许多化学性质与稀盐酸和稀硫酸相似,在生活中常有许多妙用。食醋在下列应用中,肯定无法实现的是( )A、除去菜刀上的铁锈 B、除去水壶壁上的水垢 C、清除溅到皮肤上的碱液 D、除去铁粉中混有的少量锌粉13. 对如图实验现象分析正确的是( ) A、打开止水夹,试管Ⅰ中产生气泡,试管Ⅱ中无现象 B、打开止水夹,液体从试管Ⅱ流向试管Ⅰ C、先打开止水夹,稍后关闭,试管Ⅱ中产生白色沉淀 D、先打开止水夹,稍后关闭,试管Ⅰ中反应立即停止14. 一瓶没有塞瓶塞的浓盐酸和一瓶没有盖瓶塞的浓硫酸,一段时间后,下列关于两者溶质质量分数说法正确的是(不考虑水分蒸发)( )A、都变大 B、都变小 C、浓盐酸变小,浓硫酸变大 D、浓盐酸变大,浓硫酸变小15. 如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
A、打开止水夹,试管Ⅰ中产生气泡,试管Ⅱ中无现象 B、打开止水夹,液体从试管Ⅱ流向试管Ⅰ C、先打开止水夹,稍后关闭,试管Ⅱ中产生白色沉淀 D、先打开止水夹,稍后关闭,试管Ⅰ中反应立即停止14. 一瓶没有塞瓶塞的浓盐酸和一瓶没有盖瓶塞的浓硫酸,一段时间后,下列关于两者溶质质量分数说法正确的是(不考虑水分蒸发)( )A、都变大 B、都变小 C、浓盐酸变小,浓硫酸变大 D、浓盐酸变大,浓硫酸变小15. 如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
甲
乙
丙
丁
戊
A
铁
硝酸银
碳酸钙
氢氧化钡
稀盐酸
B
硝酸银
铁
稀盐酸
氢氧化钡
碳酸钙
C
硝酸银
铁
碳酸钙
氢氧化钡
稀盐酸
D
铁
氢氧化钡
碳酸钙
硝酸银
稀盐酸
A、A B、B C、C D、D二、实验探究题
-
16. 某兴趣小组同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口(填物态变化名称)成小水滴。 猜想二:是盐酸小液滴。可能是因为同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小金提出质疑:为什么刚才打开盛放盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾? 小金联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后。(填操作和现象) 得出结论:这种盐酸浓度并不高,是镁和盐酸反应放热促使盐酸形成白雾。
17. 某兴趣小组的同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?(1)、同学们作出猜想猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口成小水滴(填物态变化名称)。
猜想二:是盐酸小液滴。因为浓盐酸具有性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在正在进行镁条和盐酸反应的试管口,试纸变红,证明猜想二是合理的。
(2)、小柯提出质疑为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联想到反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后_(填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是镁条和盐酸反应放热促使盐酸形成白雾。
18. 军军化学兴趣小组的同学想通过实验制备NO气体并验证它的性质。在查阅资料后得知:①NO常温下是一种无色、有毒,难溶于水的气体,②NO常温下能与氧气迅速反应,生成红棕色的NO2气体,NO2能和水反应,3NO2+H2O=2HNO3+NO③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4H2O。他们设计了以下装置图。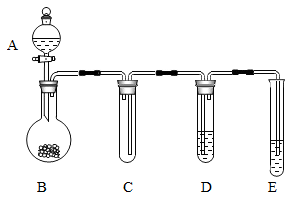 (1)、图中A仪器的名称为。(2)、若试管C中是空气,E为尾气吸收装置,试管D中液体是紫色石蕊溶液,则打开A中活塞后,试管C中的现象是。试管D出现的现象是。(3)、做完本实验后他们讨论以铜和稀硝酸为主要原料制取Cu(NO3)2时设计了两种方案:
(1)、图中A仪器的名称为。(2)、若试管C中是空气,E为尾气吸收装置,试管D中液体是紫色石蕊溶液,则打开A中活塞后,试管C中的现象是。试管D出现的现象是。(3)、做完本实验后他们讨论以铜和稀硝酸为主要原料制取Cu(NO3)2时设计了两种方案:方案一:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4H2O;
方案二:2Cu+O2
 2CuO,CuO+2HNO3=Cu(NO3)2+H2O。
2CuO,CuO+2HNO3=Cu(NO3)2+H2O。你认为以上两种方案中哪一方案更好。并说明理由。(理由答出两点)
19. 小江和小南用稀硫酸与锌制取氢气时,发现添加少量硫酸铜溶液能加快反应.硫酸铜溶液是稀硫酸和锌反应的催化剂吗?硫酸铜溶液量的多少会影响反应速率吗?(1)、他们先进行如图实验,观察到试管B中产生气泡速度快得多,并有暗红色固体生成。A实验的作用是。他们认为CuSO4溶液不是催化剂,所依据的实验现象是。 (2)、在6支试管中分别加入2颗大小形状都相同的锌粒,倒入等质量、等质量分数的稀硫酸;按下表所示 条件进行实验,并测量收集50毫升氢气所用的时间。记录如下:
(2)、在6支试管中分别加入2颗大小形状都相同的锌粒,倒入等质量、等质量分数的稀硫酸;按下表所示 条件进行实验,并测量收集50毫升氢气所用的时间。记录如下:试管
A
B
C
D
E
F
CuSO4溶液/毫升
0
0.5
1
1.5
2
4
水/毫升
4
3.5
3
V1
V2
0
收集H2所用的时间/秒
348
246
190
165
230
360
①试管E中加入水的体积V1=毫升;
②由上表可得出,CuSO4的溶液的量对稀硫酸与锌反应速率影响的变化趋势是。
三、填空题
-
20. 根据图信息回答问题:
 (1)、加入稀盐酸至过量能观察到的现象是 ;(2)、反应中,数目减少的离子是(填离子符号);(3)、验证反应后溶液中稀盐酸有剩余,下列操作可行的是 。A、取样,加入CuO粉末 B、取样;滴加NaOH溶液 C、取样,加入CaCO3粉末 D、取样,滴加AgNO3溶液21. 学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)、加入稀盐酸至过量能观察到的现象是 ;(2)、反应中,数目减少的离子是(填离子符号);(3)、验证反应后溶液中稀盐酸有剩余,下列操作可行的是 。A、取样,加入CuO粉末 B、取样;滴加NaOH溶液 C、取样,加入CaCO3粉末 D、取样,滴加AgNO3溶液21. 学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。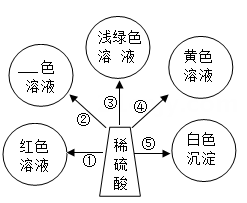 (1)、若用Cu(OH)2实现②,会得到色溶液。(2)、若想实现③,得到浅绿色溶液,可选用的单质是。(3)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。22. 浓硫酸在实验室中常用作干燥剂,因为浓硫酸具有 , 下列气体①SO2②NH3③H2;其中浓硫酸能干燥的气体有(填序号);
(1)、若用Cu(OH)2实现②,会得到色溶液。(2)、若想实现③,得到浅绿色溶液,可选用的单质是。(3)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。22. 浓硫酸在实验室中常用作干燥剂,因为浓硫酸具有 , 下列气体①SO2②NH3③H2;其中浓硫酸能干燥的气体有(填序号);
①金属表面除锈 ②制造药物氯化锌 ③除去氯化钠中少量的氢氧化钠杂质,不能用硫酸来代替的是(填序号)。23. 如图所示,将水滴入盛有浓硫酸的锥形瓶中。 (1)、该实验过程中可以观察到锥形瓶中的水浮在液体表面且沸腾,并出现液体飞溅的现象,U 形管中液面呈现的现象,产生该现象的原因是:。(2)、根据上述现象你认为稀释浓硫酸时应:。24. 某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:将带锈铁钉放入试管后加入足量的稀盐酸.看到铁锈消失,溶液呈黄色,反应的化学方程式为 , 待铁锈消失后又看到现象,该反应的化学方程式为。25. 纯净的浓盐酸是色液体,有气味,它是的水溶液,常用的浓盐酸的质量分数是 , 浓盐酸在空气里会形成 , 这是因为浓盐酸具有挥发性,挥发出来的气体和空气里的接触,形成盐酸的缘故。
(1)、该实验过程中可以观察到锥形瓶中的水浮在液体表面且沸腾,并出现液体飞溅的现象,U 形管中液面呈现的现象,产生该现象的原因是:。(2)、根据上述现象你认为稀释浓硫酸时应:。24. 某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:将带锈铁钉放入试管后加入足量的稀盐酸.看到铁锈消失,溶液呈黄色,反应的化学方程式为 , 待铁锈消失后又看到现象,该反应的化学方程式为。25. 纯净的浓盐酸是色液体,有气味,它是的水溶液,常用的浓盐酸的质量分数是 , 浓盐酸在空气里会形成 , 这是因为浓盐酸具有挥发性,挥发出来的气体和空气里的接触,形成盐酸的缘故。
26. 稀盐酸是实验室中一种重要的试剂,用途广泛。 (1)、小叶向盛有稀盐酸的烧杯中加入适量的某种固体与之反应。反应前后烧杯内溶液中主要离子种类及个数比变化如图所示。则加入的固体可能是 (写序号)。A、铁 B、铝 C、氧化铜 D、氢氧化镁(2)、在稀盐酸的下列用途中,不能用稀硫酸代替的是(填编号)。
(1)、小叶向盛有稀盐酸的烧杯中加入适量的某种固体与之反应。反应前后烧杯内溶液中主要离子种类及个数比变化如图所示。则加入的固体可能是 (写序号)。A、铁 B、铝 C、氧化铜 D、氢氧化镁(2)、在稀盐酸的下列用途中,不能用稀硫酸代替的是(填编号)。①金属表面除锈②制造药物氯化锌
③除去NaCl中的少量NaOH④实验室制取CO2
27. 某同学对酸的化学性质进行了归纳,如图所示,回答下列问题。 (1)、性质 3 箭头上方的反应物质类别为。(2)、根据性质 5,硫酸可以与下列哪些物质发生反应 。A、烧碱溶液 B、纯碱溶液 C、氯化钡溶液 D、食盐溶液28. 月球表面富含钛铁矿,钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其主要工艺流程如下图所示:
(1)、性质 3 箭头上方的反应物质类别为。(2)、根据性质 5,硫酸可以与下列哪些物质发生反应 。A、烧碱溶液 B、纯碱溶液 C、氯化钡溶液 D、食盐溶液28. 月球表面富含钛铁矿,钛因其硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其主要工艺流程如下图所示: (1)、请写出上述工艺流程中镁在高温下与TiCl4反应生成Ti和氯化镁的化学方程式。该反应的基本反应类型是。(2)、上述生产过程中得到的金属钛中混有少量金属杂质,可加入除去。
(1)、请写出上述工艺流程中镁在高温下与TiCl4反应生成Ti和氯化镁的化学方程式。该反应的基本反应类型是。(2)、上述生产过程中得到的金属钛中混有少量金属杂质,可加入除去。
