辽宁省沈阳市郊联体2021-2022学年高三上学期化学10月月考试卷
试卷更新日期:2021-10-15 类型:月考试卷
一、单选题
-
1. 古代的很多诗歌、谚语都蕴含着科学知识。下列解释正确的是( )A、“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 B、“春蚕到死丝方尽,蜡炬成灰泪始干”,“泪”是指石蜡燃烧生成的水 C、“爆竹声中除旧岁,春风送暖入屠苏”,爆竹爆炸发生的是分解反应 D、“纷纷灿烂如星陨,赫赫喧雁似火攻”中烟花是某些金属元素发生化学变化呈现出的颜色2. 下列关于化学用语的表述正确的是( )A、BF3的电子式:
 B、Fe2+的原子结构示意图:
B、Fe2+的原子结构示意图:  C、中子数为143的U原子:
D、乙醇的结构简式:C2H6O
3. 为阿伏加德罗常数的值。下列叙述正确的是( )A、18g重水(D2O)中含有的质子数为 B、3mol的 与 完全反应时转移的电子数为 C、 (分子结构:
C、中子数为143的U原子:
D、乙醇的结构简式:C2H6O
3. 为阿伏加德罗常数的值。下列叙述正确的是( )A、18g重水(D2O)中含有的质子数为 B、3mol的 与 完全反应时转移的电子数为 C、 (分子结构: )中的共价键数目为
D、1L 的 溶液中 离子数为
4. 下列说法正确的是( )A、 、 、 互为同素异形体 B、 、 、 在相同条件下的密度之比为 C、由 、 、 与 、 、 能形成9种水分子 D、 、 发生核聚变成为其他元素,属于化学变化5. 室温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=10的溶液中,Na+、ClO-、 、Cl- B、0.1mol·L-1Fe2(SO4)3溶液中,Cu2+、 、 、 C、使蓝色石蕊试纸变红的溶液中,Mg2+、 、K+、Cl- D、0.2mol·L-1KI溶液中, 、H+、Al3+、Br-6. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、7. 一种新型的合成氨的方法如图所示.下列说法正确的是( )
)中的共价键数目为
D、1L 的 溶液中 离子数为
4. 下列说法正确的是( )A、 、 、 互为同素异形体 B、 、 、 在相同条件下的密度之比为 C、由 、 、 与 、 、 能形成9种水分子 D、 、 发生核聚变成为其他元素,属于化学变化5. 室温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=10的溶液中,Na+、ClO-、 、Cl- B、0.1mol·L-1Fe2(SO4)3溶液中,Cu2+、 、 、 C、使蓝色石蕊试纸变红的溶液中,Mg2+、 、K+、Cl- D、0.2mol·L-1KI溶液中, 、H+、Al3+、Br-6. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、7. 一种新型的合成氨的方法如图所示.下列说法正确的是( ) A、反应①中 发生了氧化反应 B、反应①和②均属于“氮的固定” C、反应③为 D、三步循环的总结果为8. 下列指定反应的离子方程式书写正确的是( )A、四氧化三铁溶于足量稀硝酸: B、工业上生产漂白粉的原理: C、用 溶液吸收少量 : D、向酸性高锰酸钾溶液中滴入少量 溶液:9. 用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的是( )
A、反应①中 发生了氧化反应 B、反应①和②均属于“氮的固定” C、反应③为 D、三步循环的总结果为8. 下列指定反应的离子方程式书写正确的是( )A、四氧化三铁溶于足量稀硝酸: B、工业上生产漂白粉的原理: C、用 溶液吸收少量 : D、向酸性高锰酸钾溶液中滴入少量 溶液:9. 用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的是( ) A、加热图1中烧杯用于分离I2和高锰酸钾固体 B、用图2装置验证二氧化硫的漂白性 C、用图3装置制备氢氧化亚铁 D、用图4装置检验氯化铵受热分解生成的两种气体10. 下列说法中错误的有( )
A、加热图1中烧杯用于分离I2和高锰酸钾固体 B、用图2装置验证二氧化硫的漂白性 C、用图3装置制备氢氧化亚铁 D、用图4装置检验氯化铵受热分解生成的两种气体10. 下列说法中错误的有( )①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②测定新制氯水的 时,先用玻璃棒蘸取液体滴在 试纸上,再与标准比色卡对照;
③用米汤直接检验食用盐中是否含有碘元素;
④ 在5.6~7.0之间的降水通常称为酸雨;
⑤加入 溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有 存在;
⑥ 通入紫色石蕊试液,溶液先变红后褪色;
⑦配制一定物质的量浓度的氢氧化钠溶液,用烧杯称量后加蒸馏水溶解,未冷却到室温便转移到容量瓶中,导致结果偏高;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤;
⑨蒸干 溶液可得纯净的无水氯化铝;
A、5个 B、6个 C、7个 D、8个11. 控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是( )选项
A
B
C
D
装置图
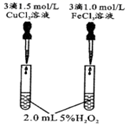


现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
B中产生白色沉淀,C中溶液颜色褪去
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2
非金属性:C>Si
A、A B、B C、C D、D12. 有机化合物M的结构简式如右图所示,其组成元素X、Y、Z、W、Q为原子序数依次增大的短周期元素。只有Y、Z、W为同周期相邻元素,Z的原子序数与Q的最外层电子数相同。下列说法正确的是( )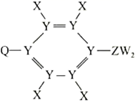 A、简单氢化物的沸点由高到低顺序为 B、含氧酸的酸性强弱顺序为 C、元素第一电离能由小到大的顺序为 D、元素X、Z、W形成的离子化合物中含有正四面体结构13. 下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。A确定时,当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当X是强碱时,过量的B跟 反应除生成C外,另一产物是盐酸盐。下列说法中错误的是( )
A、简单氢化物的沸点由高到低顺序为 B、含氧酸的酸性强弱顺序为 C、元素第一电离能由小到大的顺序为 D、元素X、Z、W形成的离子化合物中含有正四面体结构13. 下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。A确定时,当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当X是强碱时,过量的B跟 反应除生成C外,另一产物是盐酸盐。下列说法中错误的是( ) A、当X是强酸时,A,B,C,D,E,F中均含同一种元素,F可能是 B、当X是强碱时,A,B,C,D,E,F中均含同一种元素,F是 C、B和 的反应是氧化还原反应 D、A可能为亚硫酸铵14. 硒(Se)是一种新型半导体材料,对富硒废料(含Ag2Se、Cu2S)进行综合处理的一种工艺流程如下图:下列说法错误的是( )
A、当X是强酸时,A,B,C,D,E,F中均含同一种元素,F可能是 B、当X是强碱时,A,B,C,D,E,F中均含同一种元素,F是 C、B和 的反应是氧化还原反应 D、A可能为亚硫酸铵14. 硒(Se)是一种新型半导体材料,对富硒废料(含Ag2Se、Cu2S)进行综合处理的一种工艺流程如下图:下列说法错误的是( ) A、合理处理富硒废料符合循环经济理念。 B、母液可在“酸溶”工序循环利用 C、“滤液”经处理可制得胆矾 D、“吸收”时氧化剂与还原剂物质的量之比为1:115. 铜镁合金完全溶解于 密度为 、质量分数为63%的浓硝酸中,得到 和 的混合气体 (换算为标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到 沉淀,下列说法正确的是( )A、该合金中铜的物质的量是 ,镁的物质的量是 B、金属完全溶解后硝酸剩余 C、 和 的混合气体中, 的体积分数是80% D、得到 沉淀时,加入 溶液的体积是
A、合理处理富硒废料符合循环经济理念。 B、母液可在“酸溶”工序循环利用 C、“滤液”经处理可制得胆矾 D、“吸收”时氧化剂与还原剂物质的量之比为1:115. 铜镁合金完全溶解于 密度为 、质量分数为63%的浓硝酸中,得到 和 的混合气体 (换算为标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到 沉淀,下列说法正确的是( )A、该合金中铜的物质的量是 ,镁的物质的量是 B、金属完全溶解后硝酸剩余 C、 和 的混合气体中, 的体积分数是80% D、得到 沉淀时,加入 溶液的体积是二、综合题
-
16. 实验目的:为研究铁质材料与热浓硫酸的反应(1)、称取铁钉(碳素钢) 放入 浓硫酸中,加热,充分反应后得到溶液 并收集到气体 。
①甲同学认为 中除 外还可能含有 。若要确认其中是否含有 ,应选择加入的试剂为(选填序号)
A. 溶液和氯水 B.铁粉和 溶液 C.浓氨水 D.酸性 溶液
②乙同学取 (标准状况)气体 通入足量溴水中,然后加入足量 溶液,经适当操作后得到干燥固体 。据此推知气体 中 的体积分数为。(保留三位有效数字)。
(2)、分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有 和 气体。为此设计了下列探究实验装置(图中夹持仪器省略)。气体Y中还有 的原因是。 (3)、装置A中试剂的作用是 , 反应的离子方程式。(4)、简述确认气体Y中含有 的实验现象。(5)、如果气体Y中含有 ,预计实验现象应是。17. 氧化还原反应在工业生产、环保及科研中有广泛的应用,请根据以上信息,结合自己所掌握的化学知识,回答下列问题:(1)、Ⅰ、氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(3)、装置A中试剂的作用是 , 反应的离子方程式。(4)、简述确认气体Y中含有 的实验现象。(5)、如果气体Y中含有 ,预计实验现象应是。17. 氧化还原反应在工业生产、环保及科研中有广泛的应用,请根据以上信息,结合自己所掌握的化学知识,回答下列问题:(1)、Ⅰ、氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。写出CuH在氯气中燃烧的化学反应方程式:。
(2)、CuH溶解在稀盐酸中生成的气体是(填化学式)。(3)、如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:。(4)、Ⅱ、钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是。
(5)、向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。ClO +_VO2++_=_Cl-+_VO +
(6)、V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则SO 、Cl-、VO2+还原性由大到小的顺序是。(7)、在20.00 mL 0.1 moI·L-1 VO 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是___________。A、VO2+ B、VO C、V2+ D、V18. 某种电镀污泥主要含有碲化亚铜( )、三氧化二铬( )以及少量的金( ),可用于制取 溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
已知:煅烧时, 发生的反应为:
(1)、 元素在元素周期表中的位置为 , 该元素最高化合价。(2)、煅烧时, 发生反应的化学方程式为。(3)、浸出液中除了含有 (在电解过程中不反应)外,还含有(填化学式)。电解沉积过程中析出单质铜的电极为极。(4)、工业上用重铬酸钠( )母液生产重铬酸钾( )的工艺流程如图所示:
通过冷却结晶能析出大量 的原因是。
(5)、测定产品中 含量的方法如下:称取试样 配成 溶液,取 置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用 标准液进行滴定。滴定过程中发生反应的离子方程式为。若三次实验消耗 标准液的体积平均为 ,则所得产品中 的纯度为。19. 某科学研究小组设计以辉钼矿( 、 、 及 等)为原料制备少量钼酸铵的工艺流程如下:
已知:①“焙砂”中有 、 、 、 、 、 。
②“氨浸”时,铜元素转化为 (深蓝色),钼元素转化为 。
③ 。
回答下列问题:
(1)、“焙烧”在马弗炉中进行。①为了使辉钼矿充分焙烧,需要采取的措施是(写出一种)。
②马弗炉中逸出的气体为 , 是一种空气污染物。
③ 转化成 的化学方程式为。
(2)、“氨浸”时发生多个反应,其中 被浸取的化学方程式为。(3)、“滤渣1”的成分有 、(填化学式)。(4)、“沉铜”是在 时进行的,铜沉淀完全的现象是 , 发生反应的离子方程式为。