浙教版科学2020-2021学年九年级上册期中检测1
试卷更新日期:2021-10-12 类型:期中考试
一、单选题
-
1. 下列变化中,属于化学变化的是( )A、雪熔化 B、水结冰 C、冰升华 D、水电解2. 人体内一些液体的pH如下:血浆pH7.35~7.45,胰液pH7.5~8.0,胃液pH0.9~1.5,胆汁pH7.1~7.3。其中显酸性的是( )。A、血浆 B、胰液 C、胃液 D、胆汁3. 某物质与盐酸相遇会产生气泡,则该物质不可能是( )。A、碳酸钙 B、铁 C、小苏打 D、食盐4. R代表一种氧化物,可发生如下两个反应:R+酸→+盐+水;R+水→碱,则R可能是( )。A、CO2 B、Fe2O3 C、CuO D、CaO5. 下列有关氢氧化钠的说法,错误的是( )A、氢氧化钠俗称烧碱 B、氢氧化钠有强烈的腐蚀性 C、氢氧化钠水溶液能使紫色石蕊试液变红 D、氢氧化钠能去油污,厨房碱性清洁剂中含有氢氧化钠6. 类比推理在科学学习和科学研究中有重要意义,下列说法正确的是( )A、酸雨的pH小于7,所以pH小于7的雨水一定是酸雨 B、CO2和SO2都能与碱溶液反应,所以非金属氧化物一定能与碱溶液反应 C、碱的溶液显碱性,显碱性的溶液一定是碱溶液 D、氢氧化钠溶液中有OH-能与酸反应,氢氧化钙溶液中也有OH- , 故也能与酸反应7. 某科学实验小组为了探究中和反应放热,使用了甲、乙装置。下列说法错误的是( )
 A、通过甲装置右瓶的导管有气泡冒出可以说明此反应放热 B、通过乙装置饱和石灰水变浑浊可以说明此反应放热 C、甲装置左瓶试管中右导管是为了使稀硫酸更容易流进去 D、甲、乙均使用NaOH 溶液,未使用 NaOH 固体,是为了更充分的反应8. 鱼胆弄破后,会使鱼肉沾上一种难溶于水的胆汁酸(一种酸),使鱼肉变苦。要消除这种苦味,下列物质中,最适宜用来冲洗鱼肉的是( )。A、食盐水 B、醋酸 C、纯碱溶液 D、氢氧化钠溶液9. 下列反应可以生成硫酸钾的是( )。A、碳酸钾和硫酸钠 B、硫酸钠和氯化钾 C、硫酸和氧化钾 D、硝酸钾和硫酸镁10. 菜刀用铁制而不用铅制的原因是( )A、铁的硬度大,铅的硬度小 B、铁的熔点高,铅的熔点低 C、铁的密度大,铅的密度小 D、铁的导电性好,铅的导电性差11. 在金属表面覆盖保护膜是普遍采用的金属防锈措施之一。下列自行车的防锈措施中,不属于覆盖保护膜的是( ) 。A、擦拭保洁 B、链条上油 C、轮圈镀铬 D、车架喷漆12. 新型冠状病毒肺炎疫情爆发后,医用消毒剂是重要的防疫物资,下列医用消毒剂的有效成分属于有机物的是( )
A、通过甲装置右瓶的导管有气泡冒出可以说明此反应放热 B、通过乙装置饱和石灰水变浑浊可以说明此反应放热 C、甲装置左瓶试管中右导管是为了使稀硫酸更容易流进去 D、甲、乙均使用NaOH 溶液,未使用 NaOH 固体,是为了更充分的反应8. 鱼胆弄破后,会使鱼肉沾上一种难溶于水的胆汁酸(一种酸),使鱼肉变苦。要消除这种苦味,下列物质中,最适宜用来冲洗鱼肉的是( )。A、食盐水 B、醋酸 C、纯碱溶液 D、氢氧化钠溶液9. 下列反应可以生成硫酸钾的是( )。A、碳酸钾和硫酸钠 B、硫酸钠和氯化钾 C、硫酸和氧化钾 D、硝酸钾和硫酸镁10. 菜刀用铁制而不用铅制的原因是( )A、铁的硬度大,铅的硬度小 B、铁的熔点高,铅的熔点低 C、铁的密度大,铅的密度小 D、铁的导电性好,铅的导电性差11. 在金属表面覆盖保护膜是普遍采用的金属防锈措施之一。下列自行车的防锈措施中,不属于覆盖保护膜的是( ) 。A、擦拭保洁 B、链条上油 C、轮圈镀铬 D、车架喷漆12. 新型冠状病毒肺炎疫情爆发后,医用消毒剂是重要的防疫物资,下列医用消毒剂的有效成分属于有机物的是( )选项
A
B
C
D
医用消毒剂
乙醇
双氧水
硼酸
“84”消毒液
有效成分
C2H5OH
H2O2
H3BO3
NaClO
A、A B、B C、C D、D13. 《焦点访谈》曾就玩具对儿童造成意外伤害进行了报道。为儿童安全考虑,某洋娃娃的外材为纯羊毛线,内充物为聚酯纤维,下列对羊毛线和聚纤维的说法正确的是( )A、所用聚酯纤维有毒 B、可用灼烧法区分羊毛线和聚酯纤维 C、聚酯纤维为无机化合物 D、羊毛线主要成分是纤维素14. 下列各图中“o”和“●”分别表示两种质子数不同的原子,能表示单质的是( )A、 B、
B、 C、
C、 D、
D、 15. 读碳和碳的化合物间的转化关系图,下列有关说法正确的是( )
15. 读碳和碳的化合物间的转化关系图,下列有关说法正确的是( )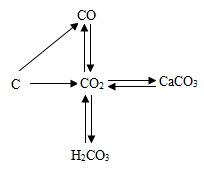 A、“C→CO”的反应中碳发生还原反应 B、“CO→CO2“的反应类型为置换反应 C、“CO2→CaCO3"的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试液验证
A、“C→CO”的反应中碳发生还原反应 B、“CO→CO2“的反应类型为置换反应 C、“CO2→CaCO3"的反应可用于检验二氧化碳 D、“CO2 H2CO3”的反应可用酚酞试液验证二、填空题
-
16. 使金属材料变成很小很小的粒子,就会形成粒子,这种金属的会发生变化,甚至与原来的性质完全不同。17. 红氧,非金属单质,化学式O8 , 是氧的一种单质形式,它可被认为可能会是更好的氧化剂,因为它能量密度更高。O8遭遇96GPa以上的高压就会变为金属氧,不仅会导电,在低温下表现出超导性:(1)、红氧,被认为可能会是更好的氧化剂,是利用了红氧的性质(填“物理”或“化学”,下同)。(2)、红氧遭遇96GPa以上的高压就会变为金属氧,不仅会导电,在低温下表现出超导性;金属氧不仅会导电,在低温下表现出超导性是利用了金属氧的性质。18. 某实验小组做酸与碱反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。如图为依据实验数据绘制的 V(盐酸)-pH图。
 (1)、滴加盐酸的体积为V1时,溶液呈色;(2)、滴加盐酸的体积为V2时,溶液中除了水分子外,主要的微粒还有;19. 根据酸的条化学性质回答下列问题。
(1)、滴加盐酸的体积为V1时,溶液呈色;(2)、滴加盐酸的体积为V2时,溶液中除了水分子外,主要的微粒还有;19. 根据酸的条化学性质回答下列问题。 (1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、图中的X代表一类物质,则X为(填物质类别)。(3)、请写出符合性质④,反应前后溶液颜色发生改变的一个反应的化学方程式。20. 氢氧化钠和氢氧化钙是实验室常见的两种碱,它们之间有许多相似之处。(1)、氢氧化钠和氢氧化钙具有相似的化学性质,原因是它们在电离时都产生了。(填微粒符号)(2)、氢氧化钠和氢氧化钙溶液都是无色透明的液体。为鉴别它们,小明设计了如图三种方案(每种方案的两支试管中事先分别加入等量的上述两种碱)。其中可行的是方案。
(1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、图中的X代表一类物质,则X为(填物质类别)。(3)、请写出符合性质④,反应前后溶液颜色发生改变的一个反应的化学方程式。20. 氢氧化钠和氢氧化钙是实验室常见的两种碱,它们之间有许多相似之处。(1)、氢氧化钠和氢氧化钙具有相似的化学性质,原因是它们在电离时都产生了。(填微粒符号)(2)、氢氧化钠和氢氧化钙溶液都是无色透明的液体。为鉴别它们,小明设计了如图三种方案(每种方案的两支试管中事先分别加入等量的上述两种碱)。其中可行的是方案。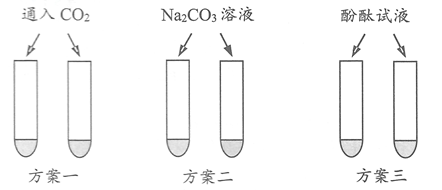 21. 物质的性质决定用途.请从①金刚石 ②铜 ③氢氧化钙 ④干冰 ⑤小苏打⑥氯化钠中
21. 物质的性质决定用途.请从①金刚石 ②铜 ③氢氧化钙 ④干冰 ⑤小苏打⑥氯化钠中选择适当物质填空(填序号)
(1)、用于治疗胃酸过多症的是;(2)、用作改良酸性土壤的是 .22. 一位农民种植的小麦产量总是比邻近地块的低,他怀疑是农田缺乏某种肥料。他将农田分为等面积的四块,除施肥不同外,其他管理措施均相同,实验结果如下表,从表中可以看出,该农田最可能缺乏的是。生长在丁地块中小麦会现的症状是。地 块
甲
乙
丙
丁
施肥情况
氮肥
磷肥、钾肥
磷肥、氮肥
不施肥
小麦产量(kg)
56.62
67.26
57.80
55.71
23. 如今,青少年近视的人越来越多,我们青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。请根据下图回答下列问题: (1)、图中标示的物质属于金属材料的有(填序号)。(2)、灯管后面的反光片为铝箔,这是利用了铝的性。24. 为探究镁、铁、铜三种金属的活动性顺序,小涛设计了如图所示的实验方案。请完成下列问题:
(1)、图中标示的物质属于金属材料的有(填序号)。(2)、灯管后面的反光片为铝箔,这是利用了铝的性。24. 为探究镁、铁、铜三种金属的活动性顺序,小涛设计了如图所示的实验方案。请完成下列问题: (1)、同学们经讨论后认为该方案可以优化,试管的实验是多余的;(2)、去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,则组成滤渣的所有可能是 。25. 某初中化学社团﹣﹣“拉瓦锡实验室”的活动丰富多彩.下面是他们以“化学与社会发展”为主题的两次活动记录:
(1)、同学们经讨论后认为该方案可以优化,试管的实验是多余的;(2)、去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,则组成滤渣的所有可能是 。25. 某初中化学社团﹣﹣“拉瓦锡实验室”的活动丰富多彩.下面是他们以“化学与社会发展”为主题的两次活动记录:活动1:在观看了“西气东输”与“石油分馏”等视频后.通过小组讨论,同学们认识到:
①、石油、天然气是人类社会重要的自然资源.天然气的主要成分是甲烷,甲烷完全燃烧的化学方程式是 .
②现在化石燃料等不可再生能源面临枯竭,化石燃料对环境的影响也不容忽视.所以,开发和利用风能、等新能源成为越来越迫切的要求.
③人们将化石燃料通过化学工艺可以制造和合成价值更高的药物、化学纤维、塑料和合成橡胶等.其中,塑料属于材料.随意丢弃会造成“白色污染”.
活动2:同学们展示了各自收集到的关于“化学物质与健康”的相关资料及一些常见食品,如:高钙牛奶、加碘食盐等.并针对“化学制品对人体有益还是有害”展开了激烈的辩论,从而认识到钙、铁、锌等元素对人体健康有重要作用,如缺铁元素会引起缺铁性贫血,缺钙元素会引起;还认识到一氧化碳、甲醛等物质对人体健康的危害.通过这样的社团活动,大家形成了“保护自然,关爱生命”的共识.
三、实验探究题
-
26. 废旧金属可以回收利用,用合金废料(含Fe、Cu)制取FeSO4和CusO4溶液的实验流程如下(部分生成物省略):
 (1)、合金属于(填“纯净物“或“混合物”)。(2)、由Cu制取CuSO4溶液有以下两种途径:
(1)、合金属于(填“纯净物“或“混合物”)。(2)、由Cu制取CuSO4溶液有以下两种途径:Ⅰ.Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
Ⅱ.2Cu+O2 2CuO CuO+H2SO4=CuSO4+H2O
从两种途径可以看出,通常情况下不反应的两种物质,在改变和后,也可以发生反应。相对于第二种方法,第一种方法的不足之处是 , (写两点)。
27. 某兴趣小组为探究金属镁的化学性质,做了镁与稀盐酸反应的实验。小柯同学做镁粉与稀盐酸反应的实验时发现试管温度明显升高,并在试管中出现灰白色沉淀,该小组同学对灰白色沉淀的成分进行如下探究:【提出假设】
假设一:可能含有氯化镁; 假设二:可能含有镁粉;
假设三:可能含有氢氧化镁。
【查阅资料】①镁可与热水反应生成氢氧化镁和氢气;②氢氧化镁在水中溶解度很小, 其水溶液呈弱碱性。
【设计并进行实验】各取少量灰白色沉淀加入 2 支试管中,进行如下实验:
编号
实验操作
实验现象
实验 1
加入一定温度的蒸馏水、搅拌
沉淀未见减少
实验 2
加入适量稀盐酸
沉淀全部溶解,没有气泡产生
【得出结论】根据实验 2 现象,说明假设二不成立。
【实验思考】
(1)、如果假设三成立,请写出实验 2 中发生反应的化学方程式:。(2)、实验后同学们请教老师得知, 灰白色沉淀的主要成分是碱式氯化镁[Mg(OH)2·MgCl2],碱式氯化镁受热易分解产生氯化氢气体。为了验证试管中的 灰白色沉淀中含有碱式氯化镁,小米同学把灰白色沉淀放进试管进行加热,并在试管口放一张湿润的紫色石蕊试纸。如果灰白色沉淀中含有碱式氯化镁,则小米同学将看到的现象是。(3)、镁与稀盐酸反应究竟是一个怎样的过程呢?小组同学进行了如下实验:在小烧杯中加入一定量的稀盐酸和去除氧化膜的镁带,测量溶液 pH 的变化,并观察实验现象。结果如下表:时间/min
0
2
4
8
12
16
20
24
溶液 pH
2.0
5.3
7.0
8.6
9.3
9.8
10.0
10.0
实验现象
/
镁带溶解较快,产生大量气泡,试管温度升高,无沉淀生成
镁带缓慢溶解,产生气泡速率减慢,溶液变浑浊,烧杯底部有灰白色沉淀
根据表中信息,请你说说溶液 pH 值出现这样变化的原因:。
28. 某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图的实验方案:

试回答:
(1)、步骤①中锌粉必须过量的原因是;(2)、写出步骤①中任一反应的化学方程式;(3)、要检验步骤④中加入的稀硫酸是否足量的方法是。29. 某探究小组的同学用H2SO4、Na2CO3、NaOH、BaCl2四种溶液进行“复分解反应发生条件”及应用的实验探究:将四种溶液两两混合,若用H2SO4与另三种Na2CO3、NaOH、BaCl2溶液分别混合:(1)、实验中,能直接观察到说明H2SO4与Na2CO3溶液发生化学反应的证据是:(2)、实验中的H2SO4与NaOH混合“无明显现象”,但实际上发生了化学反应,其反应的实质是H+和OH−结合生成H2O.同理,H2SO4与BaCl2发生了化学反应,其反应的实质是由此同学们总结得出:复分解反应发生的条件是有沉淀或气体或水生成。
30. 某科学兴趣小组为研究不同金属跟稀硫酸反应的快慢,将甲、乙、丙、丁四种金属片分别与相同体积、相同溶质质量分数的稀硫酸反应,观察30秒内产生的氢气泡的多少,记录在下表中。(“+”越多表示产生的气泡越多)金属
甲
乙
丙
丁
氢气泡的多少
++
++++
+++
+
(1)、从实验结果可看出,甲、乙、丙、丁四种金属与稀硫酸反应由快到慢的顺序是。(2)、要获得令人信服的实验结论,除了稀硫酸的体积和溶质质量分数必须相同外,4种金属的也必须相同。四、解答题
-
31. 实验室有一瓶标签被腐蚀的氢氧化钠溶液,为了测定其溶质质量分数,某兴趣小组设计了两种实验方案,实验过程及结果记录如下:(注:方案2滴入酚酞试液的质量忽略不计:氢氧化钠与氯化镁反应的化学方程式为:MgCl+2NaOH=2NaCI+Mg(OH)2↓)
 (1)、方案1中进行过滤时,需要用到下列器材中的(填字母编号,可多选)。
(1)、方案1中进行过滤时,需要用到下列器材中的(填字母编号,可多选)。 (2)、根据方案1中的数据,计算该氢氧化钠溶液中溶质的质量分数。(3)、根据方案2中的数据,算得氢氧化钠溶液的溶质质量分数,发现与事实严重不符,小明分析造成这种情况的原因可能是加入的稀盐酸过量,为证明稀盐酸确实过量需要进行的实验是(写出实验操作与相应现象)。32. 小金同学各取 48g 氧化铁粉末利用图示装置进行甲、乙对比实验,探究温度对CO 和 Fe2O3 反应的影响(固定装置略)。
(2)、根据方案1中的数据,计算该氢氧化钠溶液中溶质的质量分数。(3)、根据方案2中的数据,算得氢氧化钠溶液的溶质质量分数,发现与事实严重不符,小明分析造成这种情况的原因可能是加入的稀盐酸过量,为证明稀盐酸确实过量需要进行的实验是(写出实验操作与相应现象)。32. 小金同学各取 48g 氧化铁粉末利用图示装置进行甲、乙对比实验,探究温度对CO 和 Fe2O3 反应的影响(固定装置略)。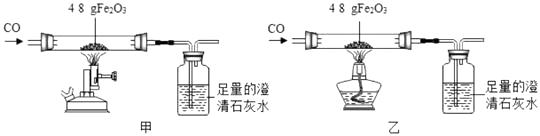
甲组用酒精喷灯(火焰温度 800℃~1000℃)、乙组用酒精灯(火焰温度 500℃~700℃) 分别对玻璃直导管进行充分加热,红色粉末均变为黑色粉末。两组分别用固体产物进行实验,记录如下。
操作步骤
甲组现象
乙组现象
① 称量反应后粉末质量(g)
33.6
44.2
② 取黑色粉末用磁铁吸引
全部能被磁铁吸引
部分能被磁铁吸引
③ 取黑色粉末加入足量稀盐酸,震荡
全部溶解,有气泡
部分溶解,无气泡
为解释这个现象,小金同学查阅到下列资料:
Ⅰ.已知铁的氧化物有 FeO、Fe3O4、Fe2O3 , 在一定条件下,均能失去或逐步失去其中的氧,最终被还原为铁。
Ⅱ.Fe3O4 是一种铁氧体磁性物质,不溶于水和酸。
(1)、从实验安全角度考虑,图示装置还应采取的改进措施是。(2)、甲组的黑色粉末与稀盐酸反应的化学方程式是。(3)、乙组的生成物可能是 , 请你通过计算证明。33. 用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
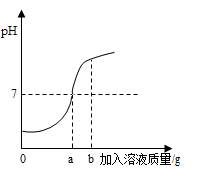 (1)、该实验是将(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.(2)、当加入溶液的质量b为20g时,求所得溶液中的溶质是(填化学式)34. 材料常常是一个时代的标志,如陶器时代、青铜器时代,现代社会中化学合成材料迅速发展,并得到广泛应用。
(1)、该实验是将(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.(2)、当加入溶液的质量b为20g时,求所得溶液中的溶质是(填化学式)34. 材料常常是一个时代的标志,如陶器时代、青铜器时代,现代社会中化学合成材料迅速发展,并得到广泛应用。
 (1)、陶是最早的合成材料.制陶的原料是黏土(主要成分是二氧化硅、氧化镁、氧化铝和碳酸钙),其原理是在900℃时,二氧化硅和氧化镁、氧化铝、碳酸钙发生一系列反应生成硅酸镁、硅酸铝、硅酸钙(CaSiO3)和一种常见的无毒气体,各种生成物熔合冷却便成为坚硬的陶,写出二氧化硅和碳酸钙反应的化学方程式 。(2)、使用电热壶方便快捷,右图电热壶的制作材料中属于金属或合金的是 (填序号);该水壶在水沸腾时有自动断电的保护功,原因是水沸腾后气压增大,迫使电源开关自动断电,从分子的角度解释水沸腾后气压增大的原因是 。(3)、“水立方”是2008年北京奥运场馆--国家游泳中心,它的外层是只有0.08 mm~0.25 mm厚的膜结构气枕,其所用材料是新型塑料ETFE[聚氟乙烯(C2F4)n],这种新型材料透明美观、防火防水、耐用,且无需清理和维护。塑料ETFE含种元素,其中碳元素的质量分数为%,属于(填“有”或“无”)机物。35. 已知金属和酸反应受温度和溶液的溶质质量分数影响。现将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强随反应时间的变化曲线如图所示,试分析曲线AB、BC和CD变化的原因。
(1)、陶是最早的合成材料.制陶的原料是黏土(主要成分是二氧化硅、氧化镁、氧化铝和碳酸钙),其原理是在900℃时,二氧化硅和氧化镁、氧化铝、碳酸钙发生一系列反应生成硅酸镁、硅酸铝、硅酸钙(CaSiO3)和一种常见的无毒气体,各种生成物熔合冷却便成为坚硬的陶,写出二氧化硅和碳酸钙反应的化学方程式 。(2)、使用电热壶方便快捷,右图电热壶的制作材料中属于金属或合金的是 (填序号);该水壶在水沸腾时有自动断电的保护功,原因是水沸腾后气压增大,迫使电源开关自动断电,从分子的角度解释水沸腾后气压增大的原因是 。(3)、“水立方”是2008年北京奥运场馆--国家游泳中心,它的外层是只有0.08 mm~0.25 mm厚的膜结构气枕,其所用材料是新型塑料ETFE[聚氟乙烯(C2F4)n],这种新型材料透明美观、防火防水、耐用,且无需清理和维护。塑料ETFE含种元素,其中碳元素的质量分数为%,属于(填“有”或“无”)机物。35. 已知金属和酸反应受温度和溶液的溶质质量分数影响。现将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强随反应时间的变化曲线如图所示,试分析曲线AB、BC和CD变化的原因。