浙教版科学九年级上册第二章 物质转化与材料利用1、2节同步夯实基础练习卷
试卷更新日期:2021-10-12 类型:同步测试
一、单选题
-
1. 小科为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中合理的是( )A、
 B、
B、 C、
C、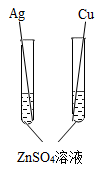 D、
D、 2. 下列有关说法正确的是( )A、O2具有助燃性 B、铁生锈属于物理变化 C、金属活动性Cu比Mg强 D、KClO3属于氧化物3. 我国发明的新型钛合金,为“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应式是: ① 2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO;②2Mg+TiCl4 2MgCl2+Ti 下列说法合理的是( )A、FeTiO3属于氧化物 B、钛合金是一种金属单质 C、反应②属于置换反应 D、TiCl4中钛元素和氯元素的质量比为96:714. 如图所示,分别向甲,乙两支试管中加入形状和大小完全相同的铁片,再向甲中加入植物油,U形玻璃管内为红墨水(开始时两端液面相平),塞上橡皮塞后,放置一段时间。下列说法错误的是( )。
2. 下列有关说法正确的是( )A、O2具有助燃性 B、铁生锈属于物理变化 C、金属活动性Cu比Mg强 D、KClO3属于氧化物3. 我国发明的新型钛合金,为“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应式是: ① 2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO;②2Mg+TiCl4 2MgCl2+Ti 下列说法合理的是( )A、FeTiO3属于氧化物 B、钛合金是一种金属单质 C、反应②属于置换反应 D、TiCl4中钛元素和氯元素的质量比为96:714. 如图所示,分别向甲,乙两支试管中加入形状和大小完全相同的铁片,再向甲中加入植物油,U形玻璃管内为红墨水(开始时两端液面相平),塞上橡皮塞后,放置一段时间。下列说法错误的是( )。 A、植物油用于隔绝氧气和水 B、甲试管中铁片比乙试管中铁片不易生锈 C、U形玻璃管两端的液面变为右低左高 D、U形玻璃管两端的液面变为左低右高5. 能用金属与同一种稀酸反应制取的化合物是( )A、CuCl2 , AlCl3 B、ZnCl2 , MgCl2 C、Fe2( SO4),FeSO4 D、Na2SO3 , K2SO46. 下列图像不能正确表示对应变化关系的是( )
A、植物油用于隔绝氧气和水 B、甲试管中铁片比乙试管中铁片不易生锈 C、U形玻璃管两端的液面变为右低左高 D、U形玻璃管两端的液面变为左低右高5. 能用金属与同一种稀酸反应制取的化合物是( )A、CuCl2 , AlCl3 B、ZnCl2 , MgCl2 C、Fe2( SO4),FeSO4 D、Na2SO3 , K2SO46. 下列图像不能正确表示对应变化关系的是( ) A、图甲表示向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸时,产生的H2质量与稀盐酸质量的关系 B、图乙表示两份完全相同的双氧水在有无MnO2情况下,产生O2质量与反应时间的关系 C、图丙表示向一定量的稀盐酸中加入过量的NaOH溶液时,溶液pH随NaOH溶液质量的变化关系 D、图丁表示向一定量Ba(OH)2溶液中滴加过量H2SO4溶液时的溶液导电性与时间的关系7. 小科按如图流程进行实验(假设每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤液中加入少量铁粉,无明显现象。由此实验可知( )
A、图甲表示向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸时,产生的H2质量与稀盐酸质量的关系 B、图乙表示两份完全相同的双氧水在有无MnO2情况下,产生O2质量与反应时间的关系 C、图丙表示向一定量的稀盐酸中加入过量的NaOH溶液时,溶液pH随NaOH溶液质量的变化关系 D、图丁表示向一定量Ba(OH)2溶液中滴加过量H2SO4溶液时的溶液导电性与时间的关系7. 小科按如图流程进行实验(假设每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤液中加入少量铁粉,无明显现象。由此实验可知( ) A、滤渣中一定有铜和铁 B、金属的活动性顺序:Zn>Fe>Cu C、两支试管混合后,固体总质量一定增加 D、滤液中的溶质一定有FeCl2、ZnCl2 , 可能含有CuCl28. 小明为探究镁、锌、铜、银的活动性顺序,设计如下实验流程,依据该流程设计,下面对物质①、②的选择合理的是( )
A、滤渣中一定有铜和铁 B、金属的活动性顺序:Zn>Fe>Cu C、两支试管混合后,固体总质量一定增加 D、滤液中的溶质一定有FeCl2、ZnCl2 , 可能含有CuCl28. 小明为探究镁、锌、铜、银的活动性顺序,设计如下实验流程,依据该流程设计,下面对物质①、②的选择合理的是( ) A、①稀盐酸 ②硝酸银 B、①稀硫酸 ②硫酸锌 C、①稀盐酸 ②硫酸亚铁 D、①稀硫酸 ②硝酸镁9. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )
A、①稀盐酸 ②硝酸银 B、①稀硫酸 ②硫酸锌 C、①稀盐酸 ②硫酸亚铁 D、①稀硫酸 ②硝酸镁9. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )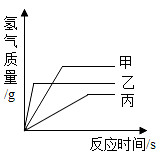 A、甲、乙、丙依次可能是Mg、Zn、Fe B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙10. 下列实验操作能达到目的的是( )
A、甲、乙、丙依次可能是Mg、Zn、Fe B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙10. 下列实验操作能达到目的的是( )选项
目的
物质
操作
A
鉴别
Na2CO3和Na2SO4溶液
滴加 BaCl2溶液,观察是否产生白色沉淀
B
制备
少量熟石灰
将石灰石加入足量水中
C
分离
铁粉和铜粉
加入适量 AgNO3溶液,过滤
D
除杂
CuSO4 溶液中混有少量H2SO4
加过量的氧化铜,过滤
A、A B、B C、C D、D11. 将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如图所示。关于甲、乙两金属,下列判断合理的是( ) A、铁、镁 B、锌、镁 C、锌、铁 D、铁、锌12. 下列实验目的、操作及现象以及结论均正确的是( )
A、铁、镁 B、锌、镁 C、锌、铁 D、铁、锌12. 下列实验目的、操作及现象以及结论均正确的是( )实验目的
操作及现象
结论
A
验证氢气的还原性
将氢气通入盛有氧化铜的硬质玻璃管,排尽其内的空气后加热,观察到黑色固体变红
氢气具有还原性
B
比较金属铝和锌的活动性
将两种金属与等质量、等浓度的盐酸反应,观察到盛有锌的试管产生气泡比铝的快
铝比锌活泼
C
验证氢氧化钠溶液为碱溶液
向氢氧化钠溶液中加入酚酞试液,观察到溶液变红
氢氧化钠溶液为碱溶液
D
验证铁和硫反应过程的能量变化
铁粉和硫粉混合后,用酒精灯加热,观察到混合物出现红热现象
该反应为吸热反应
A、A B、B C、C D、D13. 向CuSO4溶液中加入一定质量的镁粉,完全反应后过滤,得滤渣和蓝色溶液。下列说法不正确的是( )A、滤渣中一定有Cu B、反应后滤液中的金属阳离子为Cu2+和Mg2+ C、向滤渣中滴加稀盐酸,一定会有气泡产生 D、向滤液中滴加氢氧化钠溶液会产生蓝色沉淀14. 生活中有很多“禁忌”,即不能做的事情。下列“禁忌”与相关的科学解释对应的是( )选项
禁忌
原理解释
A
用锡壶装醋酸
活动性顺序:Sn<H
B
煤气泄漏时,开灯检查
电火花会点燃混合气体,气体爆炸
C
用稀HCl除铁锈时,浸泡太久
6HCl+2Fe=2FeCl3+3H2↑
D
浓硫酸洒在手上,直接用水冲洗
浓硫酸具有吸水性
A、A B、B C、C D、D15. 下列说法中正确的是( )A、碱的组成中一定含有氢、氧两种元素 B、金属都可以与盐酸反应生成盐和氢气 C、铁与氧气反应一定生成四氧化三铁 D、含有金属元素和氧元素的化合物一定是金属氧化物16. 如图所示为人们总结出来的常见金属的活动性顺序,下列有关说法错误的是( )
金属活动性由强逐渐减弱
A、常温下,铝制品比铁制品更容易腐蚀 B、排在氢前面的金属可以把酸里的氢置换出来 C、排在前面的金属可以将后面的金属从其盐溶液中置换出来 D、铜器时代早于铁器时代,这与两种金属的活动性有一定关系17. 下列反应属于置换反应的是( )A、2Na+H2O=2NaOH+H2↑ B、Cu(NO3)2+2KOH=Cu(OH)2↓+KNO3 C、CO2+Ca(OH)2=CaCO3↓+H2O D、Fe2O3+3CO 3CO2+2Fe18. 最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法不正确的是( )A、该反应不可能是置换反应 B、该反应中不止一种元素的化合价发生变化 C、该反应中MnO2可能催化剂 D、该反应中MnOOH不是碱19. 向一定质量的AgNO3、Fe(NO3)2混合溶液中加入a 克 Zn粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得质量仍为a 克。下列说法正确的是( )A、滤液一定呈无色 B、滤液中一定含Fe(NO3)2和Zn(NO3)2 C、滤渣中一定含Fe D、滤渣滴加稀盐酸一定无气泡产生20. 下列化学反应属于置换反应的是( )A、Zn+H2SO4=ZnSO4+H2↑ B、Ba(OH)2+H2SO4=BaSO4↓+2H2O C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 D、2HgO 2Hg+O2↑二、填空题
-
21. 已知某金属X有下列相关信息:①它的主要矿物的化学成分是X2O3;②它主要通过加热还原法冶炼而成;③它的年产量在所有金属中居首位。(1)、据此推断X是_____。A、钛 B、铁 C、铝 D、铜(2)、在高炉中,用含X2O3的矿物冶炼该金属的原理是(用化学方程式表示)。(3)、下列物质中,不能与X2O3 , 反应生成X的是A、木炭 B、氢气 C、一氧化碳 D、氧气22. 钨是熔点最高的金属。工业上用黑钨矿(主要成分为钨酸亚铁FeWO4)冶炼钨,主要反应有:
①4FeWO4+4Na2CO3+O2 4Na2WO4+2Fe2O3+4X
②Na2WO4+2HCl=H2WO4+2NaCl
③H2WO4 WO3+H2O
④WO3+3H2 W+3H2O
(1)、钨酸亚铁FeWO4中W的化合价为。(2)、反应①中X的化学式为。(3)、上述4条化学反应中,属于置换反应的是。(填序号)23. 铝是日常生活中常见的金属,请根据所学知识回答下列问题:.(1)、Al和CuSO4溶液反应的化学方程式为 。(2)、生活中铝比铁更耐腐蚀的原因是 (用化学反应方程式表示)。24. 铜、铁、铝是生活中常见的金属,请回答: (1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的。(2)、用等质量的锌、铁、镁三种金属分別与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是 (填字母)。A、曲线X、Y、Z分别表示锌、铁、镁的反应情况 B、反应后一定有剩余的金属是镁 C、反应后可能没有剩余的金属是锌和铁 D、三份盐酸均反应完25. 制造芯片的基材主要是高纯硅。下图是制备高纯硅的一种工艺流程:
(1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的。(2)、用等质量的锌、铁、镁三种金属分別与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是 (填字母)。A、曲线X、Y、Z分别表示锌、铁、镁的反应情况 B、反应后一定有剩余的金属是镁 C、反应后可能没有剩余的金属是锌和铁 D、三份盐酸均反应完25. 制造芯片的基材主要是高纯硅。下图是制备高纯硅的一种工艺流程:
回答下列问题:
(1)、反应Ⅰ 的 化学方程式是。(2)、过滤所得粗硅应充分洗涤,以除去表面可能吸附的HCl和(填化学式)。(3)、反应Ⅱ的基本类型属于;反应Ⅱ要在无氧气环境中进行,原因是(答出一种即可)。(4)、上述生产流程中,可以循环利用的物质是(填化学式)。26. 金属材料与人类的生产和生活密切相关.请回答:(1)、下列用品中,主要利用金属导热性的是 .A、铂金饰品 B、铁锅 C、铝导线(2)、自行车构件中的支架是铁制品,为防止它锈蚀,可在其表面刷漆,其防锈的原理是 .(3)、有X、Y、Z三种金属,它们具有如下性质:①X、Z均不与稀盐酸反应②Y+2HCl═YCl2+H2↑③X+Z(NO3)2═X(NO3)2+Z则X、Y、Z三种金属活动性由强到弱的顺序是 .
三、实验探究题
-
27. 学习了金属的性质之后,同学们决定用实验对铁、铝、铜三种金属的活动性顺序进行验证。请回答:
(一)验证实验
(1)、将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,过一会儿取出铁丝,观察到就能得出三种金属的活动性顺序为:铝>铁>铜。(2)、将铁丝插入硫酸铜溶液中时,除了上述观象,同学们还发现容液中有较多气泡放出。为了确定生成了什么气体,同学们决定继续进行探究。[建立猜想]放出的气体可能是SO2、O2、H2的一种或几种。
[查阅资料]SO2易溶于水,化学性质与二氧化碳相似,也能使澄清石灰水变浑油,生成CaSO3
[方案设计]依据上述猜想,同学们分别设计了如下方案:
甲同学认为气体是O2 , 检验方法是 , 经检验不是O2。对于另两种气体的验证,同学合作设计了如图组合实验方案:
 (3)、实验开始时,先将收集到的气体从A通入一段时间后,再点燃C处酒精灯;这样操作的目的是。(4)、实验过程中根据现象,可以得出结论:铝丝与硫酸铜溶液反应时,产生的气体是氢气,硫酸铜溶液中可能含有酸。28. 含铜离子的盐溶液一般呈蓝色,但老师在做氧化铜粉末与新配制的稀盐酸反应实验时,反应后的溶液却是绿色的,这是怎么回事呢?他们对此进行了科学探究:
(3)、实验开始时,先将收集到的气体从A通入一段时间后,再点燃C处酒精灯;这样操作的目的是。(4)、实验过程中根据现象,可以得出结论:铝丝与硫酸铜溶液反应时,产生的气体是氢气,硫酸铜溶液中可能含有酸。28. 含铜离子的盐溶液一般呈蓝色,但老师在做氧化铜粉末与新配制的稀盐酸反应实验时,反应后的溶液却是绿色的,这是怎么回事呢?他们对此进行了科学探究:猜想一:生成物中除铜离子外可能还有其它离子;
猜想二:可能与铜离子浓度偏大有关;
(1)、为了验证猜想一,同学们先查阅了常见离子的颜色,知道了亚铁离子的颜色为浅绿色。于是,他们向反应后的溶液中加入金属锌,结果在锌表面只生成红色固体,则证明猜想一是。(2)、为了验证猜想二,上网进行了查询,发现氯化铜溶液的颜色与溶液的浓度有关,见下表。那么,实验若要得到蓝色的氯化铜溶液,老师可采取的措施是:。溶液浓度
溶液很浓
溶液较浓
溶液很稀
溶液颜色
黄色
绿色
蓝色
(3)、进一步查阅网上资料可知:氯化铜溶液的颜色变化的真正原因是氯离子的浓度不同产生的。为了验证上述资料是否正确。小宁同学向反应后蓝色的溶液中加入NaCI固体, 溶液出现 , 则该资料是正确的。29. 为了探究铁生锈的条件,某实验小组的同学用下列装置进行实验。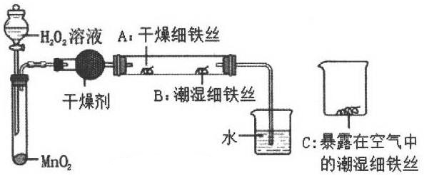 (1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,微热试管,说明气密性良好的现象是;(2)、加入药品,4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。A、B处实验现象对比说明铁生锈主要与有关;B、C处实验现象对比说明铁生锈的快慢与有关;(3)、写出一种防止铁生锈的方法。30. 铬(Cr)是一种重要的金属材料,具有良好的抗腐蚀性,常用来镀在其他金属的表面上达到防锈的目的。小明想利用实验室的药品和器材来比较铝和铬的金属活动性强弱。
(1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,微热试管,说明气密性良好的现象是;(2)、加入药品,4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。A、B处实验现象对比说明铁生锈主要与有关;B、C处实验现象对比说明铁生锈的快慢与有关;(3)、写出一种防止铁生锈的方法。30. 铬(Cr)是一种重要的金属材料,具有良好的抗腐蚀性,常用来镀在其他金属的表面上达到防锈的目的。小明想利用实验室的药品和器材来比较铝和铬的金属活动性强弱。【实验器材及药品】厚度相同的铝片和铬片(表面打磨过)、质量分数为 10%的稀盐酸、剪刀、秒表、注射器若干、具支试管若干、橡胶塞若干、相同气球若干。
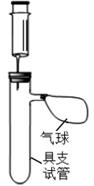
( ( 温馨提示:在金属活动性强弱差别不大时,产生气泡的快慢 难以区分) )。
(1)、实验中使用的铝片和铬片表面均用砂纸事先打磨过,其目的是。(2)、小明利用相关实验器材搭建了如右图所示装置,请你帮助他设计实验步骤。建议:①每组实验中取用稀盐酸 10mL;②每组实验取用金属片 2 片;。
31. 镁条在空气中久置表面会变黑,某同学设计并进行实验,探究镁条变黑的条件。【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关
【进行实验】通过控制与镁条接触的物质,利用如图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。

编号
主要实验操作
实验现象
1
先充满用NaoH浓溶液洗涤过的空气再加入2mL浓硫酸
镁条始终无明显变化
2
镁条始终无明显变化
3
先加入2mL浓硫酸再通入约4mLCO2
镁条始终无明显变化
4
先加入4mL饱和NaSO3溶液再充满CO2
镁条始终无明显变化
5
先加入2mL蒸馏水再通入约4mLCO2
镁条第3天开始变黑至第20天全部变黑
【解释与结论】
(1)、得出“镁条变黑一定与CO2有关”结论,在编号2组设计是实验操作中加;(2)、由上述实验可推知,镁条变黑的条件是。(3)、【反思与评价】该同学在猜想时,认为镁条变黑与O2有关,与空气另一主要成分无关,其理由是。32. 铁在不同环境条件下锈蚀的快慢不同。为了比较铁在不同酸性环境中锈蚀的快慢,科学兴趣小组利用如图所示装置进行实验探究。
可选用的器材:铁粉、溶质质量分数为7.3%的盐酸、蒸馏水、烧杯、量筒、托盘天平。
建议:铁粉可装入纱布吊袋内;每组宜取10mL盐酸溶液;每组实验时间不超过1周。
实验步骤:
①利用提供的盐酸和蒸馏水,配置溶质质量分数为3.65%的盐酸
②检查装置气密性;
……
(1)、写出步骤①中所需要的测量工具。(2)、补充完整实验步骤②之后的其它步骤。。四、解答题
-
33. 某金属混合物的主要成分是锌、铁和铜,课外兴趣小组将500克稀硫酸溶液不断加到50克金属混合物中得到如下数据:
次数
第1次
第2次
第3次
第4次
第5次
加入稀硫酸溶液的质量/克
100
100
100
100
100
剩余固体的质量/克
37
24.9
a
3
3
(1)、表格中“a”的值为;(2)、其所用稀硫酸溶液的溶质质量分数为多少?(3)、第2次反应结束后,溶液中含有的溶质有。34. 有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:甲
乙
丙
取用金属混合物的质量/g
10
10
20
取用稀硫酸的质量/g
100
120
100
反应后过滤,得干燥固体的质量/g
4.4
4.4
14.4
回答下列问题:
(1)、丙同学所得混合物中铜的质量是。(2)、甲所得溶液中含有溶质的是。(3)、根据实验数据分析,若取用金属混合物15g,加入到120g稀硫酸中,充分反应后最终得到固体质量为。(4)、计算丙同学所得溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)35. 将Cu-Zn合金样品20g放入足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示。试计算: (1)、原样品中所含锌的质量。(2)、实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数。
(1)、原样品中所含锌的质量。(2)、实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数。
