四川省成都市青羊区2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-10-09 类型:期末考试
一、单选题
-
1. 下列物质中,属于溶液的是( )
A、蔗糖水 B、牛奶 C、米粥 D、豆浆2. 某原子的原子核内有1个质子和2个中子,则该原子的核外电子数为( )A、3 B、2 C、1 D、03. 垃圾分类从你我他开始。饮料罐属于( )A、 可回收垃圾
B、
可回收垃圾
B、 有害垃圾
C、
有害垃圾
C、 厨余垃圾
D、
厨余垃圾
D、 其他垃圾
4. 乙醇俗称酒精,其完全燃烧的的化学方程式为:C2H5OH+3O2 2CO2+3H2O,根据该化学方程式无法获取的信息是( )A、反应物和生成物 B、反应所需条件 C、反应物的颜色和状态 D、生成物的分子个数比5. 下列化学符号正确的是 ( )
其他垃圾
4. 乙醇俗称酒精,其完全燃烧的的化学方程式为:C2H5OH+3O2 2CO2+3H2O,根据该化学方程式无法获取的信息是( )A、反应物和生成物 B、反应所需条件 C、反应物的颜色和状态 D、生成物的分子个数比5. 下列化学符号正确的是 ( )
A、1个—氧化碳分子:Co B、2个碳酸根离子:2CO32- C、3个亚铁离子:3Fe3+ D、4个氢原子:2H26. 化学与生活息息相关,下列说法错误的是( )A、家用电器着火,立即用水浇灭 B、炒菜时油锅着火,应立即盖上锅盖 C、“钻木取火”的原理是通过摩擦生热使温度达到木材着火点 D、燃气灶火焰出现黄色,锅底出现黑色时,可增大灶具进风口7. 不同温度时,NaCl固体的溶解度如下表所示。20℃时,将50 g NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。下列说法正确的是( )温度/℃
20
40
60
80
100
溶解度/g
36.0
36.6
37.3
38.4
39.8
A、烧杯中溶液的质量为150g B、烧杯中剩余固体的质量为14g C、加入50g水,搅拌后烧杯中仍有剩余固体 D、升高温度能将烧杯中的饱和溶液变为不饱和溶液8. 下列各图所示装置的气密性检查中,漏气的是( )A、 B、
B、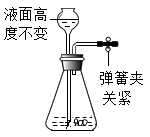 C、
C、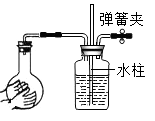 D、
D、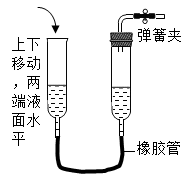 9. 下表是元素周期表的一部分,则下列回答正确的是( )
9. 下表是元素周期表的一部分,则下列回答正确的是( )11 Na
钠
12 Mg
镁
13 Al
铝
14 Si
硅
15 P
磷
16 S
硫
17 Cl
氯
18 Ar
氩
A、12号元素的离子符号是Mg+2 B、氯原子的原子结构示意图是 C、表中左边是非金属元素、右边是金属元素
D、硫元素的相对原子质量为16g
10. 实验课上,鲲鹏实验组设计了如下四个实验,其中不能达到目的是( )A、
C、表中左边是非金属元素、右边是金属元素
D、硫元素的相对原子质量为16g
10. 实验课上,鲲鹏实验组设计了如下四个实验,其中不能达到目的是( )A、 验证二氧化碳的密度比空气大
B、
验证二氧化碳的密度比空气大
B、 探究空气中氧气含量
C、
探究空气中氧气含量
C、 验证质量守恒定律
D、
验证质量守恒定律
D、 探究反应物浓度对反应速率的影响
11. 中国科学家成功将二氧化碳转化为乙烯(C2H4),其反应前后分子种类的微观示意图如图所示。下列说法错误的是( )
探究反应物浓度对反应速率的影响
11. 中国科学家成功将二氧化碳转化为乙烯(C2H4),其反应前后分子种类的微观示意图如图所示。下列说法错误的是( ) A、反应中原子种类没有改变 B、反应前后分子种类发生了改变 C、丙和丁中的氢元素全部来自于乙中 D、参加反应的甲与生成的丙质量比为11:712. 如图所示装置可用于实验室制取某些气体,并能随开随用。下表中所选用的药品及制取的气体完全正确的一组是( )
A、反应中原子种类没有改变 B、反应前后分子种类发生了改变 C、丙和丁中的氢元素全部来自于乙中 D、参加反应的甲与生成的丙质量比为11:712. 如图所示装置可用于实验室制取某些气体,并能随开随用。下表中所选用的药品及制取的气体完全正确的一组是( )
选项
选用药品
制取的气体
固体M
液体N
A
锌粒
稀硫酸
氢气
B
碳酸钠
浓盐酸
二氧化碳
C
大理石
稀硫酸
二氧化碳
D
二氧化锰
过氧化氢
氧气
A、A B、B C、C D、D13.如图为甲、乙两种固体物质在水中的溶解度曲线.下列说法错误的是( )
 A、甲物质的溶解度随温度的升高而增大 B、在t1℃时,甲、乙两物质的溶解度相等 C、在t2℃时,N点表示甲物质的不饱和溶液 D、在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g14. 某密闭容器内有四种物质,在一定条件下充分反应。测得反应前后各物质质量如下表。
A、甲物质的溶解度随温度的升高而增大 B、在t1℃时,甲、乙两物质的溶解度相等 C、在t2℃时,N点表示甲物质的不饱和溶液 D、在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g14. 某密闭容器内有四种物质,在一定条件下充分反应。测得反应前后各物质质量如下表。物质
X
Y
Z
Q
反应前质量/g
224
10
0
2
反应后质量/g
2
170
44
a
下列有关说法中错误的是( )
A、a的值等于18 B、X是反应物 C、该反应属于分解反应 D、若Y和Z的相对分子质量之比为20:11,则Y和Z的化学计量系数(即化学方程式中化学式前的系数)之比为2:115. 将一定质量木炭跟少量氧气放在密闭的容器里加热,充分反应。下图一定不能正确反映容器内有关物质的质量随时间变化而变化的关系图像是( )A、 B、
B、 C、
C、 D、
D、
二、填空题
-
16. 科技改变生活。(1)、氮气充入食品包装袋防腐,是因为。(2)、宇航员太空行走时,需要“人造空气”供给呼吸。这种“人造空气”中含有体积分数为70%的氮气、20%以上的氧气、还有二氧化碳。“人造空气”中供给呼吸的物质是 , “人造空气”中的氮气和空气中的氮气化学性质(填“相同”或“不同”)。(3)、修建高铁过程中常用黑火药(含KNO3、S、C)进行工程爆破,黑火药爆炸时产生浓烟,推测该浓烟中含有K2S,从元素守恒角度说明理由。(4)、最新研究表明,在光照条件下,利用Pt/TiO2为催化剂分解水可以得到过氧化氢和氢气,该反应的化学方程式为。17. 人类的生产生活离不开燃料。
 (1)、化石燃料包括天然气、煤和 , 天然气的主要成分是。(2)、家用燃气热水器的工作原理如图1所示,若“空气进气孔”被部分堵塞,导致天然气燃烧不充分,会产生的有毒气体是。(3)、氢气属于清洁燃料,是因为。工业上利用氢氧焰(氢气在氧气中燃烧所产生的高温火焰)切割金属。进行图2所示实验:关闭K,点燃氢气(已验纯),铁丝发红,不熔断;打开K,一段时间后,点燃氢气(已验纯),铁丝熔断。出现上述不同现象的原因是。(4)、开发和利用新能源是解决能源问题的重要途径。下列利用了新能源的是(填序号)。
(1)、化石燃料包括天然气、煤和 , 天然气的主要成分是。(2)、家用燃气热水器的工作原理如图1所示,若“空气进气孔”被部分堵塞,导致天然气燃烧不充分,会产生的有毒气体是。(3)、氢气属于清洁燃料,是因为。工业上利用氢氧焰(氢气在氧气中燃烧所产生的高温火焰)切割金属。进行图2所示实验:关闭K,点燃氢气(已验纯),铁丝发红,不熔断;打开K,一段时间后,点燃氢气(已验纯),铁丝熔断。出现上述不同现象的原因是。(4)、开发和利用新能源是解决能源问题的重要途径。下列利用了新能源的是(填序号)。
三、计算题
-
18. 果糖(C6H12O6)主要存在于蜂蜜、水果中,具有口感好、甜度高等优点。请回答:(1)、果糖分子中碳、氢、氧原子的个数比为。(2)、果糖中氧元素质量分数的计算式为。19. 某潜水艇上有100人,如果每人每天消耗氧气为1.44 kg,所需要的氧气全部由Na2O2与CO2反应来提供,则每天总共需要Na2O2的质量是多少?(已知:2Na2O2+2CO2=2Na2CO3+O2。)
四、综合题
-
20. 高纯硅可用于制备硅半导体材料,其主要生产流程如下图所示:
 (1)、① 发生反应的化学方程式为SiO2 + 2C Si + 2CO↑,该反应中碳元素的化合价变化为零价→+2价,硅元素的化合价变化为。(2)、② 反应的基本反应类型为(填“化合反应”或“分解反应”)。(3)、SiO2属于(填序号)。
(1)、① 发生反应的化学方程式为SiO2 + 2C Si + 2CO↑,该反应中碳元素的化合价变化为零价→+2价,硅元素的化合价变化为。(2)、② 反应的基本反应类型为(填“化合反应”或“分解反应”)。(3)、SiO2属于(填序号)。A.纯净物 B. 化合物 C. 氧化物
21. 尿素[CO(NH2)2]是一种常用氮肥,下图是利用甲烷制尿素的主要流程: (1)、设备Ⅲ中的反应在一定条件下进行,产生CO2和H2 , 该反应的化学方程式为 , 其中化合价升高的元素是。(2)、设备Ⅵ中,参加反应的物质是。(3)、设备Ⅴ中,可以循环利用的气体是。22. 根据下图所示的实验回答问题。
(1)、设备Ⅲ中的反应在一定条件下进行,产生CO2和H2 , 该反应的化学方程式为 , 其中化合价升高的元素是。(2)、设备Ⅵ中,参加反应的物质是。(3)、设备Ⅴ中,可以循环利用的气体是。22. 根据下图所示的实验回答问题。 (1)、甲中棉花的作用是。(2)、乙的目的是研究品红分子在水中的运动速率与的关系。(3)、丙是电解水实验,反应的化学方程式为:与电源正极相连的试管中产生的气体是。(4)、丁是验证质量守恒定律。其中红磷燃烧的现象是:充分反应并冷却后,天平仍保持平衡,从微观的角度解释其原因。23. 利用下图所示装置进行实验。
(1)、甲中棉花的作用是。(2)、乙的目的是研究品红分子在水中的运动速率与的关系。(3)、丙是电解水实验,反应的化学方程式为:与电源正极相连的试管中产生的气体是。(4)、丁是验证质量守恒定律。其中红磷燃烧的现象是:充分反应并冷却后,天平仍保持平衡,从微观的角度解释其原因。23. 利用下图所示装置进行实验。 (1)、打开K1 , 放入适量的过氧化氢溶液,关闭K1 , 观察到蜡烛 ;A中发生反应的化学方程式为 。(2)、为证明CO2在通常条件下不燃烧、也不支持燃烧,继续的操作是 。24. 在利用红磷燃烧测定空气中氧气含量的实验中,用传感器记录集气瓶内氧气浓度随时间变化的情况,如图所示。
(1)、打开K1 , 放入适量的过氧化氢溶液,关闭K1 , 观察到蜡烛 ;A中发生反应的化学方程式为 。(2)、为证明CO2在通常条件下不燃烧、也不支持燃烧,继续的操作是 。24. 在利用红磷燃烧测定空气中氧气含量的实验中,用传感器记录集气瓶内氧气浓度随时间变化的情况,如图所示。
(进行实验)
(1)、活动1:证明红磷熄灭后,氧气还有剩余实验装置
实验步骤
现象
结论
Ⅰ.用高能激光笔照射燃烧匙中足量的红磷
红磷燃烧,放出大量热,一段时间后熄灭,白磷始终不燃烧
红磷熄灭后,氧气还有剩余
Ⅱ.冷却后,将装有白磷的燃烧匙提出水面,用高能激光笔照射
白磷 现象①
(解释与结论)
红磷燃烧的化学方程式为。
(2)、步骤Ⅰ中白磷始终不燃烧的原因是。(3)、步骤Ⅱ中的现象①是。(4)、实验中气球的作用是。(5)、活动2:探究影响剩余氧气浓度的因素用如图装置进行实验,得到数据如表。
可燃物
白磷
红磷
木炭
着火点/℃
40
240
370
生成物状态
固态
固态
气态
剩余氧气浓度
3.1%
7.0%
14.0%

通过对比右表中红磷和白磷的相关数据,可以得出影响剩余氧气浓度的因素可能是。
(6)、结合以上探究及实验数据,在“测定空气中氧气含量”的实验中,通常使用红磷而不用木炭的原因可能有。