四川省成都市锦江区2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-10-09 类型:期末考试
一、单选题
-
1. 小编整理2020年度盘点时,下列“年度突破”中不属于化学学科研究领域的是( )A、开发研制对抗新冠病毒的疫苗 B、化学纳米传感器应用于快速诊断,检测新冠病毒 C、发现快速射电暴的新源头—磁星 D、重新设计大分子单体,制造更易回收的塑料2. 下列资源的利用过程中一定发生了化学变化的是( )
①甲烷用作家用燃料
②液氮作制冷剂
③利用风力发电
④利用高温煅烧石灰石制二氧化碳
⑤用高分子分离膜淡化海水
⑥75%的医用酒精用于防疫消毒
A、①③④ B、①②⑤ C、③④⑤ D、①④⑥3. 下列过程中主要利用物质的化学性质的是( )A、石墨棒用作于电池电极 B、石灰浆用于粉刷墙壁 C、稀有气体通电时发出不同颜色的光 D、汽油用于清洗油污4. 如图是两个关于水的实验,有关说法正确的是( ) A、实验1,试管a中收集到的气体能够燃烧,产生淡蓝色火焰 B、实验2,水变化前后分子的种类和分子间间隔均不改变 C、实验1、2都遵守质量守恒定律 D、实验1、2均能验证水的组成5. 下列关于实验现象的描述中正确的是( )A、用燃着的火柴去点蜡烛熄灭时产生的白烟,不能将蜡烛重新点燃 B、引燃的铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁 C、将二氧化碳通入紫色石蕊溶液中,溶液由紫色变成红色 D、向饱和的食盐溶液中加入少量蔗糖固体,蔗糖固体不能溶解6. 2020年6月我国成功发射第55颗北斗导航卫星的过程中,“长三乙”火箭第一,二级使用偏二甲肼和四氧化二氮作为推进剂,下列有关偏二甲肼(C2H8N2)的说法错误的是( )A、C,H,N三种元素的质量比为12:8:14 B、相对分子质量为(12×2+1×8+14×2) C、C,H,N原子的个数比为1:4:1 D、氮元素的质量分数为7. 下列对化学用语中数字“2”的意义描述正确的是( )A、NO2中表示二氧化氮中含有两个氧原子 B、 中表示镁元素的化合价为正二价 C、2He中表示两个氮元素 D、SO42-中表示一个硫酸根离子带两个负电荷8. 下列微观模型示意图可表示二氧化碳和水转化为乙醇的反应,下列说法错误的是( )
A、实验1,试管a中收集到的气体能够燃烧,产生淡蓝色火焰 B、实验2,水变化前后分子的种类和分子间间隔均不改变 C、实验1、2都遵守质量守恒定律 D、实验1、2均能验证水的组成5. 下列关于实验现象的描述中正确的是( )A、用燃着的火柴去点蜡烛熄灭时产生的白烟,不能将蜡烛重新点燃 B、引燃的铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁 C、将二氧化碳通入紫色石蕊溶液中,溶液由紫色变成红色 D、向饱和的食盐溶液中加入少量蔗糖固体,蔗糖固体不能溶解6. 2020年6月我国成功发射第55颗北斗导航卫星的过程中,“长三乙”火箭第一,二级使用偏二甲肼和四氧化二氮作为推进剂,下列有关偏二甲肼(C2H8N2)的说法错误的是( )A、C,H,N三种元素的质量比为12:8:14 B、相对分子质量为(12×2+1×8+14×2) C、C,H,N原子的个数比为1:4:1 D、氮元素的质量分数为7. 下列对化学用语中数字“2”的意义描述正确的是( )A、NO2中表示二氧化氮中含有两个氧原子 B、 中表示镁元素的化合价为正二价 C、2He中表示两个氮元素 D、SO42-中表示一个硫酸根离子带两个负电荷8. 下列微观模型示意图可表示二氧化碳和水转化为乙醇的反应,下列说法错误的是( ) A、丙物质是乙醇,俗称酒精,化学式为C2H5OH B、反应前后四种物质的分子个数比依次为2:3:1:3 C、反应前后四种物质都含有氧元素,所以都属于氧化物 D、该反应既能吸收二氧化碳缓解温室效应,还可以将其转化成含碳燃料,并释放氧气9. 已知:白磷、红磷的着火点分别是40℃、240℃,用下图装置进行实验(装置中夹持仪器已略去),将一定量的白磷、红磷分別浸入80℃热水中,白磷、红磷均不燃烧。下列分析正确的是( )
A、丙物质是乙醇,俗称酒精,化学式为C2H5OH B、反应前后四种物质的分子个数比依次为2:3:1:3 C、反应前后四种物质都含有氧元素,所以都属于氧化物 D、该反应既能吸收二氧化碳缓解温室效应,还可以将其转化成含碳燃料,并释放氧气9. 已知:白磷、红磷的着火点分别是40℃、240℃,用下图装置进行实验(装置中夹持仪器已略去),将一定量的白磷、红磷分別浸入80℃热水中,白磷、红磷均不燃烧。下列分析正确的是( ) A、水中白磷和红磷均不燃烧,说明白磷、红磷均不是可燃物 B、若升高右侧漏斗至红磷露出水面,便可观察到红磷燃烧 C、若升高左侧漏斗至白磷露出水面,便可观察到白磷燃烧,对比在水中白磷不燃烧的现象,可验证燃烧需可燃物与氧气接触 D、此实验装置既操作简便,又能防止空气污染10. 木炭还原氧化铜和一氧化碳还原氧化铜的实验装置分别如下图所示。下列分析或结论正确的是( )
A、水中白磷和红磷均不燃烧,说明白磷、红磷均不是可燃物 B、若升高右侧漏斗至红磷露出水面,便可观察到红磷燃烧 C、若升高左侧漏斗至白磷露出水面,便可观察到白磷燃烧,对比在水中白磷不燃烧的现象,可验证燃烧需可燃物与氧气接触 D、此实验装置既操作简便,又能防止空气污染10. 木炭还原氧化铜和一氧化碳还原氧化铜的实验装置分别如下图所示。下列分析或结论正确的是( ) A、两个实验中都可观察到红色粉末变黑的现象 B、木炭还原氧化铜的化学方程式为: C、两个实验结束时都要先撤出澄清石灰水中的导管,再停止加热 D、木炭和一氧化碳,都能夺去氧化铜中的氧,表现出还原性11. 除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )A、CuO(木炭粉):在空气中灼烧 B、H2O(NaCl):向水中加入活性炭吸附 C、CO(CO2):通过灼热的木炭层 D、CO2(CO):通过灼热的氧化铜粉末12. 硝酸钾的溶解度曲线如图所示。下列说法正确的是( )
A、两个实验中都可观察到红色粉末变黑的现象 B、木炭还原氧化铜的化学方程式为: C、两个实验结束时都要先撤出澄清石灰水中的导管,再停止加热 D、木炭和一氧化碳,都能夺去氧化铜中的氧,表现出还原性11. 除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是( )A、CuO(木炭粉):在空气中灼烧 B、H2O(NaCl):向水中加入活性炭吸附 C、CO(CO2):通过灼热的木炭层 D、CO2(CO):通过灼热的氧化铜粉末12. 硝酸钾的溶解度曲线如图所示。下列说法正确的是( ) A、溶质的质量分数:b>a>c B、将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液 C、60℃时,向50g水中加入70gKNO3 , 形成不饱和溶液 D、从溶液中获得KNO3晶体的方法是:蒸发浓缩后再冷却结晶13. 下列四个图像与对应描述不相符的是( )
A、溶质的质量分数:b>a>c B、将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液 C、60℃时,向50g水中加入70gKNO3 , 形成不饱和溶液 D、从溶液中获得KNO3晶体的方法是:蒸发浓缩后再冷却结晶13. 下列四个图像与对应描述不相符的是( )

A.水通电,生成两种气体的体积变化
B.加热31.6g高锰酸钾,开始分解后固体质量随时间变化


C.将5gNH4NO3溶于20mL水中,溶液的温度随时间变化
D.将t℃溶质质量分数为w的NaCl饱和溶液20g。升温至90℃时溶质质量分数随温度变化
A、A B、B C、C D、D二、多选题
-
14. 生活中广泛用于照明、显像等领域的LED技术,从化学物质的角度来看实际是一种高光效氮化镓发光二极管,下图分别是氮、镓的原子结构示意图和在元素周期表中的信息,下列说法正确的是( )
 A、氮化镓的化学式为GaN3 B、镓原子在化学反应中容易失去电子,形成Ga3+ C、镓元素的相对原子质量是69.72g D、氮元素在周期表中位于第2周期VA族
A、氮化镓的化学式为GaN3 B、镓原子在化学反应中容易失去电子,形成Ga3+ C、镓元素的相对原子质量是69.72g D、氮元素在周期表中位于第2周期VA族三、填空题
-
15. 2020年12月17日,“嫦娥五号”在月球采集2公斤月壤成功返回地球,实现了我国首次月球无人采样返回,月壤成分非常复杂,还有待深入研究,但最令人瞩目的是它蕴含丰富的氦-3(He3),氦-3具有核发电效率非常高且放射性小,反应过程易控制等优点,既环保又安全,结合以前,科学家们在月球岩石中已经发现的:克利普岩(富含“K、P、U(铀),Tb(钍)”)、斜长岩(富含“Si、Al、Mg、Ca、Na”)、玄武岩(富含“Fe、Ti(钛)”)等,这些月球的“土”特产,未来可能会成为人类的宝贵资源。



根据信息回答下列问题:
(1)、请画出氦-3原子的结构示意图。(2)、钍元素的原子序数为;铀的元素符号是。钍元素和铀元素的本质区别是不同。(3)、根据结构示意判断,钙原子在化学反应中容易失去电子形成(用离子符号表示);钙、镁元素化学性质相似的原因是:。(4)、据悉氧化铝陶瓷可用于运载火箭腹部作隔热瓦,可推测氧化铝耐 , 写出氧化铝的化学式是。(5)、本次运载“嫦五”的火箭第一、二级是以液氢和液氧为推进剂。液氢燃烧产生动力的化学反应方程式是。16. 2020年12月18日,成都地铁五线齐发,成都轨道交通运营里程突破500公里。(1)、“文明乘车,从我做起”,乘坐地铁时,禁止携带易燃易爆等危险品上车,如:(请任举一例),也不要在车厢内食用臭豆腐、榴莲等食物,从分子的角度说明原因 , 疫情防控期间,乘坐地铁时还要戴好口罩。口罩中的无纺布面料主要是聚丙烯((C3H6)n),聚丙烯中碳、氢元素的质量比为。(2)、多条地铁的运行,使成都市民出行史加便利,减少了私家车的使用,大大降低了汽车尾气中(请任举一例)等污染物的排放,有利于改善成都的空气质量。四、计算题
-
17. 已知一种新型“人造树叶”能将CO2转化成乙醇(C2H5OH),反应的化学方程式为: ,研究显示,1L“人造树叶”每天能从空气中吸收968gCO2 , 根据化学方程式计算,1L“人造树叶”工作1天可得到的乙醇的质量是多少?
五、综合题
-
18. 小霏同学元旦节从青城山带回一瓶浑浊且有异味的山泉水,她在化学实验室模仿自来水厂净化过程后,最终制成蒸馏水,操作流程如下图所示:
 (1)、明矾的作用是。若操作①后,所得液体仍然浑浊,其原因可能是(从下列选项中选择)。
(1)、明矾的作用是。若操作①后,所得液体仍然浑浊,其原因可能是(从下列选项中选择)。A 漏斗内滤纸有破损 B 漏斗下端未紧靠烧杯内壁 C 漏斗内液面高于滤纸的边缘
(2)、取少量液体D于试管中,加入 , 振荡,发现有产生,说明液体D是硬水。(3)、小霏同学用得到的蒸馏水配制100g质量分数为16%的Na2CO3溶液,用于模拟泡沫灭火器原理。实验操作示意图如下,回答下面的问题:
①计算:需要Na2CO3的质量为g;②称量:用称取Na2CO3 , 用规格为mL(填“10”、“50”或“100”)的量筒量取所需要的水。
③溶解:用玻璃棒搅拌
(4)、从烧杯⑤中把溶液倒入吸滤瓶的正确操作是 , 从⑦中橡胶管喷出大量液体的原因是。19. 下面框图中A、B、C、D、E均为氧化物,甲、乙为单质,A的溶液常用于实验室制取甲气体,C是生活中常见液体,E可用作温室中的气体肥料,丙是澄清石灰水的溶质,B、乙为黑色固体。各物质间转化关系如下图所示,反应物、生成物均已标出,反应条件未标出。 (1)、反应①的化学方程式为。(2)、反应②的过程中热量。(3)、反应③的基本反应类型属于:。(4)、反应④常用于检验气体E,其化学方程式为:。20. 实验室里现有氯酸钾、二氧化锰,以及下列仪器和用品,根据要求回答下列问题:
(1)、反应①的化学方程式为。(2)、反应②的过程中热量。(3)、反应③的基本反应类型属于:。(4)、反应④常用于检验气体E,其化学方程式为:。20. 实验室里现有氯酸钾、二氧化锰,以及下列仪器和用品,根据要求回答下列问题: (1)、实验室利用上述药品制取O2应选用的仪器用品是(填序号,且在①至⑩中选择),反应的化学方程式为:。请简述检查此发生装置气密性的方法是。(2)、若将仪器⑪内装满水,再将(填“a”或“b”)端连接量筒,就可以粗略测定收集的O2体积,若仪器⑪内不装水,而倒置变成仪器⑫,此时用排空气法收集O2 , 则气体应从端(填“a”或“b”)通入仪器⑫中。(3)、加热KClO3固体制氧气(1.5gMnO2作催化剂),并对KClO3完全分解后的残留固体进行分离(KCl的溶解度曲线如图所示)。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲在室温下将KCl全部溶解,至少应加入蒸馏水的体积约(填字母)。
(1)、实验室利用上述药品制取O2应选用的仪器用品是(填序号,且在①至⑩中选择),反应的化学方程式为:。请简述检查此发生装置气密性的方法是。(2)、若将仪器⑪内装满水,再将(填“a”或“b”)端连接量筒,就可以粗略测定收集的O2体积,若仪器⑪内不装水,而倒置变成仪器⑫,此时用排空气法收集O2 , 则气体应从端(填“a”或“b”)通入仪器⑫中。(3)、加热KClO3固体制氧气(1.5gMnO2作催化剂),并对KClO3完全分解后的残留固体进行分离(KCl的溶解度曲线如图所示)。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲在室温下将KCl全部溶解,至少应加入蒸馏水的体积约(填字母)。
A 5 mL B 10 mL C 20 mL D 30 mL
对溶解所得混合物进行过滤,滤渣经洗涤、干燥处理得MnO2:从滤液中获得KCl晶体的最佳方法是。
21. 某化学兴趣小组进行二氧化碳实验室制取与部分性质的自主探究实验:(1)、Ⅰ、探究药品选择:按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应),产生CO2体积随时间变化曲线如图1所示:

实验编号
药品
1
块状大理石、10%H2SO4溶液
2
块状大理石、7%HCl溶液
3
大理石粉末、7%HCl溶液
图1中甲对应实验(选填“1”“2”或“3”):不选用丙对应的药品制取CO2的理由是;确定选用乙对应的药品制取CO2的化学方程式是。
(2)、Ⅱ、探究改进装置创新实验:
连接装置,检验装置气密性良好。
利用改进装置(如图2)收集并验证二氧化碳的性质:
①打开K2、关闭K1时,可利用A、C装置验证CO2的性质。
②打开K1、关闭K2时,可利用A、B装置制取一瓶CO2。请将B装置中的导管补画完整。补画后检验B中CO2已收集满的方法是。
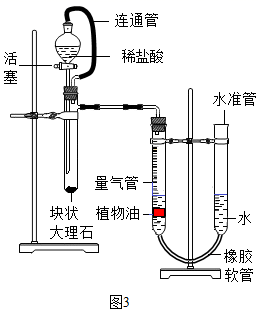
(3)、利用创新实验(图3)粗略测定收集的CO2的体积:①打开活塞,把稀盐酸加入试管,观察到的现象是。反应结束后进行读数,读数前调节水准管与量气管液面相平的原因是。
②实验中,加入稀盐酸体积为V1mL,左侧量气管最后读数为VmL,则反应生成CO2体积约为mL。该实验条件下CO2密度为dg/mL,则大理石样品中碳酸钙质量表达式为g。
(4)、Ⅲ、探究不同物质对CO2的吸收效果:利用已收集满250mLCO2的3个的烧瓶进行实验,如下图所示,同时迅速将注射器内液体全部注入各自烧瓶中,关闭活塞:一段时间后,同时振荡三个烧瓶。分别得到图4所示的烧瓶内压强与时间的关系曲线图。


回答下列问题:
①实验步骤中,曲线1、2、3中导致气压快速变小(如:cd段)的原因是。
②曲线1对应反应的化学方程式为。
③根据图4所示曲线,可以得出的结论是(填字母序号)。
A. 1体积水中溶解CO2的量约为1体积
B. CO2能与水发生反应生成碳酸
C. CO2能与NaOH溶液发生反应
D. 40%NaOH溶液比澄清石灰水更适合用于吸收CO2
-
-