黑龙江省鸡西市密山市(五四学制)2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-09-29 类型:期末考试
一、单选题
-
1. 很多用电器的插头都是铜制插头,这是利用了金属铜的( )A、延展性 B、导电性 C、弹性 D、导热性2. 下列物质不能在水中形成溶液的是( )A、白糖 B、食盐 C、醋酸 D、面粉3. 下列是生活中常见物质的pH范围,显碱性的是( )A、葡萄汁(3.5~4.5) B、鸡蛋清(7.6~8.0) C、纯牛奶(6.3~6.6) D、苹果汁(2.9~3.3)4. 下列金属单质能与稀盐酸反应放出氢气的是( )A、Cu B、Fe C、Ag D、Au5. 常见的金属矿石赤铁矿的主要成分是( )A、Fe2O3 B、Fe3O4 C、FeCO3 D、Al2O36. 下列可以作为溶质的是( )A、只有固体 B、只有液体 C、只有气体 D、固体或液体或气体7. 下列物质溶于水因发生化学反应放出热量的是( )A、NaOH B、NH4NO3 C、NaCl D、CaO8. 不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是( )A、食醋 B、氨水 C、NaCl溶液 D、Na2CO3溶液9. 化把对提高农作物的产量具有重要作用。下列化属于复合肥料的是( )A、CO(NH2)2 B、(NH4)2 HPO4 C、K2SO4 D、Ca(H2 PO4)210. 下列化学方程式正确的是( )A、 B、 C、 D、11. 下列关于Ca(OH)2的说法错误的是( )A、微溶于水,水溶液呈碱性 B、能与酸反应,可用于治疗胃酸过多 C、可用来改良酸性土壤 D、澄清溶液可用来检验CO212. 现有X、Y、Z三种金属,如果把X、Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y、Z分别放入到硝酸银溶液中,Y表面有银析出,而Z没有变化,判断X、Y、Z的金属活动性顺序( )A、X>Z>Y B、Y>X>Z C、X>Y>Z D、Z>Y>X13. 下列能使紫色石蕊试液和无色酚酞试液均变色的是( )A、pH=1的盐酸 B、pH=3的硫酸 C、pH=7的氯化钠溶液 D、pH=14的氢氧化钾溶液14. 下列对实验现象的描述错误的是( )A、打开盛有浓硫酸的试剂瓶,瓶口产生大量白雾 B、将二氧化碳通入紫色石蕊试液中,溶液变红 C、打开盛有浓盐酸的试剂瓶,瓶口产生大量白雾 D、镁和稀盐酸反应产生大量气泡,放出热量15. 硫酸是一种重要的工业原料,下列说法错误的是( )A、浓硫酸可用于干燥O2 B、浓硫酸可使纸张炭化 C、实验室可用块状石灰石与稀硫酸制备CO2 D、稀硫酸可用于金属表面除锈16. 某工厂排出的废水pH小于7,并含有较多的Cu2+ , 对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入( )A、烧碱和纯碱 B、盐酸和铁粉 C、生石灰和铁粉 D、熟石灰和金属银17. 线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如右图所示实验,探究铁生锈的条件。下列说法错误的是( )
 A、乙试管中植物油的作用是隔绝空气 B、只有甲试管中的铁钉有明显锈迹 C、乙丙两支试管的实验现象说明铁生锈需要水 D、实验表明铁生锈是铁与空气和水共同作用的结果18. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是( )
A、乙试管中植物油的作用是隔绝空气 B、只有甲试管中的铁钉有明显锈迹 C、乙丙两支试管的实验现象说明铁生锈需要水 D、实验表明铁生锈是铁与空气和水共同作用的结果18. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是( )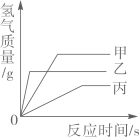 A、完全反应所需时间:丙>甲>乙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙
A、完全反应所需时间:丙>甲>乙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙二、多选题
-
19. 下列各组离子能大量共存,且形成无色溶液的是( )A、Cu2+ OH- B、Ag+ Ca2+ Cl- C、K+ OH- D、Na+ K+20. 下表有关物质的除杂方法中,正确的是( )
实验目的
有关实验方案
A
除去NaCl溶液中混有少量的Na2CO3
加入适量稀硫酸、蒸发结晶
B
除去FeCl2 溶液中混有少量的CuCl2
加入过量的铁粉、过滤
C
除去NaCl溶液中少量MgCl2
加入适量的NaOH溶液、过滤
D
稀盐酸(稀硫酸)
加入适量的Ba(NO3)2溶液、 过滤
A、A B、B C、C D、D三、填空题
-
21. 生活中的一些物质中含有酸碱盐,请选择适当的物质填空(选填序号):
A 、盐酸 B 、碳酸钙 C、 氢氧化钠 D、 氯化钠 E、 碳酸氢钠
(1)、胃液中含有的帮助消化的物质是;(2)、能除油污,可作炉具清洁剂的是;(3)、是焙制糕点所用的发酵粉的主要成分之一的物质是;(4)、生活中,用于腌渍蔬菜、鱼、蛋等,起到延长保存时间作用的物质是;(5)、可用作建筑材料的是;22. 根据下图,回答下列问题。 (1)、写出溶剂的化学式(2)、写出图中阴离子的符号(3)、写出KOH与盐酸反应的化学方程式: , 该反应类型为反应。23. 金属在生产、生活和社会发展中的应用较为广泛。(1)、今年新冠病毒肆虐全球,抗疫过程我们用到了多种材料。修建火神山、雷神山两座医院时,用到了大量铝合金材料,铝合金密度小、硬度大、耐腐蚀。铝制品耐腐蚀的原因是(请用 化学反应方程式表示)。(2)、近年来,我国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是铁合金,与纯铁相比较,铁合金具有的优良性能(答一点)。(3)、早在明代宋应星所著的《天工开物》里就对铁器的生产和使用有所记载,到了现代,炼铁技术得到进一步发展。炼铁的原理是利用一氧化碳与氧化铁 的反应,请写出该反应的化学方程式 , 该反应(填“属于”或“不属于”)置换反应。(4)、钢窗表面喷漆不仅美观,而且可有效防止铁与空气中的 接触而生锈。(5)、为了防止家中常用的铁锅生锈,你的做法是;除防止金属腐蚀外,请再写出一条保护金属资源的有效途径:。(6)、工业上可用稀盐酸除去铁锈,该反应的化学方程式为24. 写出下列反应的化学方程式。(1)、氯化钡溶液(BaCl2)和硫酸反应(2)、碳酸钙和盐酸反应25. 化学与生活、生产息息相关,请运用化学知识回答以下问题。(1)、用石灰浆粉刷墙壁,干燥后墙面变硬的原因是。(用化学方程式表示)。(2)、服用含有氢氧化铝的药物可以治疗胃酸过多症,这是因为(用化学方程 式表示)。26. A、B、C三种固体物质的溶解度曲线如图所示,请完成下列问题:
(1)、写出溶剂的化学式(2)、写出图中阴离子的符号(3)、写出KOH与盐酸反应的化学方程式: , 该反应类型为反应。23. 金属在生产、生活和社会发展中的应用较为广泛。(1)、今年新冠病毒肆虐全球,抗疫过程我们用到了多种材料。修建火神山、雷神山两座医院时,用到了大量铝合金材料,铝合金密度小、硬度大、耐腐蚀。铝制品耐腐蚀的原因是(请用 化学反应方程式表示)。(2)、近年来,我国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是铁合金,与纯铁相比较,铁合金具有的优良性能(答一点)。(3)、早在明代宋应星所著的《天工开物》里就对铁器的生产和使用有所记载,到了现代,炼铁技术得到进一步发展。炼铁的原理是利用一氧化碳与氧化铁 的反应,请写出该反应的化学方程式 , 该反应(填“属于”或“不属于”)置换反应。(4)、钢窗表面喷漆不仅美观,而且可有效防止铁与空气中的 接触而生锈。(5)、为了防止家中常用的铁锅生锈,你的做法是;除防止金属腐蚀外,请再写出一条保护金属资源的有效途径:。(6)、工业上可用稀盐酸除去铁锈,该反应的化学方程式为24. 写出下列反应的化学方程式。(1)、氯化钡溶液(BaCl2)和硫酸反应(2)、碳酸钙和盐酸反应25. 化学与生活、生产息息相关,请运用化学知识回答以下问题。(1)、用石灰浆粉刷墙壁,干燥后墙面变硬的原因是。(用化学方程式表示)。(2)、服用含有氢氧化铝的药物可以治疗胃酸过多症,这是因为(用化学方程 式表示)。26. A、B、C三种固体物质的溶解度曲线如图所示,请完成下列问题: (1)、t3℃时,A,B,C三种物质的溶解度由大到小的顺序是。(2)、t2℃时,配制140gA物质的饱和溶液需要A物质的质量g。(3)、现有t1℃接近饱和的C溶液,在不改变溶液中溶质的质量分数的前提下,要使其变为饱和溶液,可采取的一种措施是。(4)、若B中含有少量的A物质,可采用方法提纯B。27. 小雨同学为验证镁、铁、锌三种金属的活动性,进行了下图所示实验:
(1)、t3℃时,A,B,C三种物质的溶解度由大到小的顺序是。(2)、t2℃时,配制140gA物质的饱和溶液需要A物质的质量g。(3)、现有t1℃接近饱和的C溶液,在不改变溶液中溶质的质量分数的前提下,要使其变为饱和溶液,可采取的一种措施是。(4)、若B中含有少量的A物质,可采用方法提纯B。27. 小雨同学为验证镁、铁、锌三种金属的活动性,进行了下图所示实验: (1)、实验中小雨观察到的现象是:盛有镁片的试管中反应、盛有铁片的试管中反应、盛有锌片的试管中反应 , 由此得出三种金属的活动性:镁>锌>铁;(2)、小明还补充了铁片与硫酸铜溶液反应的实验,实验中观察到的现象是:、 , 有关反应的化学方程式为。 由此得出铁、铜两种金属的活动性:铁铜(填“>”“=”“<”)。28. 综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六只试管中进行实验(如图所示),请回答下列问题:
(1)、实验中小雨观察到的现象是:盛有镁片的试管中反应、盛有铁片的试管中反应、盛有锌片的试管中反应 , 由此得出三种金属的活动性:镁>锌>铁;(2)、小明还补充了铁片与硫酸铜溶液反应的实验,实验中观察到的现象是:、 , 有关反应的化学方程式为。 由此得出铁、铜两种金属的活动性:铁铜(填“>”“=”“<”)。28. 综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六只试管中进行实验(如图所示),请回答下列问题: (1)、上述六只试管中有气泡产生的是(填序号),相关反应的化学方程式为(只写出一个)。(2)、能证明“C试管中发生了化学反应”的现象是。(3)、有一只试管中的物质不与稀盐酸反应,原因是。
(1)、上述六只试管中有气泡产生的是(填序号),相关反应的化学方程式为(只写出一个)。(2)、能证明“C试管中发生了化学反应”的现象是。(3)、有一只试管中的物质不与稀盐酸反应,原因是。四、综合题
-
29.(1)、如图是粗盐提纯实验的操作示意图。
 (2)、此操作在加热过程中,需要用玻璃棒不断搅拌,这 是为了防止。30. 某化学兴趣小组开展的氢氧化钠性质系列探究活动如下图所示。
(2)、此操作在加热过程中,需要用玻璃棒不断搅拌,这 是为了防止。30. 某化学兴趣小组开展的氢氧化钠性质系列探究活动如下图所示。

回答下列问题:
(1)、实验①观察到氢氧化钠表面变。(2)、实验②观察到紫色石蕊溶液变成色,实验③观察到无色酚酞 溶液变成色。由此得出:碱溶液能使指示剂变色。(3)、实验④:I.当滴加稀盐酸至溶液呈中性时,溶液显色;继续滴加稀盐酸并用玻璃棒不断搅拌,此时溶液中的溶质除酚酞外还有、(填 化学式)
Ⅱ.如图是氢氧化钠与盐酸反应的微观模拟示意图:

从微观的角度分析,甲、乙两处应填入的离子符号分别为OH-和。
(4)、实验⑤观察到的现象是 , 说明碱溶液能与某些盐反应。该反应的化学方程式为。(5)、实验④⑤对应的化学反应,属于中和反应的是(填数字序号)。(6)、实验⑥⑦为用软矿泉水瓶所做的对比实验,装的软矿泉水瓶变瘪更明显,原因是(用化学方程式表示)。五、计算题