浙教版科学九年级第二章金属性质
试卷更新日期:2021-09-29 类型:同步测试
一、单选题
-
1. 下列有关说法正确的是( )A、O2具有助燃性 B、铁生锈属于物理变化 C、金属活动性Cu比Mg强 D、KClO3属于氧化物2. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“---”表示相邻的两种物质能发生反应。若甲为铁, 乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种, 则下列判断错误的是( )
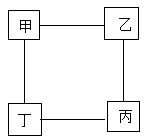 A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO43. 能用金属与同一种稀酸反应制取的化合物是( )A、CuCl2 , AlCl3 B、ZnCl2 , MgCl2 C、Fe2( SO4),FeSO4 D、Na2SO3 , K2SO44. 下列图像不能正确表示对应变化关系的是( )
A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO43. 能用金属与同一种稀酸反应制取的化合物是( )A、CuCl2 , AlCl3 B、ZnCl2 , MgCl2 C、Fe2( SO4),FeSO4 D、Na2SO3 , K2SO44. 下列图像不能正确表示对应变化关系的是( ) A、图甲表示向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸时,产生的H2质量与稀盐酸质量的关系 B、图乙表示两份完全相同的双氧水在有无MnO2情况下,产生O2质量与反应时间的关系 C、图丙表示向一定量的稀盐酸中加入过量的NaOH溶液时,溶液pH随NaOH溶液质量的变化关系 D、图丁表示向一定量Ba(OH)2溶液中滴加过量H2SO4溶液时的溶液导电性与时间的关系5. 小科按如图流程进行实验(假设每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤液中加入少量铁粉,无明显现象。由此实验可知( )
A、图甲表示向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸时,产生的H2质量与稀盐酸质量的关系 B、图乙表示两份完全相同的双氧水在有无MnO2情况下,产生O2质量与反应时间的关系 C、图丙表示向一定量的稀盐酸中加入过量的NaOH溶液时,溶液pH随NaOH溶液质量的变化关系 D、图丁表示向一定量Ba(OH)2溶液中滴加过量H2SO4溶液时的溶液导电性与时间的关系5. 小科按如图流程进行实验(假设每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤液中加入少量铁粉,无明显现象。由此实验可知( ) A、滤渣中一定有铜和铁 B、金属的活动性顺序:Zn>Fe>Cu C、两支试管混合后,固体总质量一定增加 D、滤液中的溶质一定有FeCl2、ZnCl2 , 可能含有CuCl26. 小明为探究镁、锌、铜、银的活动性顺序,设计如下实验流程,依据该流程设计,下面对物质①、②的选择合理的是( )
A、滤渣中一定有铜和铁 B、金属的活动性顺序:Zn>Fe>Cu C、两支试管混合后,固体总质量一定增加 D、滤液中的溶质一定有FeCl2、ZnCl2 , 可能含有CuCl26. 小明为探究镁、锌、铜、银的活动性顺序,设计如下实验流程,依据该流程设计,下面对物质①、②的选择合理的是( ) A、①稀盐酸 ②硝酸银 B、①稀硫酸 ②硫酸锌 C、①稀盐酸 ②硫酸亚铁 D、①稀硫酸 ②硝酸镁7. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )
A、①稀盐酸 ②硝酸银 B、①稀硫酸 ②硫酸锌 C、①稀盐酸 ②硫酸亚铁 D、①稀硫酸 ②硝酸镁7. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )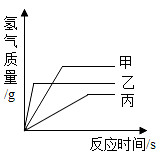 A、甲、乙、丙依次可能是Mg、Zn、Fe B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙8. 下列图象不能正确反映对应变化关系的是( )A、向二氧化锰中加入一定量的双氧水
A、甲、乙、丙依次可能是Mg、Zn、Fe B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙8. 下列图象不能正确反映对应变化关系的是( )A、向二氧化锰中加入一定量的双氧水 B、向一定量的稀盐酸中加入氢氧化钠溶液至过量
B、向一定量的稀盐酸中加入氢氧化钠溶液至过量  C、向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量
C、向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量 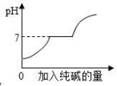 D、向等质量的镁粉和铝粉中分别加入过量等质量分数的稀硫酸
D、向等质量的镁粉和铝粉中分别加入过量等质量分数的稀硫酸  9. 为比较Zn、Cu、Ag的金属活动性顺序,以及它们置换酸中的氢的能力,某科学兴趣小组设计了下图所示的四个实验,其中不必进行的实验是( )A、
9. 为比较Zn、Cu、Ag的金属活动性顺序,以及它们置换酸中的氢的能力,某科学兴趣小组设计了下图所示的四个实验,其中不必进行的实验是( )A、 B、
B、 C、
C、 D、
D、 10. 下列图像分别对应四个变化过程的一种趋势,其中正确的图像个数有 ( )
10. 下列图像分别对应四个变化过程的一种趋势,其中正确的图像个数有 ( )
①图甲,在一定量Fe(NO3)2、AgNO3和Cu(NO3)2的混合溶液中加入铁粉
②图乙,向等质量的锌粉和铁粉中,分别加入足量且相同质量分数的稀盐酸
③图丙,在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
④图丁,向质量和质量分数都相等的稀盐酸中分别加入足量的锌粉和铁粉
A、1 个 B、2 个 C、3 个 D、4 个11. 下列四个图像能正确反映对应变化关系的是( )A、
电解水 B、
等质量且形状、 大小均相同的锌、 铁两种金属分别逐滴滴入过量的同种稀硫酸 C、
硝酸银、 硝酸铜的混合溶液加入锌粉至过量 D、
氯化镁溶液与氢氧化钙溶液混合, 充分反应12. 下列物质中能满足如图中的变化要求的甲物质是( ) A、Cu B、Al2O3 C、Mg D、CuO13. 如图所示的四个图像,分别对应四种过程,其中正确的是( )A、加热氯酸钾和二氧化锰的混合物
A、Cu B、Al2O3 C、Mg D、CuO13. 如图所示的四个图像,分别对应四种过程,其中正确的是( )A、加热氯酸钾和二氧化锰的混合物 B、恒温下,往一定量的KNO3不饱和溶液中加入KNO3固体
B、恒温下,往一定量的KNO3不饱和溶液中加入KNO3固体  C、在等质量的镁、铁里分别加入足量的稀硫酸
C、在等质量的镁、铁里分别加入足量的稀硫酸  D、浓硫酸长久露置在空气中
D、浓硫酸长久露置在空气中  14. 把足量的铁粉分别投入到各组物质的溶液中,充分反应后过滤,滤液中只有一种溶质的是( )A、Na2SO4和CuSO4 B、H2SO4 和 CuSO4 C、HCl 和H2SO4 D、CuCl2 和 Cu(NO3)215. 在试管中加入一段纯净的镁条,再加入硝酸银溶液,观察到如下现象:①镁条表面迅速覆盖了一层疏松的固体物质;②镁条表面有明显的气泡。经检验,疏松的固体物质中有单质银,气泡中有氢气。对于上述实验现象,分析错误的是( )A、镁投入硝酸银溶液中,只发生:2AgNO3+Mg=Mg(NO3)2+2Ag B、镁跟硝酸银溶液反应会生成氢气 C、镁能从硝酸银溶液中置换出银 D、根据该实验可判断镁比银化学活动性强16. 某学生将锌粒放入CuSO4溶液中,发现锌粒表面有红色物质析出,同时还有少量无色无味气泡产生。对于产生气泡的“异常现象”,下列分析有科学道理的是( )A、产生的气体可能是CO2 B、CuSO4溶液呈碱性 C、溶液中可能含有氢离子 D、若用银粉替代锌粒也会有同样的现象17. 将金属M的粉末放入盛有硝酸铜溶液的烧杯中,充分反应后,溶液呈无色,继续向烧杯中加入一定量的硝酸银溶液,充分反应后过滤,得到滤渣和蓝色滤液。根据实验分析,下列说法错误的是( )A、金属活动性强弱顺序:M>Cu>Ag B、滤渣中可能有金属M C、滤液中至少含有两种溶质 D、滤渣中一定有Ag18. 某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤渣中加入少量的稀盐酸,无气泡产生,则下列有关说法中正确的是( )A、滤出的固体中一定含有银,滤液可能含有硝酸亚铁 B、滤出的固体中一定含有银和铜,一定不含有铁 C、滤液中一定含有硝酸亚铁,一定没有硝酸银 D、滤出的固体中一定含有银,滤液中一定含有硝酸亚铁19. 下列四个坐标示意图分别表示四个实验过程中的某些变化情况,其中错误的是( )
14. 把足量的铁粉分别投入到各组物质的溶液中,充分反应后过滤,滤液中只有一种溶质的是( )A、Na2SO4和CuSO4 B、H2SO4 和 CuSO4 C、HCl 和H2SO4 D、CuCl2 和 Cu(NO3)215. 在试管中加入一段纯净的镁条,再加入硝酸银溶液,观察到如下现象:①镁条表面迅速覆盖了一层疏松的固体物质;②镁条表面有明显的气泡。经检验,疏松的固体物质中有单质银,气泡中有氢气。对于上述实验现象,分析错误的是( )A、镁投入硝酸银溶液中,只发生:2AgNO3+Mg=Mg(NO3)2+2Ag B、镁跟硝酸银溶液反应会生成氢气 C、镁能从硝酸银溶液中置换出银 D、根据该实验可判断镁比银化学活动性强16. 某学生将锌粒放入CuSO4溶液中,发现锌粒表面有红色物质析出,同时还有少量无色无味气泡产生。对于产生气泡的“异常现象”,下列分析有科学道理的是( )A、产生的气体可能是CO2 B、CuSO4溶液呈碱性 C、溶液中可能含有氢离子 D、若用银粉替代锌粒也会有同样的现象17. 将金属M的粉末放入盛有硝酸铜溶液的烧杯中,充分反应后,溶液呈无色,继续向烧杯中加入一定量的硝酸银溶液,充分反应后过滤,得到滤渣和蓝色滤液。根据实验分析,下列说法错误的是( )A、金属活动性强弱顺序:M>Cu>Ag B、滤渣中可能有金属M C、滤液中至少含有两种溶质 D、滤渣中一定有Ag18. 某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤渣中加入少量的稀盐酸,无气泡产生,则下列有关说法中正确的是( )A、滤出的固体中一定含有银,滤液可能含有硝酸亚铁 B、滤出的固体中一定含有银和铜,一定不含有铁 C、滤液中一定含有硝酸亚铁,一定没有硝酸银 D、滤出的固体中一定含有银,滤液中一定含有硝酸亚铁19. 下列四个坐标示意图分别表示四个实验过程中的某些变化情况,其中错误的是( )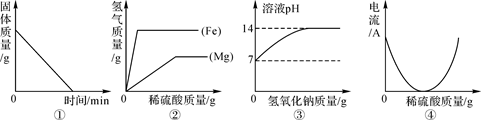 A、图①:加热一定量碳铵(NH4HCO3)的实验,试管中固体的质量变化 B、图②:等质量的镁条和铁丝分别与足量的稀硫酸反应,产生气体的质量变化 C、图③:向一定质量的水中加入氢氧化钠时,形成的溶液pH的变化 D、图④:向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸,测得溶液导电性的变化20. 如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1 , 再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2 , 下列说法正确的是( )
A、图①:加热一定量碳铵(NH4HCO3)的实验,试管中固体的质量变化 B、图②:等质量的镁条和铁丝分别与足量的稀硫酸反应,产生气体的质量变化 C、图③:向一定质量的水中加入氢氧化钠时,形成的溶液pH的变化 D、图④:向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸,测得溶液导电性的变化20. 如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤的读数为F1 , 再向烧杯中加入适量的铜粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的读数为F2 , 下列说法正确的是( )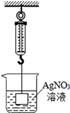 A、F2<F1 B、F2>F1 C、F2=F1 D、无法判断
A、F2<F1 B、F2>F1 C、F2=F1 D、无法判断二、填空题
-
21. 为探究镁、铁、铜三种金属的活动性顺序,小涛设计了如图所示的实验方案。请完成下列问题:
 (1)、同学们经讨论后认为该方案可以优化,试管的实验是多余的;(2)、去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,则组成滤渣的所有可能是 。22. 金属在生产和生活中应用广泛。(1)、下列属于铁合金的是 (选填字母)。A、铁锈 B、纯铁 C、不锈钢(2)、某化工厂的废液中含有硝酸银、硝酸亚铁和硝酸锌。兴趣小组的同学们取适量的上述废液样品,将一定质量的镁粉加入样品中,充分反应后过滤,得到滤液和滤渣。
(1)、同学们经讨论后认为该方案可以优化,试管的实验是多余的;(2)、去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,则组成滤渣的所有可能是 。22. 金属在生产和生活中应用广泛。(1)、下列属于铁合金的是 (选填字母)。A、铁锈 B、纯铁 C、不锈钢(2)、某化工厂的废液中含有硝酸银、硝酸亚铁和硝酸锌。兴趣小组的同学们取适量的上述废液样品,将一定质量的镁粉加入样品中,充分反应后过滤,得到滤液和滤渣。①若滤液为浅绿色,则滤液中除Fe(NO3)2外,一定含有的溶质还有。
②所得滤液的质量与废液样品的质量相比一定减小,其原因是。
23. 铁在潮湿空气中易生锈,其反应过程如下:
 (1)、步骤②中的反应物除Fe(OH)2外,还有(选填“O2”“H2O”或“O2和H2O”)。(2)、已知步骤③为分解反应,若x 为 2,则此分解反应的化学方程式为。24. 制造芯片的基材主要是高纯硅。下图是制备高纯硅的一种工艺流程:
(1)、步骤②中的反应物除Fe(OH)2外,还有(选填“O2”“H2O”或“O2和H2O”)。(2)、已知步骤③为分解反应,若x 为 2,则此分解反应的化学方程式为。24. 制造芯片的基材主要是高纯硅。下图是制备高纯硅的一种工艺流程:
回答下列问题:
(1)、反应Ⅰ 的 化学方程式是。(2)、过滤所得粗硅应充分洗涤,以除去表面可能吸附的HCl和(填化学式)。(3)、反应Ⅱ的基本类型属于;反应Ⅱ要在无氧气环境中进行,原因是(答出一种即可)。(4)、上述生产流程中,可以循环利用的物质是(填化学式)。25. 利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图:
已知:2Cu+2H2SO4+O2=2CuSO4+2H2O
(1)、过程Ⅱ中加入过量锌粉的目的是。(2)、过程Ⅲ中有气体产生,所选用的物质C是(填一种酸)。26. 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni) ,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。(1)、铸造以上硬币用到的材料都是(填“合成材料”或“金属材料”)。(2)、选择铸造硬币的材料不需要考虑的因素是 (填序号)。A、金属的导电性 B、金属的耐腐蚀性 C、金属的硬度 D、金属价格与硬币面值的吻合度(3)、以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:Ni+H2SO4=NiSO4+H2↑ Fe+NiCl2=Ni+FeCl2
四种金属活动性由强到弱的顺序为(用元素符号表示)。
27. 日常生活、工农业生产中的许多问题都与化学知识密切相关。(1)、在家里,常可以选用厨房用品中的(选填“黄酒”、“苏打”或“食醋”)来除去铁制品表面的锈迹。(2)、为了保证安全,点燃甲烷气体前要检验气体的。(3)、为适应火车提速,一些铁路线上原有的短轨需要连接为超长轨。工人常用2Al+Fe2O3=Al2O3+2Fe (条件高温)这一反应来焊接钢轨,该反应属于化学基本反应类型中的。28. 某科学小组向一定量Mg(NO3)2、AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,然后过滤,并对滤液和滤渣的成分进行了分析和实验探究。(1)、向滤液中滴加稀盐酸,有白色沉淀产生,则滤渣中的成分是。(2)、向滤渣中滴加稀盐酸,有气泡产生,则滤液中的溶质是。三、实验探究题
-
29. 某科学兴趣小组为研究不同金属跟稀硫酸反应的快慢,将甲、乙、丙、丁四种金属片分别与相同体积、相同溶质质量分数的稀硫酸反应,观察30秒内产生的氢气泡的多少,记录在下表中。(“+”越多表示产生的气泡越多)
金属
甲
乙
丙
丁
氢气泡的多少
++
++++
+++
+
(1)、从实验结果可看出,甲、乙、丙、丁四种金属与稀硫酸反应由快到慢的顺序是。(2)、要获得令人信服的实验结论,除了稀硫酸的体积和溶质质量分数必须相同外,4种金属的也必须相同。30. 下图为某小组探究金属化学性质的两组实验。实验I 实验II (1)、实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是;(2)、写出实验II中C试管内反应的化学方程式;(3)、实验II中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是(填字母序号)。31. 铜锈的主要成分是Cu2(OH)2CO3。某同学为了研究铜在空气中生锈的条件,利用了如图甲所示的实验装置进行实验,经过近一个月的观察,该同学发现B装置中的铜钉生锈了,而A、C装置中的铜钉无明显变化。由此得出结论:“铜生锈的原因是铜与空气中的水和氧气相互作用的结果。”试回答下列问题。
 (1)、该同学所得出的结论完整吗? , 理由是。(2)、你认为影响铜生锈的因素还可能有;为了验证你的判断,应选择图中的(选填“乙”或“丙”)装置进一步实验。(3)、通过上述实验,你认为影响铜生锈的主要因素:。(4)、铜与铁相比,更易生锈,由此可得出结论:。(5)、写出一条防止铜铁等金属制品生锈的具体方法:。32. 为了从硝酸亚铁和硝酸银的混合溶液中,提取并回收银,小浔设计了如下的实验方案:
(1)、该同学所得出的结论完整吗? , 理由是。(2)、你认为影响铜生锈的因素还可能有;为了验证你的判断,应选择图中的(选填“乙”或“丙”)装置进一步实验。(3)、通过上述实验,你认为影响铜生锈的主要因素:。(4)、铜与铁相比,更易生锈,由此可得出结论:。(5)、写出一条防止铜铁等金属制品生锈的具体方法:。32. 为了从硝酸亚铁和硝酸银的混合溶液中,提取并回收银,小浔设计了如下的实验方案:
 (1)、若溶液乙为无色溶液,则固体甲一定含有的物质是 , 可能含有的物质是。(2)、若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是或(填化学式)。33. 金属材料广泛应用于生产生活中。(1)、常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是。(2)、铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为。(3)、向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质:(写化学式)。(4)、铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
(1)、若溶液乙为无色溶液,则固体甲一定含有的物质是 , 可能含有的物质是。(2)、若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是或(填化学式)。33. 金属材料广泛应用于生产生活中。(1)、常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是。(2)、铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为。(3)、向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质:(写化学式)。(4)、铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式:。
②冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是t(结果精确到0.1)。
(5)、含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为g。34. 古往今来,金属材料和制品在我们的社会生活中一直起着非常重要的作用。(1)、考古工作者发现铁质的出土文物往往锈蚀严重,铁生锈的条件是。在实验室常用稀盐酸清除铁锈,化学方程式为。(2)、近年来,我国高铁建设促进了经济、社会的快速发展。制造铁轨的材料是合金钢,主要原因是合金钢具有的优越性能(要求只答一条)。(3)、某同学在实验室进行了两个有关金属性质的实验:实验Ⅰ:硫酸铝溶液和铁粉混合;
实验Ⅱ:硫酸铜溶液与铁粉混合。
在上述两个实验结束后,该同学将实验Ⅰ和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多,原因是(用文字说明)。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。那么,滤液中所含金属离子的情况可能是 (填序号)。
①Al3+②Al3+、Fe2+③Al3+、Fe3+
④Fe2+、Cu2+⑤Al3+、Fe2+、Cu2+
四、解答题
-
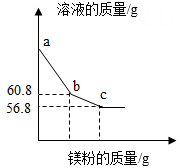
35. 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品50g,向其中逐滴加入一定浓度的稀硫酸.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
 (1)、反应结束,生成氢气的质量为g;(2)、求样品中铜的质量(3)、a点溶液中溶质的成分有(填化学式)36. 某科学兴趣小组同学取 8.5g 铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到 9.2g 固体。为测定所得固体中各成分的含量,同学们将 62.5g 稀盐酸分五次加入到该固体中,得到数据如下表:
(1)、反应结束,生成氢气的质量为g;(2)、求样品中铜的质量(3)、a点溶液中溶质的成分有(填化学式)36. 某科学兴趣小组同学取 8.5g 铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到 9.2g 固体。为测定所得固体中各成分的含量,同学们将 62.5g 稀盐酸分五次加入到该固体中,得到数据如下表:次数
1
2
3
4
5
加入盐酸溶液质量/g
12.5
12.5
12.5
12.5
12.5
剩余固体质量/g
8.5
7.8
a
6.4
6.4
请分析计算:
(1)、表中 a 的值是;(2)、9.2g 固体中铁的质量是;(3)、稀盐酸的溶质质量分数是多少?(4)、与硫酸铜反应的铁的质量是多少?37. 某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成。分四次取样品与稀硫酸反应,其实验数据记录如下表。实验序号
1
2
3
4
取样品质量(g)
100
100
100
100
取稀硫酸质量(g)
40
80
120
160
产生气体质量(g)
0.4
0.8
1.0
1.0
试计算:
(1)、黄铜中锌的质量分数;(2)、所用稀硫酸中溶质的质量分数。(3)、第4次实验充分反应后,所得溶液ZnSO4的溶质质量分数是多少?38. 某科学兴趣小组用足量的稀硫酸对10克铜锌合金样品进行科学探究,有关数据见图。 (1)、图中M的值为克。(2)、AB和BC不在同一直线上的原因是。(3)、求所用稀硫酸的溶质的质量分数。
(1)、图中M的值为克。(2)、AB和BC不在同一直线上的原因是。(3)、求所用稀硫酸的溶质的质量分数。