浙教版科学八年级上册第一章溶液专题
试卷更新日期:2021-09-29 类型:同步测试
一、单选题
-
1. 如图所示为配制50g溶质质量分数为 10%的氯化钠溶液的操作过程,下列有关操作与目的分析均正确的是( )

选项
操作
目的
A
用剩的食盐放回原试剂瓶
避免浪费
B
天平调平后在左、右托盘各垫一张相同的纸
保证称取的食盐质量更准确
C
用50mL量筒替代天平量取所需的水
更加简便
D
溶解时用玻璃棒搅拌
增加食盐的溶解能力
A、A B、B C、C D、D2. 下列物质依次为悬浊液、乳浊液、溶液的一组是( )A、牛奶、汽水、石灰水 B、矿泉水、自来水、汽油和水的混合物 C、江水、肥皂水、碘酒 D、酒精、泥浆、汽水3. 长期放置在敞口容器内的饱和食盐水,在保持温度不变的情况下,发现容器底部有少量晶体出现,这说明( )A、溶液变为不饱和溶液 B、溶剂质量减少,溶液仍为饱和溶液 C、溶液中溶剂、溶质的质量均未改变 D、溶液比原来要浓一些4. 将相同质量的甲、乙两种不同溶质的溶液同时蒸发掉10g水,并冷却到T℃时,分别析出2g甲和3g乙物质(均不带结晶水),则下列说法正确的是( )A、T℃时,甲、乙两种物质的溶解度可能相同 B、T℃时,甲物质的溶解度一定大于乙 C、T℃时,甲物质的溶解度一定小于乙 D、将析出晶体后的甲、乙两种饱和溶液混合后(甲、乙不反应),溶液仍饱和5. 20℃时,将等质量的a、b两种不含结晶水的固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图甲;然后升温到50℃时,现象如图乙;a、b两种物质的溶解度曲线如图丙。由这一过程可知 ( )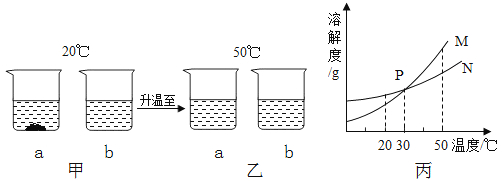 A、图甲中a溶液溶质质量分数比b溶液大 B、图乙中a、b溶液一定都是饱和溶液 C、图丙中表示a的溶解度曲线是M D、30℃时a、b溶液溶质质量分数不相等6.
A、图甲中a溶液溶质质量分数比b溶液大 B、图乙中a、b溶液一定都是饱和溶液 C、图丙中表示a的溶解度曲线是M D、30℃时a、b溶液溶质质量分数不相等6.右图所示是a、b、c(不含结晶水)三种固体物质的溶解度曲线,下列说法正确的是( )
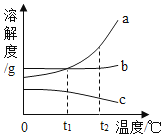 A、三种物质溶解度的大小顺序是a>b>c B、t2℃时,将a的溶液降温至t1℃,可能有晶体析出 C、t1℃时,a、b两种物质的溶液中溶质质量分数一定相等 D、采用升高温度的方法,可将饱和的c物质溶液变成不饱和7. 甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )
A、三种物质溶解度的大小顺序是a>b>c B、t2℃时,将a的溶液降温至t1℃,可能有晶体析出 C、t1℃时,a、b两种物质的溶液中溶质质量分数一定相等 D、采用升高温度的方法,可将饱和的c物质溶液变成不饱和7. 甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( ) A、甲的溶解度大于乙的溶解度 B、①②两溶液均变为不饱和溶液 C、①溶液质量增加,②溶液质量减少 D、①溶液中溶质的质量分数大于②溶液8. 配制硝酸钾溶液时得到下表数据。根据表中数据分析,不正确的是( )
A、甲的溶解度大于乙的溶解度 B、①②两溶液均变为不饱和溶液 C、①溶液质量增加,②溶液质量减少 D、①溶液中溶质的质量分数大于②溶液8. 配制硝酸钾溶液时得到下表数据。根据表中数据分析,不正确的是( )序号
温度/℃
水的质量/克
所加硝酸钾的质量/克
所得溶液的质量/克
①
28
10
4
14
②
28
10
6
14
③
60
10
8
18
A、28℃时10克水中最多能溶解硝酸钾4克 B、60℃时等质量水中能溶解的硝酸钾比28℃时多 C、①②所得溶液溶质的质量分数相等 D、③所得溶液一定是硝酸钾的饱和溶液9. 下列有关溶液的说法中,正确的是( )A、溶液不一定都是混合物 B、将100g KCl饱和溶液蒸干得到25g固体,则KCl在该温度下的溶解度为25g C、常温下将饱和Ca(OH)2溶液加热到50℃,会使溶液由饱和变为不饱和 D、从25%的H2SO4溶液中取出10mL,则取出溶液的质量分数仍为25%10. 下列食盐溶液,溶质质量分数不等于5%的是( )A、5g食盐溶解在95g水中得到的溶液 B、100g水中溶解5g食盐得到的溶液 C、每100g食盐溶液中含有5g食盐 D、将食盐和水按1∶19的质量比配成的溶液11.如图是A、B两种物质的溶解度曲线,下列叙述错误的是( )
 A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法12. 在粗盐提纯的实验中,下列操作正确的是( )A、粗盐称量
A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法12. 在粗盐提纯的实验中,下列操作正确的是( )A、粗盐称量 B、粗盐溶解
B、粗盐溶解  C、浊液过滤
C、浊液过滤  D、蒸发结晶
D、蒸发结晶  13.
13.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
 A、t1℃时,向100克水中加入20克甲,充分溶解后所得溶液是饱和溶液 B、甲饱和溶液从t2℃降温至t1℃,溶液的质量不变 C、乙饱和溶液温度降低,有晶体析出,是化学变化 D、当甲中含有少量乙时,可用降低甲饱和溶液温度的方法提纯甲14. mg硝酸钾的不饱和溶液,恒温蒸发水分,直到有少量晶体析出.在此变化过程中,溶液溶质质量分数(a%)与时间(t)的变化关系可用图( )A、
A、t1℃时,向100克水中加入20克甲,充分溶解后所得溶液是饱和溶液 B、甲饱和溶液从t2℃降温至t1℃,溶液的质量不变 C、乙饱和溶液温度降低,有晶体析出,是化学变化 D、当甲中含有少量乙时,可用降低甲饱和溶液温度的方法提纯甲14. mg硝酸钾的不饱和溶液,恒温蒸发水分,直到有少量晶体析出.在此变化过程中,溶液溶质质量分数(a%)与时间(t)的变化关系可用图( )A、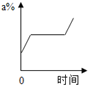 B、
B、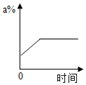 C、
C、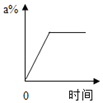 D、
D、 15. 关于溶液下列说法正确的是( )A、饱和溶液一定是浓溶液 B、t℃时,100克某物质的饱和溶液中含该溶质18克,则该物质在t℃时溶解度是18克 C、饱和溶液指一定温度下一定量溶剂中不能继续溶解某种溶质的溶液 D、不饱和溶液加溶剂可以变为饱和溶液16. 如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
15. 关于溶液下列说法正确的是( )A、饱和溶液一定是浓溶液 B、t℃时,100克某物质的饱和溶液中含该溶质18克,则该物质在t℃时溶解度是18克 C、饱和溶液指一定温度下一定量溶剂中不能继续溶解某种溶质的溶液 D、不饱和溶液加溶剂可以变为饱和溶液16. 如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( ) A、蒸发前原溶液是饱和溶液 B、n的数值是12 C、蒸发10克水后的溶液是饱和溶液 D、甲物质的溶解度随温度的升高而增大17. 如图,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析, 正确的是( )
A、蒸发前原溶液是饱和溶液 B、n的数值是12 C、蒸发10克水后的溶液是饱和溶液 D、甲物质的溶解度随温度的升高而增大17. 如图,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析, 正确的是( )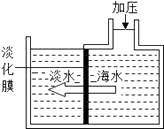 A、溶质质量增加 B、溶剂质量减少 C、溶液质量不变 D、溶质质量分数减少18. 如图所示,将水分别滴入装有氢氧化钠固体和硝酸铵固体的两支试管中,下列说法错误的是( )
A、溶质质量增加 B、溶剂质量减少 C、溶液质量不变 D、溶质质量分数减少18. 如图所示,将水分别滴入装有氢氧化钠固体和硝酸铵固体的两支试管中,下列说法错误的是( )
 A、硝酸铵固体溶解时会吸收热量 B、氢氧化钠固体溶解时会放出热量 C、两只烧杯的溶液中都有固体析出 D、两只烧杯中溶液的溶质质量分数都保持不变19. 在20℃时,将一种可溶性盐与一种不溶性物质组成的固体混合物30g,投入到40g水中,充分搅拌、溶解、过滤,剩余固体15.6g,此15.6g固体加入40g水中充分搅拌、溶解、过滤,还剩余5g固体,则该可溶性盐在20℃时的溶解度为( )A、36.0g B、31.25g C、26.5g D、无法计算20. 今有60g溶质的质量分数为10%的NaNO3溶液,欲将其溶质的质量分数增大一倍,应采用的方法是( )A、把溶剂蒸发掉一半 B、加入6gNaNO3晶体 C、把溶剂蒸发掉30g D、加入20%的NaNO3溶液30g
A、硝酸铵固体溶解时会吸收热量 B、氢氧化钠固体溶解时会放出热量 C、两只烧杯的溶液中都有固体析出 D、两只烧杯中溶液的溶质质量分数都保持不变19. 在20℃时,将一种可溶性盐与一种不溶性物质组成的固体混合物30g,投入到40g水中,充分搅拌、溶解、过滤,剩余固体15.6g,此15.6g固体加入40g水中充分搅拌、溶解、过滤,还剩余5g固体,则该可溶性盐在20℃时的溶解度为( )A、36.0g B、31.25g C、26.5g D、无法计算20. 今有60g溶质的质量分数为10%的NaNO3溶液,欲将其溶质的质量分数增大一倍,应采用的方法是( )A、把溶剂蒸发掉一半 B、加入6gNaNO3晶体 C、把溶剂蒸发掉30g D、加入20%的NaNO3溶液30g二、填空题
-
21. 下列为氯化钠和氯化铵在不同温度时的溶解度。回答下列问题:
温度/℃
0
10
20
30
40
50
氯化铵溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
氯化钠溶解度/g
35.7
35.8
36.0
36.3
36.6
37.0
(1)、由表中数据可知,溶解度随温度变化较大的物质是。(2)、20 ℃时100 g水最多只能溶解氯化钠g,氯化钠与氯化铵溶解度相等的温度在℃之间。(3)、向烧杯中加入100 g水和50.0 g氯化铵配成50 ℃的溶液,再冷却到20 ℃,烧杯中析出固体为g。22. 如图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
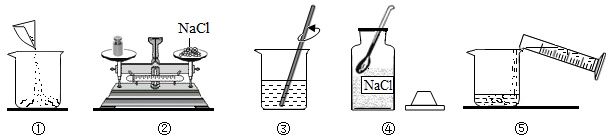 (1)、如图中的玻璃仪器分别是广口瓶、量筒、和玻璃棒,其中玻璃棒在此操作中的作用是。(2)、指出图②中的一处错误操作。(3)、通过计算确定需要水的质量是g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。量水时,量筒必须平放,视线要跟量筒中水的凹液面的处保持水平。(4)、用上述图示的序号表示配制溶液的操作顺序 。23. 甲、乙两图分别表示氯化钠和硝酸钾在水中的溶解度曲线.
(1)、如图中的玻璃仪器分别是广口瓶、量筒、和玻璃棒,其中玻璃棒在此操作中的作用是。(2)、指出图②中的一处错误操作。(3)、通过计算确定需要水的质量是g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。量水时,量筒必须平放,视线要跟量筒中水的凹液面的处保持水平。(4)、用上述图示的序号表示配制溶液的操作顺序 。23. 甲、乙两图分别表示氯化钠和硝酸钾在水中的溶解度曲线.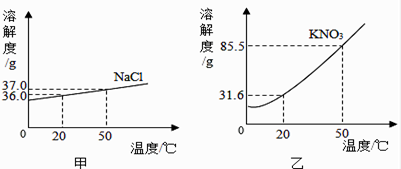 (1)、比较甲、乙两图可知:影响固体物质溶解度曲线陡斜程度的因素是 , 两种物质中 的溶解度受温度影响更小.
(1)、比较甲、乙两图可知:影响固体物质溶解度曲线陡斜程度的因素是 , 两种物质中 的溶解度受温度影响更小.
(2)、20℃时硝酸钾的溶解度为 .
(3)、若将20℃时硝酸钾的饱和溶液升温到50℃,此时溶液为 (填“饱和溶液”或“不饱和溶液”),溶液中硝酸钾的质量分数(填“变大”、“变小”或“不变”).
24. 如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答: (1)、写出标号仪器的名称:A , D .(2)、图中还缺少的一种仪器是 , 其作用是 , 装置安装存在一处的错误是 , 这样安装会出现的后果是 .(3)、在过滤时,若经过两次过滤后滤液仍然浑浊,其原因可能是 , (要求写出两条).25. 在一定温度下,向 100g 水中依次加入一定质量的 KCl 固体,充分溶解。加入 KCl 的质量与得到相应溶液质量的关系如图所示。
(1)、写出标号仪器的名称:A , D .(2)、图中还缺少的一种仪器是 , 其作用是 , 装置安装存在一处的错误是 , 这样安装会出现的后果是 .(3)、在过滤时,若经过两次过滤后滤液仍然浑浊,其原因可能是 , (要求写出两条).25. 在一定温度下,向 100g 水中依次加入一定质量的 KCl 固体,充分溶解。加入 KCl 的质量与得到相应溶液质量的关系如图所示。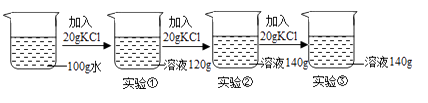 (1)、实验③所得溶液的质量分数是。3 次实验所得溶液质量分数由小到大的关系 是。(2)、实验②的溶液是否为饱和溶液?(填“是”“不是”或者“无法判断”)。26.
(1)、实验③所得溶液的质量分数是。3 次实验所得溶液质量分数由小到大的关系 是。(2)、实验②的溶液是否为饱和溶液?(填“是”“不是”或者“无法判断”)。26.在实验室可用如图装置制取蒸馏水.回答下列问题:
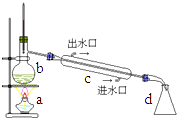 (1)、写出装置图中仪器的名称:
(1)、写出装置图中仪器的名称:B;c;d
(2)、仪器C的作用是;冷水由端流入,由端流出;(3)、水在中由液态变气态,在中由气态变为液态.三、实验探究题
-
27. 烧杯中盛有一定质量、温度为80 ℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
溶液的温度/℃
75
65
50
35
20
析出固体M的质量/g
0
0
2.0
4.5
8.4
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)、65℃时,该溶液是否为饱和溶液?(填“是” “否”或“无法判断”)。(2)、将40℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的有(填序号)。①升温 ②降温 ③加溶质M ④加水 ⑤加另一种固体N ⑥恒温蒸发水 ⑦与40℃时M的饱和溶液混合(3)、20℃时,用固体粉末M和水配制100g溶质质量分数为5% 的M溶液,必须用到的仪器有:托盘天平(带砝码盒)、烧杯、药匙、量筒(100mL)、。28. 某同学配制60g溶质质量分数为5%的NaCl溶液,准备了如图1所示实验用品.回答下列问题: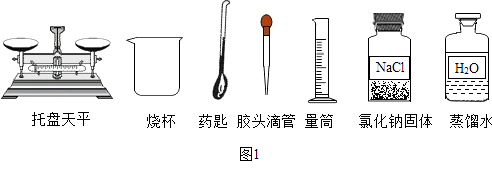 (1)、该同学按下列实验步骤进行:①计算,②称量,③量取,④ . (填步骤名称)(2)、配制过程还缺少的一种玻璃仪器是 . (填名称)(3)、计算所需NaCl质量为3g,称量时NaCl应放在托盘天平的(填“左盘”或“右盘”)上.(4)、量取蒸馏水操作如下:
(1)、该同学按下列实验步骤进行:①计算,②称量,③量取,④ . (填步骤名称)(2)、配制过程还缺少的一种玻璃仪器是 . (填名称)(3)、计算所需NaCl质量为3g,称量时NaCl应放在托盘天平的(填“左盘”或“右盘”)上.(4)、量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用(填仪器名称)滴加蒸馏水至刻度线.如图2所示,该同学观察方式正确的是(填序号).
 (5)、若用C观察方式量取水的体积,所配制溶液的溶质质量分数会(填“偏大”“偏小”或“无影响”).29. 分析处理图表中的信息是学习化学的一种重要方法.(1)、如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
(5)、若用C观察方式量取水的体积,所配制溶液的溶质质量分数会(填“偏大”“偏小”或“无影响”).29. 分析处理图表中的信息是学习化学的一种重要方法.(1)、如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)温度(℃)
0
10
20
30
40
50
60
70
80
90
100
KNO3
13.3
20.9
32
45.8
64
85.5
110
138
169
202
246
NaCl
35.7
35.8
36
36.3
36.6
37
37.3
37.8
38.4
39
39.8
Ⅰ.20℃时,NaCl的溶解度是 g.
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为(只列计算式,不需要计算结果).
Ⅲ.KNO3中含少量氯化钠时,提纯硝酸钾的一般方法是 .
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是 .
(2)、如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.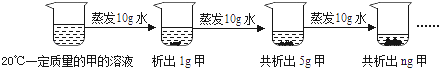
Ⅰ.蒸发前原溶液是(填“饱和”或“不饱和”)溶液.n的数值是 .
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是(填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
30.甲、乙、丙三种物质的溶解度曲线如右图所示.据图回答:
 (1)、50℃时,乙物质的溶解度是g;
(1)、50℃时,乙物质的溶解度是g;
(2)、30℃时,三种物质的溶解度由大到小的顺序为;
(3)、要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是;
(4)、50℃时,将等质量的甲.乙.丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是 , 所得溶液中溶质质量分数最小的是.31. 用下列实验操作可完成两个实验。提纯含少量泥沙的粗盐,一般经过以下操作流程: (1)、操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。
(1)、操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。 (2)、操作⑤中除用到三脚架、玻璃棒、坩埚、坩埚钳外,还需要用到等仪器。(3)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 (可多选)。A、食盐没有全部溶解即过滤 B、蒸发时食盐飞溅剧烈 C、蒸发后,所得精盐很潮湿 D、器皿上沾有的精盐没全部转移到称量纸上(4)、实验二:用提纯得到的精盐配制13%的氯化钠溶液40克。
(2)、操作⑤中除用到三脚架、玻璃棒、坩埚、坩埚钳外,还需要用到等仪器。(3)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 (可多选)。A、食盐没有全部溶解即过滤 B、蒸发时食盐飞溅剧烈 C、蒸发后,所得精盐很潮湿 D、器皿上沾有的精盐没全部转移到称量纸上(4)、实验二:用提纯得到的精盐配制13%的氯化钠溶液40克。步骤如下:
①计算:可计算出需精盐克。
②称量和量取:称量氯化钠时,若发现天平指针向左偏(如图),则应怎么处理?
③溶解:
(5)、经检测,所配制的氯化钠溶液的溶质质量分数偏小,其原因不可能是 。A、制得的食盐还不纯 B、读数时仰视 C、称量用的砝码生锈 D、砝码与药品位置放反32. 我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.(1)、我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取实验的方法主要为“盐田法”,生产流程如下:

在蒸发池中促进水分蒸发,主要是利用了下列各项中的 .(填选项序号)
①潮汐能 ②生物能 ③电能 ④太阳能 ⑤化学能
(2)、金属镁广泛应用于生活、生产和国防工业,从卤水中提取镁的过程如图所示:

在上述转化过程中,①处发生的反应属于 反应.(填“中和”“复分解”“氧化”“化合”“分解”之一)
(3)、海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素.KCl和KNO3的溶解度曲线如图所示,试回答下列问题:

①t1℃时,KCl饱和溶液的溶质质量分数KNO3饱和溶液的溶质质量分数;(填“大于”“小于”“等于”之一)
②已知20℃时,KNO3的溶解度为31.6g;80℃时,KNO3的溶解度为169g,在20℃时,向盛有200g水的烧杯中加入80gKNO3 , 充分溶解,得到该温度时KNO3的(填“饱和”“不饱和”之一)溶液,若使烧杯内物质缓慢升温至80℃,在该温度下,最后所得溶液中溶质与溶剂的质量之比为 .(填最简整数比)
四、解答题
-
33. 根据氯化钠和硝酸钾的溶解度表,回答下列问题:
温度(℃) 10 20 30 40 50 60 70 氯化钠溶解度(克) 35.8 36.0 36.3 36.4 37.0 37.3 37.8 硝酸钾溶解度(克) 20.9 31.6 45.8 63.9 85.5 110 138 (1)、写出硝酸钾和氯化钠具相同溶解度时的温度范围(限表中相邻两个温度之间);(2)、50℃,向100克水中加入90克硝酸钾,充分搅拌后所得溶液质量为;(3)、计算20℃时氯化钠饱和溶液的溶质质量分数。(写出计算过程)34. 实验室常用溶质质量分数为98%的浓硫酸(密度1.84g/cm3)来配制需要用的较稀的硫酸溶液.现要配制500mL溶质质量分数为20%(密度为1.14g/cm3)的硫酸溶液,需要多少毫升浓硫酸?需要加水多少毫升?35. 如图为某医用生理盐水注射液的标签中的部分内容。计算: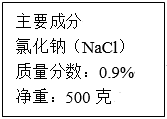 (1)、该瓶盐水能给病人体内提供氯化钠的质量是多少?(2)、若用溶质质量分数为18%的氯化钠溶液配制该瓶生理盐水,需要18%的氯化钠溶液多少克?需蒸馏水多少毫升?(ρ水=1×103Kg/m3)36. 如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,阅读后计算:
(1)、该瓶盐水能给病人体内提供氯化钠的质量是多少?(2)、若用溶质质量分数为18%的氯化钠溶液配制该瓶生理盐水,需要18%的氯化钠溶液多少克?需蒸馏水多少毫升?(ρ水=1×103Kg/m3)36. 如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,阅读后计算: (1)、欲配制600克溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少毫升。(2)、100毫升该硫酸与200毫升水混合后所得溶液的质量分数为多少?(3)、将一个体积为100cm3 , 密度为2.7×103kg/m3的小石块投入刚买回的硫酸试剂中,石块所受的浮力为多少牛?37. 下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)
(1)、欲配制600克溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少毫升。(2)、100毫升该硫酸与200毫升水混合后所得溶液的质量分数为多少?(3)、将一个体积为100cm3 , 密度为2.7×103kg/m3的小石块投入刚买回的硫酸试剂中,石块所受的浮力为多少牛?37. 下表为硫酸密度与硫酸溶液中的溶质的质量分数对照表(20℃)密度(g/mL)
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数(%)
1
10
20
30
40
50
60
70
80
90
98

有一物块A,其体积为250cm3 , 密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。
(1)、求物块A静止时受到的浮力大小?(2)、求这种硫酸溶液的溶质质量分数是多少?(3)、要使物块A全部浸入溶液中,至少需要往容器中加水多少千克?(容器足够大,加水后溶液不溢出。)