广东省汕头市潮阳区2020-2021学年高一上学期化学期末考试试卷
试卷更新日期:2021-09-27 类型:期末考试
一、单选题
-
1. 在芷兰实验学校2020级高一新生太阳山拉练活动中,很多同学在即将登顶时,看到阳光透过树叶的缝隙而呈现出的美丽光束。形成这种现象的本质原因是( )A、发生了丁达尔效应 B、雾是一种胶体 C、空气中的小水滴颗粒做布朗运动 D、空气中的小水滴颗粒直径大小约为1-100nm2. 化学与生活密切相关,下列物质与其用途不符合是( )A、Ti-Fe合金——储氢材料 B、纯碱——治疗胃酸过多 C、次氯酸钠——消毒剂 D、三氧化二铁——制作红色颜料3. 设NA表示阿伏加德罗常数,下列叙述正确的是( )A、25℃、101.3kPa时,11.2L H2中含有的原子数为NA B、2L 1mol/L Na2SO4溶液中离子总数为6NA C、0℃、101.3kPa时,22.4L H2O中含有的分子数为NA D、加热含4molHCl的浓盐酸与足量MnO2的混合物,使其充分反应,转移的电子数为2NA4. 过氧化钠常用作呼吸面具或潜水艇的供氧剂,下列说法错误的是( )A、Na2O2的电子式:
 B、Na+的结构示意图:
B、Na+的结构示意图:  C、7.8gNa2O2中含有阴阳离子总数为0.4NA
D、Na2O2与足量CO2反应生成标况下2.24LO2时,转移的电子数为0.2NA
5. “分类”是一种思想方法,在化学发展中起到了重要的作用,下列判断合理的是( )
C、7.8gNa2O2中含有阴阳离子总数为0.4NA
D、Na2O2与足量CO2反应生成标况下2.24LO2时,转移的电子数为0.2NA
5. “分类”是一种思想方法,在化学发展中起到了重要的作用,下列判断合理的是( )①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出氢离子的化合物都是酸
③根据水溶液是否导电,将物质分为电解质与非电解质
④根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据氧化物中是否含有金属元素,可将分为碱性氧化物和酸性氧化物
A、只有① B、只有①②⑤ C、只有④⑤ D、只有①②④6. 下列叙述中,正确的是( )A、相同条件下,1体积的CH4与1体积的CO、CO2的混合气体所含碳原子数相同 B、等质量的O2和O3中所含分子数相同 C、H2SO4的摩尔质量是98 D、将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L7. 下列实验操作、现象与结论相符的一组是( )序号
实验操作、现象
结论
A
向一种未知溶液中滴加AgNO3溶液,有白色沉淀
未知溶液中一定含有
B
向一种未知溶液中滴加盐酸,产生能使澄清石灰水变浑浊的无色无味的气体
未知溶液中一定含有
C
未知溶液进行焰色试验,焰色为黄色
该未知溶液中含钠元素
D
向紫色石蕊溶液中滴加氯水,溶液先变红后褪色
Cl2具有酸性和漂白性
A、A B、B C、C D、D8. 下列关于古代化学的应用和记载的说明不合理的是( )A、《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机”,指的是黑火药爆炸,其主要反应的方程式为:S+2KNO3+3C=K2S+N2↑+3CO2↑ B、《梦溪笔谈》“熬胆矾铁釜,久之亦化为铜”是发生了氧化还原反应 C、“自古书契多编以竹简,其用缣帛者(丝织品)谓之为纸”,文中“纸”的主要成分是纤维素 D、“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为Fe3O49. 下列反应的离子方程式书写正确的是( )A、向氯化亚铁溶液中加入氯水:Fe2++HClO+H+=Fe3++Cl-+H2O B、浓烧碱溶液中加入铝片:Al+2OH-= +H2↑ C、用浓NaOH溶液溶解Al2O3:OH-+Al2O3= +H2O D、往氯化铁溶液中滴加氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓10. U是重要的核工业原料,在自然界的丰度很低。 U的浓缩一直为国际社会所关注。下列有关 U的说法中正确的是( )A、 U原子核中含有92个中子 B、 U原子核外有143个电子 C、 U与 U互为同位素 D、 U与 U互为同素异形体11. 纳米级 Fe3O4可用于以太阳能为热源分解水制H2 , 过程如下图所示。下列说法正确的是:( ) A、过程Ⅰ的反应为:6FeO+O2 2Fe3O4 B、过程Ⅱ中H2为还原剂 C、整个过程的总反应为:2H2O 2H2↑+O2↑ D、FeO 是过程Ⅰ的氧化产物12. 下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )A、氢氧化钠与盐酸;氢氧化钠与碳酸 B、Al2O3与硫酸反应;Al2O3与盐酸 C、Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 D、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液13. 在强酸性溶液中,下列各组离子能大量共存的是( )A、 、 、 、K+ B、Na+、Ba2+、Ca2+、 C、Mg2+、 、K+、Cl- D、K+、Ba2+、Na+、14. 下列说法中,正确的是( )A、液态HCl、固态NaCl均不导电,所以HCl、NaCl均是非电解质 B、蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质 C、NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 D、铜、石墨均导电,所以它们是电解质15. 《Nature》杂志评选出的2019年世界十大科技进展之一是我国科研人员发现用于“点击化学”的一种新化合物(如图所示),W、X、Y、Z为短周期主族元素且原子序数依次增大,X的最外层电子数是次外层电子数的3倍,X、Z同主族,Y元素在周期表中非金属性最强,其原子的最外层电子数与W原子的核外电子总数相等。下列说法正确的是( )
A、过程Ⅰ的反应为:6FeO+O2 2Fe3O4 B、过程Ⅱ中H2为还原剂 C、整个过程的总反应为:2H2O 2H2↑+O2↑ D、FeO 是过程Ⅰ的氧化产物12. 下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )A、氢氧化钠与盐酸;氢氧化钠与碳酸 B、Al2O3与硫酸反应;Al2O3与盐酸 C、Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 D、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液13. 在强酸性溶液中,下列各组离子能大量共存的是( )A、 、 、 、K+ B、Na+、Ba2+、Ca2+、 C、Mg2+、 、K+、Cl- D、K+、Ba2+、Na+、14. 下列说法中,正确的是( )A、液态HCl、固态NaCl均不导电,所以HCl、NaCl均是非电解质 B、蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质 C、NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 D、铜、石墨均导电,所以它们是电解质15. 《Nature》杂志评选出的2019年世界十大科技进展之一是我国科研人员发现用于“点击化学”的一种新化合物(如图所示),W、X、Y、Z为短周期主族元素且原子序数依次增大,X的最外层电子数是次外层电子数的3倍,X、Z同主族,Y元素在周期表中非金属性最强,其原子的最外层电子数与W原子的核外电子总数相等。下列说法正确的是( ) A、原子半径:r(Z)>r(X)>r(Y) B、四种元素中,最高价含氧酸酸性最强的为Y C、最简单氢化物的沸点W>X D、最简单氢化物的稳定性:W>X>Y16. 配制500mL0.100 mol·L-1的NaCl溶液,部分实验操作示意图如下:
A、原子半径:r(Z)>r(X)>r(Y) B、四种元素中,最高价含氧酸酸性最强的为Y C、最简单氢化物的沸点W>X D、最简单氢化物的稳定性:W>X>Y16. 配制500mL0.100 mol·L-1的NaCl溶液,部分实验操作示意图如下:
下列说法正确的是( )
A、实验中需用的仪器有:分析天平、 250mL容量瓶、烧杯、玻璃棒、胶头滴管等 B、上述实验操作步骤的符合题意顺序为①②④③ C、容量瓶需要用自来水、蒸馏水洗涤,必须干燥后才可用 D、定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低二、综合题
-
17. Na2CO3可用于纺织、制肥皂、造纸、制玻璃等,NaHCO3可用于制药、焙制糕点等,两者都是白色固体;某实验小组通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。(1)、称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴加2滴酚酞试液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论。
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象:I.溶液温度升高;II.(填字母序号)。
a.滴入酚酞后呈浅红色 b.滴入酚酞后呈红色
(2)、“套管实验”的实验装置如图所示,请分析实验原理,并回答下列问题: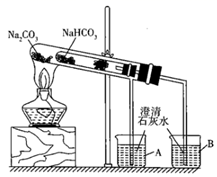
①整个实验过程中,能观察到烧杯B中的现象是;
②实验结束时的操作是。
③写出实验过程中试管中发生反应的化学方程式:。
④该实验可证明NaHCO3的热稳定性(填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?(填“能”或“不能”)。
⑤能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是。

A.将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.两支试管中均盛有3mL6mol/L稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C.分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
⑥下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是。
A.取a g混合物充分加热,减重b g
B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体
18. 某工厂的工业废水中含有大量的FeSO4、较多的CuSO4和少量Na2SO4 , 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。 (1)、操作a的名称为 , 所需要的玻璃仪器为。(2)、加入的试剂④为。(3)、鉴别溶液D中的金属阳离子时,应加入的试剂依次是 , 现象依次是;请写出鉴别过程中属于氧化还原反应的离子方程式:。(4)、若取2mL溶液D加入试管中,然后滴加氢氧化钠溶液,产生的现象是;此现象涉及氧化还原反应的化学方程式是。19. 几种主族元素在周期表中的位置如下
(1)、操作a的名称为 , 所需要的玻璃仪器为。(2)、加入的试剂④为。(3)、鉴别溶液D中的金属阳离子时,应加入的试剂依次是 , 现象依次是;请写出鉴别过程中属于氧化还原反应的离子方程式:。(4)、若取2mL溶液D加入试管中,然后滴加氢氧化钠溶液,产生的现象是;此现象涉及氧化还原反应的化学方程式是。19. 几种主族元素在周期表中的位置如下
根据上表回答下列问题:
(1)、⑥元素的氢化物的电子式是。(2)、①③⑦三种元素原子半径由大到小的顺序是(用元素符号表示)。(3)、表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 , 该元素在周期表中的位置是。(4)、①②③三种元素最高价氧化物对应水化物碱性最强的是(填化学式),①与③最高价氧化物对应水化物反应的离子方程式为。(5)、⑦的非金属性强于⑧,从原子结构的角度解释其原因:。下列表述中能证明这一事实的是(填字母)。a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于 ⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
(6)、①和④形成的化合物是(填“离子”或“共价”)化合物。20. 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。(1)、①写出实验室中制取氯气的离子方程式;②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,15.8g KMnO4能和 gHCl发生上述反应、其中有molHCl被氧化、产生的Cl2在标准状况下的体积为L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的物质的量为;
(2)、常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用 :①浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:;(已知酸性:H2CO3 >HClO> )
②某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,写出该反应的化学方程式:;
(3)、世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为Cl- , ClO2的消毒效率是氯气的倍。