广东省深圳市龙华区2020-2021学年高二上学期化学期末考试试卷
试卷更新日期:2021-09-27 类型:期末考试
一、单选题
-
1. 某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中错误的是( )A、夏天,打开啤酒瓶时会在瓶口逸出气体,可以用勒夏特列原理加以解释 B、使用催化剂既不会改变反应的限度也不会改变反应的焓变 C、吸热反应就是反应物的总能量比生成物的总能量低;也可以理解为化学键断裂时吸收的能量比化学形成时放出的能量少 D、电解质溶液的导电能力与溶液中的离子浓度及离子所带电荷多少有关2. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol B、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol C、需要加热才能发生的反应一定是吸热反应 D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热3. 能证明乙酸是弱酸的实验事实是( )A、CH3COOH溶液与Zn反应放出H2 B、0.1 mol/L CH3COONa溶液的pH大于7 C、CH3COOH溶液与NaCO3反应生成CO2 D、0.1 mol/L CH3COOH溶液可使紫色石蕊变红4. 已知室温时0.1mol/L某一元酸HA在水中有0.1%发生电离,叙述错误的是( )A、该溶液的pH=4 B、升高温度,溶液的Kw增大 C、此酸的电离平衡常数约为1×10-7 D、该溶液里不存在HA分子5. 下列说法正确的是( )A、放热或熵减小均有利于反应的正向自发进行 B、ΔH>0,ΔS<0的反应在任何温度下均能正向自发进行 C、2H2O2(aq)=2H2O(l)+O2(g) ΔH=-189.3 kJ· mol−1 , 任何温度下均可正向自发进行 D、向水中加入NH4NO3固体,溶液温度降低,可说明铵盐水解是吸热的6. 下列变化不能用勒夏特列原理释解的是( )A、工业生产硫酸的过程中使用过量的空气以提高二氧化硫的转化率 B、反应 达到平衡后,加压使混合气体颜色变深 C、实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出 D、实验室用饱和食盐水除去氯气中混有的少量氯化氢7. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、c( )=0.1mol∙L-1的溶液中: 、 、 、 B、 =10-12的溶液中: 、 、 、 C、c( )=0.1mol∙L-1的溶液中: 、 、 、 D、加入KSCN显血红色的澄清透明溶液中: 、 、 、8. 下列电离方程式正确的是( )A、NaHCO3溶于水:NaHCO3 Na++ B、NaHSO4溶于水:NaHSO4=Na++H++ C、HF溶于少量水:HF=H++F- D、H2CO3溶液:H2CO3=2H++9. 一种高温熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
 A、如用此种电池电镀铜,待镀铜金属上增重 19.2 g,则应消耗2.24 LCH4 B、电极 A 上 H2参与的电极反应为: C、电池工作时,CO 向电极B移动 D、电极 B上发生的电极反应为:10. 铬酸银(Ag2CrO4)微溶于水,作化学试剂。常用作分析试剂,有机合成催化剂,电镀,卤化物滴定确定终点的指示剂等。在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10−10。下列说法错误的是( )
A、如用此种电池电镀铜,待镀铜金属上增重 19.2 g,则应消耗2.24 LCH4 B、电极 A 上 H2参与的电极反应为: C、电池工作时,CO 向电极B移动 D、电极 B上发生的电极反应为:10. 铬酸银(Ag2CrO4)微溶于水,作化学试剂。常用作分析试剂,有机合成催化剂,电镀,卤化物滴定确定终点的指示剂等。在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10−10。下列说法错误的是( ) A、t℃时,Y点和Z点时Ag2CrO4的Ksp相等 B、饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C、t℃时,Ag2CrO4的Ksp为1×10−8 D、t℃时,将0.01 mol·L−1 AgNO3溶液滴入20 mL 0.01 mol·L−1 KCl和0.01 mol·L−1 K2CrO4的混合溶液中,Cl-先沉淀11. 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )
A、t℃时,Y点和Z点时Ag2CrO4的Ksp相等 B、饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C、t℃时,Ag2CrO4的Ksp为1×10−8 D、t℃时,将0.01 mol·L−1 AgNO3溶液滴入20 mL 0.01 mol·L−1 KCl和0.01 mol·L−1 K2CrO4的混合溶液中,Cl-先沉淀11. 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( ) A、两溶液稀释前的浓度相同 B、a、b、c三点溶液的pH由大到小顺序为b>a>c C、b点的Kw值比a点的Kw值大 D、a点水电离的n(H+)小于c点水电离的n(H+)12. 下列说法正确的是( )A、常温下,向稀醋酸溶液中缓慢通入少量 ,溶液中 值增大 B、工业合成氨 ,为提高 产率,选择较低温度下进行 C、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 D、电解精炼铜时,阳极泥中含有Zn、Ag、Au等金属单质13. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g),下列判断正确的是( )A、增加Ni的用量,可加快该反应速率 B、该反应达到平衡时,4v正[Ni(CO)4]=v逆(CO) C、减小压强,正反应速率减小,逆反应速率增大 D、选择合适的催化剂可提高CO的平衡转化率14. 钙钛矿太阳能电池被称为是第三代太阳能电池,下图是钙钛矿太阳能电池的示意图。若用该电池作电源电解酸性硫酸铬溶液获取铬单质和硫酸,下列说法正确的是( )
A、两溶液稀释前的浓度相同 B、a、b、c三点溶液的pH由大到小顺序为b>a>c C、b点的Kw值比a点的Kw值大 D、a点水电离的n(H+)小于c点水电离的n(H+)12. 下列说法正确的是( )A、常温下,向稀醋酸溶液中缓慢通入少量 ,溶液中 值增大 B、工业合成氨 ,为提高 产率,选择较低温度下进行 C、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 D、电解精炼铜时,阳极泥中含有Zn、Ag、Au等金属单质13. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g),下列判断正确的是( )A、增加Ni的用量,可加快该反应速率 B、该反应达到平衡时,4v正[Ni(CO)4]=v逆(CO) C、减小压强,正反应速率减小,逆反应速率增大 D、选择合适的催化剂可提高CO的平衡转化率14. 钙钛矿太阳能电池被称为是第三代太阳能电池,下图是钙钛矿太阳能电池的示意图。若用该电池作电源电解酸性硫酸铬溶液获取铬单质和硫酸,下列说法正确的是( )
 A、当太阳能电池有6 mol电子转移时,Cr棒上增重的质量为104 g B、D电极发生的电极反应式为2H++2e-=H2↑ C、乙池的 向甲池移动 D、C电极接钙钛矿太阳能电池的B极15. 用来表示可逆反应2A(g)+B(g)⇌2C(g) ΔH<0的正确图像为( )A、
A、当太阳能电池有6 mol电子转移时,Cr棒上增重的质量为104 g B、D电极发生的电极反应式为2H++2e-=H2↑ C、乙池的 向甲池移动 D、C电极接钙钛矿太阳能电池的B极15. 用来表示可逆反应2A(g)+B(g)⇌2C(g) ΔH<0的正确图像为( )A、 B、
B、 C、
C、 D、
D、 16. X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是( )
16. X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是( ) A、该反应的热化学方程式为X(g) +3Y(g) ⇌ 2Z(g) △H= -(E2-E1)kJ B、若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 C、该温度下,反应的平衡常数数值约为533,若升高温度,该反应的平衡常数减小,Y的转化率降低 D、图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线17. 下列实验操作能达到实验目的的是( )
A、该反应的热化学方程式为X(g) +3Y(g) ⇌ 2Z(g) △H= -(E2-E1)kJ B、若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 C、该温度下,反应的平衡常数数值约为533,若升高温度,该反应的平衡常数减小,Y的转化率降低 D、图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线17. 下列实验操作能达到实验目的的是( )目的
操作
A
测定NaClO溶液的pH
取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比
B
验证Ksp(AgCl)>Ksp( AgI)
取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀
C
证明Na2CO3溶液中存在水解平衡
向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化
D
检验Fe(NO3)2晶体是否已
氧化变质
将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红
A、A B、B C、C D、D18. 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定体积均是20mL、浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )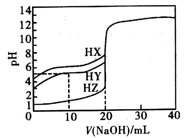 A、酸性强弱顺序是HX>HY>HZ B、由图象可知,HY为弱酸,其电离常数数量级为10-6 C、pH=2的HZ溶液加水稀释10倍,pH为3 D、加入20mLNaOH溶液时,只有HY溶液达到滴定终点19. 用 NA 表示阿伏加德罗常数的值,下列说法错误的是( )A、常温常压下,9.5g 羟基(- OH)中所含中子数为 5NA B、室温下,1L pH=13 的 NaOH 溶液中,由水电离的 OH−数目为 10−13NA C、2mol FeBr2 与足量氯气反应时,转移的电子数为 6NA D、甲烷燃料电池的正极消耗 22.4L O2 , 电路中通过的电子数为 4NA20. 下列说法正确的是( )A、常温下, 的下列溶液① ;② ;③ ;④ .;⑤ 中, 由大到小的顺序是:⑤>②>①>④>③ B、常温下, 溶液和 溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: C、常温下,将 、 两溶液混合后,溶液呈中性,溶液中 大于 D、pH相等的下列溶液:a. 、b. 、c. NaOH,其物质的量浓度由小到大顺序为:c<a<b
A、酸性强弱顺序是HX>HY>HZ B、由图象可知,HY为弱酸,其电离常数数量级为10-6 C、pH=2的HZ溶液加水稀释10倍,pH为3 D、加入20mLNaOH溶液时,只有HY溶液达到滴定终点19. 用 NA 表示阿伏加德罗常数的值,下列说法错误的是( )A、常温常压下,9.5g 羟基(- OH)中所含中子数为 5NA B、室温下,1L pH=13 的 NaOH 溶液中,由水电离的 OH−数目为 10−13NA C、2mol FeBr2 与足量氯气反应时,转移的电子数为 6NA D、甲烷燃料电池的正极消耗 22.4L O2 , 电路中通过的电子数为 4NA20. 下列说法正确的是( )A、常温下, 的下列溶液① ;② ;③ ;④ .;⑤ 中, 由大到小的顺序是:⑤>②>①>④>③ B、常温下, 溶液和 溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: C、常温下,将 、 两溶液混合后,溶液呈中性,溶液中 大于 D、pH相等的下列溶液:a. 、b. 、c. NaOH,其物质的量浓度由小到大顺序为:c<a<b二、综合题
-
21.(1)、Ⅰ.在101kPa时, 在 中完全燃烧生成2mol液态水,放出 的热量,请写出 燃烧热的热化学方程式为。(2)、已知在常温常压下:①
②
③
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)、Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。在固定体积的密闭容器中,进行如下化学反应:N2+3H2 2NH3 , △H<0,该反应的化学平衡常数表达式是K=。已知平衡常数K与温度T的关系如表:T/℃
400
300
平衡常数K
K1
K2
①试判断K1K2(填写“>”“=”或“<”)。
②下列各项能说明该反应已达到平衡状态的是(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是(填字母)。
a.采用较高温度(400~500℃) b.将生成的氨液化并及时从体系中分离出来
c.用铁触媒加快化学反应速率 d.采用较高压强(20~50MPa)
22. 如图,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是 (1)、甲池是装置,乙、丙池是装置(2)、石墨电极的名称是通甲醇气体的电极名称是(3)、甲池通入氧气的电极反应式为(4)、乙池中银电极的电极反应式为乙池中反应的化学方程式为23. 如图所示:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。
(1)、甲池是装置,乙、丙池是装置(2)、石墨电极的名称是通甲醇气体的电极名称是(3)、甲池通入氧气的电极反应式为(4)、乙池中银电极的电极反应式为乙池中反应的化学方程式为23. 如图所示:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。 (1)、往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为。(2)、从图中数据计算可得Zn(OH)2的溶度积Ksp=。(3)、某废液中含Zn2+ , 为提取Zn2+可以控制溶液pH的范围是。(4)、泡沫灭火器内装有NaHCO3饱和溶液;灭火器内另有一容器中装有Al2(SO4) 3溶液,该溶液呈酸性的原因是:(用离子方程式表示)。当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH)3 , 阻止火势蔓延。其相关化学反应的离子方程式为:。24.(1)、Ⅰ.葡萄酒中SO2最大使用量为0.25g·L-1 , 取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4 , 然后用0.0900mol·L-1NaOH标准溶液进行滴定。
(1)、往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为。(2)、从图中数据计算可得Zn(OH)2的溶度积Ksp=。(3)、某废液中含Zn2+ , 为提取Zn2+可以控制溶液pH的范围是。(4)、泡沫灭火器内装有NaHCO3饱和溶液;灭火器内另有一容器中装有Al2(SO4) 3溶液,该溶液呈酸性的原因是:(用离子方程式表示)。当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH)3 , 阻止火势蔓延。其相关化学反应的离子方程式为:。24.(1)、Ⅰ.葡萄酒中SO2最大使用量为0.25g·L-1 , 取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4 , 然后用0.0900mol·L-1NaOH标准溶液进行滴定。①滴定前排气泡时,应选择下图中的(填序号)。

②若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)。
A.=10mL B.=40mL C.<10mL D.>40mL
(2)、Ⅱ.研究电解质在水溶液中的平衡能了解它的存在形式。常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)=mol•L-1
②X点时,溶液中各离子浓度由大到小的顺序是。
③K点时,溶液中c(H+)+c(M+)–c(OH-)=mol•L-1