广东省广州市荔湾区2020-2021学年高二上学期化学期末考试试卷
试卷更新日期:2021-09-27 类型:期末考试
一、单选题
-
1. 下列物质中,属于弱电解质的是( )A、CaCO3 B、HCl C、H2O D、Ba(OH)22. 下列说法错误的是( )A、可逆反应的ΔH 表示完全反应时的热量变化,与反应是否可逆无关 B、放热反应不需加热就能反应,吸热反应不加热就不能反应 C、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH 相同 D、已知:①C(s,石墨)+O2(g) =CO2(g) ΔH1=-393.5kJ∙mol−1 ②C(s,金刚石)+O2(g) =CO2(g) ΔH2=-395.0kJ∙mol−1 , 则石墨比金刚石稳定3. 下列方程式书写正确的是( )A、 的水解方程式: B、 的水解方程式: C、NaHSO4在水溶液中的电离方程式: D、H2S的电离方程式:4. 在下列溶液中,pH 由大到小的排列顺序是( )
① 0.1 mol·L-1 KOH 溶液 ② 0.1 mol·L-1 CH3COOH 溶液 ③ 0.1 mol·L-1 HNO3溶液 ④ 0.1 mol·L-1 H2SO4溶液
A、①②③④ B、②①④③ C、④③②① D、③④①②5. 下列过程或现象与盐类水解无关的是( )A、明矾用于净水 B、饱和食盐水使甲基橙显黄色 C、实验室利用氯化铁溶液制备氢氧化铁胶体 D、铵态化肥不能与草木灰混合使用6. 下列事实能用勒夏特列原理解释的是( )A、在FeSO4溶液中加入铁粉以防氧化 B、加入催化剂能使 H2O2的分解速率加快 C、H2、I2、HI 平衡时的混合气体加压后颜色变深 D、用排饱和食盐水收集 Cl27. 某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g) Z(g)+W(s) ΔH>0, 下列叙述正确的是( )A、加入少量 W,逆反应速率增大 B、升高温度,正反应和逆反应速率都增大 C、在容器中加入氦气,压强增大,反应速率增大 D、将容器的体积压缩,可增大活化分子的百分数,有效碰撞次数增大8. 醋酸溶液中存在电离平衡:CH3COOH H++CH3COO- , 下列叙述错误的是( )A、升高温度,醋酸的电离常数 Ka增大 B、0.10 mol·L-1的 CH3COOH 溶液加水稀释,溶液中导电粒子的数目增大 C、CH3COOH 溶液中加少量的 CH3COONa 固体,平衡逆向移动 D、25℃时,欲使醋酸溶液的 pH、电离常数 Ka和电离程度都减小,可加入少量冰醋酸9. 恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 (g)+ O2(g) 2SO3(g),下列不能用来判断该反应达到平衡状态的是( )A、容器中压强不再变化 B、SO2的体积分数不再变化 C、容器中混合物的密度不再变化 D、容器中各物质的浓度不再变化10. 下列有关电化学在生产、生活中的应用分析正确的是( )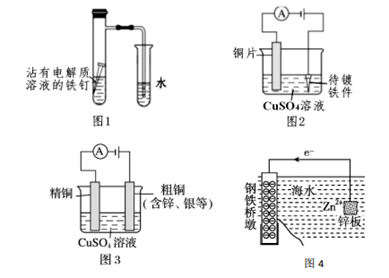 A、图 1:导气管口有气泡冒出 B、图 2:铁件上能发生的反应是: C、图 3:溶液中 c(Cu2+)增大 D、图 4:采用了牺牲阳极的阴极保护法保护桥墩11. 纯的叠氮酸(HN3)是一种弱酸,常温下用 0.2 mol·L-1HN3 溶液滴入 25mL0.1 mol·L-1NaOH 溶液中,滴加过程中的pH 值的变化曲线(溶液混合时的体积变化忽略不计) 如图。下列说法正确的是( )
A、图 1:导气管口有气泡冒出 B、图 2:铁件上能发生的反应是: C、图 3:溶液中 c(Cu2+)增大 D、图 4:采用了牺牲阳极的阴极保护法保护桥墩11. 纯的叠氮酸(HN3)是一种弱酸,常温下用 0.2 mol·L-1HN3 溶液滴入 25mL0.1 mol·L-1NaOH 溶液中,滴加过程中的pH 值的变化曲线(溶液混合时的体积变化忽略不计) 如图。下列说法正确的是( ) A、该滴定过程用甲基橙作指示剂 B、点 B 对应溶液中: C、点 D 对应溶液中: D、沿曲线 A→B→C 的过程中,由水电离产生的 c(OH-)逐渐减少12. 下列有关滴定的说法正确的是( )A、用 25mL 滴定管进行中和滴定时,用去标准液的体积为 21.7mL B、用未知浓度的 HCl 溶液滴定已知浓度的 NaOH 溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高 C、用标准的 KOH 溶液滴定未知浓度的 HCl 溶液,配制标准溶液的固体 KOH 中混有NaOH 杂质,则结果偏高 D、将 KMnO4标准溶液加入碱式滴定管中,滴定未知浓度的 H2C2O4溶液13. 下列实验方案不能达到相应目的的是( )
A、该滴定过程用甲基橙作指示剂 B、点 B 对应溶液中: C、点 D 对应溶液中: D、沿曲线 A→B→C 的过程中,由水电离产生的 c(OH-)逐渐减少12. 下列有关滴定的说法正确的是( )A、用 25mL 滴定管进行中和滴定时,用去标准液的体积为 21.7mL B、用未知浓度的 HCl 溶液滴定已知浓度的 NaOH 溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高 C、用标准的 KOH 溶液滴定未知浓度的 HCl 溶液,配制标准溶液的固体 KOH 中混有NaOH 杂质,则结果偏高 D、将 KMnO4标准溶液加入碱式滴定管中,滴定未知浓度的 H2C2O4溶液13. 下列实验方案不能达到相应目的的是( )A
B
C
D
目的
比较碳酸根与碳酸氢根水解程度
研究浓度对化学平衡的影响
比较不同催化剂对化学反应速率的影响
比较碳酸、醋酸和硼酸的酸性强弱
实验方案



 A、A B、B C、C D、D14. 某课题组利用碳氨液[(NH4)2CO3、NH3·H2O)]从辉铜矿石(主要成分 Cu2S)中直接浸取铜并制取铜盐,其过程如下图所示。
A、A B、B C、C D、D14. 某课题组利用碳氨液[(NH4)2CO3、NH3·H2O)]从辉铜矿石(主要成分 Cu2S)中直接浸取铜并制取铜盐,其过程如下图所示。
其反应机理如下:
① (快反应)
② (慢反应)
③ (快反应)
下列说法正确的是( )
A、通入热的空气可以加快铜的浸出率,温度越高,浸出率越大 B、浸出装置发生的反应中,热空气的作用是氧化剂, 是还原产物 C、在浸出装置中加入适量的(NH4)2S2O8 , 使平衡①、②正向移动,铜的浸出率增大 D、提高铜的浸出率的关键因素是提高反应②的速率,原因是反应②的活化能比反应①、③的小15. 下列说法正确的是( )A、pH=1 的醋酸加水稀释到原体积的 1000 倍,稀释后 pH=4 B、某温度下,某溶液中水电离出的 c(H+)=1×10-7 mol·L-1 , 则该温度下溶液呈中性 C、室温下pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同 D、其它条件相同时,同浓度同体积的CH3COOH 溶液和盐酸分别与镁反应,CH3COOH溶液反应放出气体的速率较慢16. 有关①100 mL 0.1 mol·L-1 的 Na2CO3 溶液两种溶液、②100 mL 0.1 mol·L-1 的 NaHCO3 溶液的叙述错误的是( )A、①溶液中: B、②溶液中: C、溶液中水电离出的 H+个数:①>② D、溶液中阴离子的物质的量浓度之和:①>②二、综合题
-
17. 氮的单质及其化合物在工业生产中用途广泛,请回答下列问题:(1)、捕碳技术(主要指捕获 CO2)在降低温室气体排放中具有重要的作用。目前 NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与 CO2可发生如下可逆反应:
反应Ⅰ: 2 NH3(l)+ H2O(l) +CO2(g) =(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+ H2O(l) +CO2(g) =NH4HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq) + H2O(l) +CO2(g) =2NH4HCO3(aq) △H3
△H3与△H1、△H2之间的关系是△H3= 。
(2)、肼(N2H4)可用于卫星发射的燃料,8gN2H4(l)在 O2(g)中完全燃烧,生成 N2(g)和 H2O(g), 放出 134kJ 热量,则肼的燃烧热△H=。 (已知 H2O(g) =H2O(l) △H= −44 kJ∙mol−1 )(3)、在微生物作用的条件下, 经过两步反应被氧化成 。两步反应的能量变化示意图如下:
①第一步反应是 (填“放热”或“吸热”)反应,判断依据是 。
②1mol (aq)全部氧化成 (aq)的热化学方程式是。
(4)、叠氮化钠(NaN3)是汽车安全气囊中的主要成分,实验室用滴定法测定叠氮化钠样品中NaN3的质量分数,测定过程的反应方程式为:;
。
滴定操作过程如下:
Ⅰ.将 2.500 g 试样配成 500 mL 溶液。
Ⅱ.取 50.00 mL 溶液置于锥形瓶中,加入 50.00 mL 0.1010 mol∙L−1 (NH4)2Ce(NO3)6溶液。
Ⅲ.充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定过量的 Ce4+ , 消耗溶液体积为 29.00 mL。
①配制叠氮化钠溶液时,除需用到烧杯、量筒、胶头滴管外,还用到的玻璃仪器有。
②计算试样中 NaN3的质量分数为。
18. 根据化学平衡理论,请回答下列几个问题:(1)、某温度(t℃)时,水中c(H+)和c(OH-)的关系如图所示,a点水的离子积Kw=。该温度下,pH=12的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液显(填“酸”或“碱”或“中”)性。 (2)、向含有酚酞的0.1mol·L−1的氨水中加入少量NH4Cl固体,观察到的现象是 , 请结合离子方程式分析产生该现象的主要原因是:。(3)、将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液呈中性,则溶液中c(Na+)c(CH3COO-)(填“>”“<”或“=”),则混合前c(NaOH)c(CH3COOH)(填“>”“<”或“=”)。(4)、为配制SbCl3溶液,取少量SbCl3固体溶于2~3mL水中,观察到有白色沉淀生成,为避免出现该现象,配制SbCl3溶液的正确方法是。(5)、25℃时,已知Ksp[Cu(OH)2]=2×10−20 , 要使c(Cu2+)=0.2mol·L−1溶液中的Cu2+沉淀较完全[残留在溶液中的c(Cu2+)降低到2×10−4mol·L−1],则应加入NaOH溶液调节pH为。19. 电解法转化 CO2可实现 CO2资源化利用。电解 CO2制甲酸(HCOOH)的原理示意图如下:(已知 HCOOH 中 C 的化合价为+2 价)
(2)、向含有酚酞的0.1mol·L−1的氨水中加入少量NH4Cl固体,观察到的现象是 , 请结合离子方程式分析产生该现象的主要原因是:。(3)、将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液呈中性,则溶液中c(Na+)c(CH3COO-)(填“>”“<”或“=”),则混合前c(NaOH)c(CH3COOH)(填“>”“<”或“=”)。(4)、为配制SbCl3溶液,取少量SbCl3固体溶于2~3mL水中,观察到有白色沉淀生成,为避免出现该现象,配制SbCl3溶液的正确方法是。(5)、25℃时,已知Ksp[Cu(OH)2]=2×10−20 , 要使c(Cu2+)=0.2mol·L−1溶液中的Cu2+沉淀较完全[残留在溶液中的c(Cu2+)降低到2×10−4mol·L−1],则应加入NaOH溶液调节pH为。19. 电解法转化 CO2可实现 CO2资源化利用。电解 CO2制甲酸(HCOOH)的原理示意图如下:(已知 HCOOH 中 C 的化合价为+2 价)
请回答:
(1)、a 端连电源的极。(2)、甲池中放出的气体是 , 发生的电极反应式为:。(3)、电解过程中,产生 HCOO-的电极反应式为:。电路中转移 0.1mol电子,理论上需消耗CO2L(标准状况)。(4)、电解过程中 K+的移动方向是 , 其原因是。20. 利用催化技术将汽车尾气中的NO和CO进行处理,其反应方程式为: 2NO+2CO 2CO2+N2 , 为研究如何增大该反应的速率和提高转化率的问题,某研究小组在其他条件相同的条件下,使用同种、等量的催化剂进行了以下三组实验探究:实验数据记录如下表;实验中 CO 的浓度与时间的变化关系如下图(已知催化剂的比表面积是指单位质量的物质所具有的总面积)。编号
t/℃
c(NO)/mol·L-1
c(CO)/mol·L-1
催化剂的比表面积/(m2·g-1)
Ⅰ
360
6.5×10-3
a
80.0
Ⅱ
280
b
4.00×10-3
120
Ⅲ
280
6.5×10-3
4.00×10-3
80.0
 (1)、若要得到温度与该反应的速率关系,则需对比组实验(填实验编号),表格数据中a= , 实验结论是。(2)、进行实验Ⅱ和实验Ⅲ的目的是 , 得到的实验结论是 。(3)、实验Ⅲ中,该反应前2s的平均反应速率为 v(CO)= , 反应达平衡时NO的平衡转化率为(保留三位有效数字),其平衡常数 K=(只列出浓度计算表达式)。(4)、对比图中的 A 点与 B 点,你可以获取的结论是。(5)、从本实验探究数据综合分析,以上三组实验中,选择实验(填编号)的反应条件更利于汽车尾气的处理。
(1)、若要得到温度与该反应的速率关系,则需对比组实验(填实验编号),表格数据中a= , 实验结论是。(2)、进行实验Ⅱ和实验Ⅲ的目的是 , 得到的实验结论是 。(3)、实验Ⅲ中,该反应前2s的平均反应速率为 v(CO)= , 反应达平衡时NO的平衡转化率为(保留三位有效数字),其平衡常数 K=(只列出浓度计算表达式)。(4)、对比图中的 A 点与 B 点,你可以获取的结论是。(5)、从本实验探究数据综合分析,以上三组实验中,选择实验(填编号)的反应条件更利于汽车尾气的处理。