广东省潮州市2020-2021学年高二上学期化学期末考试试卷
试卷更新日期:2021-09-27 类型:期末考试
一、单选题
-
1. 化学与生活、生产联系密切,下列说法错误的是( )A、加热纯碱溶液可增强其去污能力 B、明矾可用作净水剂 C、NH4Cl溶液可作焊接金属的除锈剂 D、草木灰可与铵态氮肥混合施用2. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1 mol SO2与1 mol O2混合,充分反应后剩余SO2分子数为0.5NA B、1 L 1 mol•L−1Na2CO3溶液中 数目小于NA C、1 L pH=1的硫酸溶液中所含H+数目为0.2NA D、粗铜精炼过程中,阳极质量每减少6.4 g,转移电子数目为0.2NA3. 对于反应2SO2(g)+O2(g)⇌2SO3(g) △H<0,下列措施中,既能使正反应速率增大又能使平衡正向移动的是( )A、通入大量的O2 B、增大容积的体积 C、移去部分SO3 D、升高体系的温度4. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、使酚酞变红色的无色溶液中: 、Cl−、Cu2+ B、pH=2的溶液中:Ca2+、Cl−、 C、含有大量Fe3+的溶液中: 、S2−、SCN− D、水电离的c(H+)=1×10−13mol·L−1的溶液中:Na+ , Al3+、5. 下列事实中,不能用勒夏特列原理解释的是( )A、氯水中有下列平衡Cl2+H2O⇌HCl+HClO,当加入AgNO3后溶液颜色变浅 B、工业上合成氨中,选择高压有利于提高产率 C、硫酸工业中进行的反应 2SO2+O2⇌2SO3 , 往往使用催化剂 D、2NO2(g)⇌N2O4(g) Δ H <0,升高温度可使体系颜色加深6. 下列关于反应能量的说法正确的是( )A、已知2C(s)+O2(g)=2CO(g) ΔH,ΔH表示碳的燃烧热 B、若C(s,石墨)=C(s,金刚石) ΔH>0,则石墨比金刚石稳定 C、已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g) = 2CO(g) ΔH2 , 则ΔH1>ΔH2 D、H+(aq)+OH−(aq)=H2O(l) ΔH=-57.3 kJ·mol−1 , 含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量7. 下列说法能证明HA是弱电解质的是( )A、常温下测得NaA溶液呈碱性 B、常温下测得0.01mo·L−1 HA溶液的pH=2 C、HA的导电性比醋酸弱 D、往HA溶液中滴加甲基橙,溶液显红色8. 已知水的电离方程式是H2O H++ OH-。下列叙述正确的是( )A、升高温度,KW增大,pH不变 B、向水中加入少量硫酸,c(H+)增大,KW不变 C、向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 D、向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低9. 联合国宣布2019年为“国际化学元素周期表年”。元素W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为 18。下列说法正确的是( )
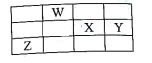 A、简单氢化物沸点:Y>W B、原子半径:Z>Y>X C、氧化物的水化物的酸性:W<X D、推测Z是半导体材料,Z与Y可形成化合物ZY410. 常温下,浓度均为 0.1 mol·L-1 的下列溶液中,粒子的物质的量浓度关系正确的是( )A、氨水中,c(NH )=c(OH-)=0.1 mol·L-1 B、NH4Cl 溶液中,c(NH )>c(Cl-) C、Na2SO4 溶液中,c(Na+)>c(SO )>c(OH-)=c(H+) D、Na2SO3 溶液中,c(Na+)=2c(SO )+c(HSO )+c(H2SO3)11. 2019年诺贝尔化学奖是关于锂电池研究的。我国科学家研制出的新型铝锂石墨烯电池具有耐热、抗冻等优良特性,有广泛的应用前景。电池反应原理为AlLi+C6(PF6) Al+C6+Li++PF− 6,下列说法正确的是( )A、放电时外电路中电子向铝锂电极移动 B、放电时负极反应为AlLi-e−=Al+Li+ C、充电时,应将石墨烯电极与电源负极相连 D、充电时,若电路中转移1 mol电子,则阴极质量增加9g12. 25℃时的三种溶液:①pH=2的醋酸;②pH=2的硫酸;③pH=12的氢氧化钠溶液。下列有关说法正确的是( )A、将①溶液用蒸馏水稀释,使体积扩大100倍,所得溶液pH变为4 B、①与②两溶液的物质的量浓度相等 C、①与③两溶液等体积混合,混合液的pH=7 D、V1 L ②溶液和V2L ③溶液混合,若混合后溶液pH=3,则V1∶V2=11∶913. 下列实验操作对应的现象与结论均正确的是( )
A、简单氢化物沸点:Y>W B、原子半径:Z>Y>X C、氧化物的水化物的酸性:W<X D、推测Z是半导体材料,Z与Y可形成化合物ZY410. 常温下,浓度均为 0.1 mol·L-1 的下列溶液中,粒子的物质的量浓度关系正确的是( )A、氨水中,c(NH )=c(OH-)=0.1 mol·L-1 B、NH4Cl 溶液中,c(NH )>c(Cl-) C、Na2SO4 溶液中,c(Na+)>c(SO )>c(OH-)=c(H+) D、Na2SO3 溶液中,c(Na+)=2c(SO )+c(HSO )+c(H2SO3)11. 2019年诺贝尔化学奖是关于锂电池研究的。我国科学家研制出的新型铝锂石墨烯电池具有耐热、抗冻等优良特性,有广泛的应用前景。电池反应原理为AlLi+C6(PF6) Al+C6+Li++PF− 6,下列说法正确的是( )A、放电时外电路中电子向铝锂电极移动 B、放电时负极反应为AlLi-e−=Al+Li+ C、充电时,应将石墨烯电极与电源负极相连 D、充电时,若电路中转移1 mol电子,则阴极质量增加9g12. 25℃时的三种溶液:①pH=2的醋酸;②pH=2的硫酸;③pH=12的氢氧化钠溶液。下列有关说法正确的是( )A、将①溶液用蒸馏水稀释,使体积扩大100倍,所得溶液pH变为4 B、①与②两溶液的物质的量浓度相等 C、①与③两溶液等体积混合,混合液的pH=7 D、V1 L ②溶液和V2L ③溶液混合,若混合后溶液pH=3,则V1∶V2=11∶913. 下列实验操作对应的现象与结论均正确的是( )选项
实验操作
现象
结论
A
常温下将Ba(OH)2·8H2O晶体与NH4Cl晶体在小烧杯中混合
烧杯壁变凉
Ba(OH)2·8H2O晶体与NH4Cl的反应是吸热反应
B
将充有NO2的密闭烧瓶放入热水中
烧瓶内气体颜色变深
NO2生成N2O4的反应中,△H>0
C
将0.1mol·L-1的氨水稀释成0.01mol·L-1 , 测量稀释前后溶液 pH
pH减小
稀释后NH3·H2O电离程度减小
D
常温下向物质的量浓度均为0.1mol·L-1的NaCl和NaI混合溶液中逐滴滴入AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
A、A B、B C、C D、D14. 已知293K时下列物质的溶度积 单位已省略 :Ag2SO4
FeS
CuS
Ag2S
1.2×10-5
6.3×10-18
8.5×10-45
6.3×10-50
下列说法正确的是( )
A、相同温度下,Ag2SO4、FeS、CuS饱和溶液中: B、向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式: C、浓度均为0.004mol/L的AgNO3和H2SO4溶液等体积混合后不能产生沉淀 D、向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变15. 反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法错误的是( ) A、三种物质中B最不稳定 B、A→B反应的活化能为E1 C、B→C反应的ΔH=E4-E3 D、加入催化剂不能改变反应的焓变16. 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
A、三种物质中B最不稳定 B、A→B反应的活化能为E1 C、B→C反应的ΔH=E4-E3 D、加入催化剂不能改变反应的焓变16. 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( ) A、两溶液稀释前的浓度相同 B、a、b、c三点溶液的pH由大到小顺序为a>b>c C、a点的Kw值比b点的Kw值大 D、a点水电离的c(H+)大于c点水电离的c(H+)
A、两溶液稀释前的浓度相同 B、a、b、c三点溶液的pH由大到小顺序为a>b>c C、a点的Kw值比b点的Kw值大 D、a点水电离的c(H+)大于c点水电离的c(H+)二、实验题
-
17.(1)、I.氯化铁可用于金属蚀刻,污水处理。
25℃时,FeCl3溶液的pH7(填“>”、“<”或“=”),原因是(用离子方程式表示)。把FeCl3溶液蒸干灼烧得到的主要产物是。
(2)、为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:实验
c(FeCl3)/mol·L−1
V (FeCl3)/ mL
温度/℃
pH
1
0.1
5
25
x
2
0.1
5
35
y
3
0.2
5
25
z
下列说法正确的是_______(填序号)。
A、上述实验能判断出温度对氯化铁水解的影响 B、表格中x > y > z C、上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大(3)、II.滴定实验是化学学科中最重要的定量实验之一、葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O3作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
往实验中加入盐酸的目的是将Na2S2O3转化成SO2;滴定过程中发生的反应是:I2+SO2+2H2O=2HI+H2SO4
加入盐酸时发生反应的离子方程式为。
(4)、滴定时,I2溶液应装在(“酸”或“碱”)式滴定管中,该滴定过程的指示剂是 , 滴定终点的现象为。(5)、实验消耗标准I2溶液50.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。(6)、下列情形会造成测定结果偏高的是_______(填序号)。A、滴定持续时间稍长,溶液中部分HI被空气氧化 B、盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗 C、滴定前平视,滴定后俯视 D、滴定前滴定管尖嘴有气泡滴定后气泡消失18. 日常生活、科学研究、工业生产中有许多问题与原电池或电解池的工作原理有关(1)、依据氧化还原反应:2Ag+(aq) + Cu(s)=Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
①电极X的材料是;电解质溶液Y是(填化学式)。
②银电极发生的电极反应为。
(2)、为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如下实验装置。
丙装置中充入滴有酚酞的氯化钠溶液,X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。
①丙装置中Y极为极(填“正”、“负”、“阴”或“阳”)。
②三种金属的活动性由强到弱的顺序是(填元素符号)。
(3)、中国科学院应用化学研究所在甲醚(CH3OCH3)燃料电池技术方面获得新突破。甲醚燃料电池的工作原理如图所示:
①甲醚由(填b或c)通入。
②该电池负极的电极反应式。
③工作一段时间后,当9.2g的甲醚完全反应时,有mol电子转移。
19. CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。(1)、I.①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1CO(g)+H2O(g)=CO2(g)+H2(g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1 ,
反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)的△H=。
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4 , 发生如下反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=。
(2)、II.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。

250~300℃时,乙酸的生成速率减小的原因是。
②为了提高该反应中CH4的转化率,可以采取的措施是。
(3)、III.已知:某酸HA Ka=4.0×10–7(298K)。25℃时,向100mL 0.1mol·L−1 HA的溶液中逐滴加0.2mol·L−1NaOH溶液,所得溶液的pH随NaOH溶液的体积变化如图所示(溶液体积变化忽略不计) 。
。①25℃时,0.1mol·L−1HA溶液中的c(H+)=mol·L-1。
②在X点时,溶液中各离子浓度由大到小的排列顺序是。
③在K点时,溶液中c(OH-)+c(A-)-c(H+)=mol·L−1。
20. 废弃物的综合利用既有利于资源节约,又有利于环境保护。某研究性学习小组利用含银废液[银主要以Ag(S2O3) 形式存在]为原料制备硝酸银,工艺流程如下:
已知:①常温下Ag2S的Ksp为2.0×10−48
②Na2CO3与少量硼砂是为了降低灼烧温度
请回答下列问题:
(1)、操作I的名称是。(2)、用NaOH溶液将pH调至8,其目的是。(3)、“反应”工序中,常温下加入Na2S溶液生成Ag2S沉淀,当溶液中Ag+完全沉淀[c(Ag+)≤1.0×10−5 mol·L−1]时,溶液中c(S2−)为 mol·L−1。(4)、称取Na2CO3和硼砂并与Ag2S混合,研细后置中灼烧(选填“坩埚”或“蒸发皿”),灼烧反应的化学方程式为。(5)、将制得Ag溶解在稀HNO3溶液中,蒸发,干燥,即可制得AgNO3.写出HNO3与Ag反应的化学反应方程式。(6)、从绿色化学的要求看,上述流程中存在的不足为。