广东省广州市番禺区2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-09-27 类型:期末考试
一、选择题
-
1. 中华文化博大精深,下列成语中一定包含化学变化的是( )A、木已成舟 B、花香四溢 C、冰雪消融 D、钻木取火2. 空气是人类生产活动的重要资源。下列生活生产中用到的气体不是来自空气的是( )A、炼钢过程用到的氧气 B、磁悬浮列车用到的氮气 C、用于生产氮肥的氨气 D、制作电光源的稀有气体3. 人们在工作、生活中,为防止事故发生常采用一些安全措施,下列措施中正确的是( )A、冬天用煤取暖时封闭门窗 B、油锅中的油着火用锅盖盖 C、电线短路引起的火灾用水浇灭 D、厨房内煤气泄漏用明火认真查明泄漏原因4. 如图为某粒子X的结构示意图,下列说法正确的是( )
 A、X2+的核外电子数为10 B、粒子X有2个电子层 C、粒子X属于非金属元素 D、粒子X已达到相对稳定结构5. 实验室制取气体的常用装置如图,下列说法正确的是( )
A、X2+的核外电子数为10 B、粒子X有2个电子层 C、粒子X属于非金属元素 D、粒子X已达到相对稳定结构5. 实验室制取气体的常用装置如图,下列说法正确的是( ) A、装置①可以较好地控制反应速率 B、装置①和④组合可以用来制取氧气 C、装置①和②组合可以用来制取氢气 D、装置③和④都可以用来收集二氧化碳6. 下列关于水的说法正确的是( )A、用肥皂水区分软水和硬水 B、明矾可以使硬水转化为软水 C、蒸馏海水和电解水的过程中水发生的变化都是物理变化 D、蒸馏水、自来水都是纯净物7. 火法炼锌主要发生的化学反应是:2C + ZnCO3 Zn +3X ,下列说法错误的是( )A、X 的化学式是 CO B、反应前后固体的质量不变 C、ZnCO3 中碳元素的化合价为+4 D、该反应中有元素的化合价发生改变8. 硼氢化钠(化学式: NaBH4 ,其中氢元素的化合价为-1)是一种安全车载氢源,常温下就可以与水反应产生氢气。下列有关硼氢化钠的说法中正确的是( )A、硼氢化钠中含2个氢分子 B、在此反应过程中,氢元素有2种不同的化合价 C、硼氢化钠中硼元素的化合价为+3 D、Na,B,H三种元素的质量比为1: 1:49. 有X,Y,Z三种金属片,分别放入稀硫酸中,X,Z表面有气泡产生,Y没有明显现象X放入ZCln溶液,没有明显现象。判断这三种金属的活动性由强到弱的顺序是( )
A、装置①可以较好地控制反应速率 B、装置①和④组合可以用来制取氧气 C、装置①和②组合可以用来制取氢气 D、装置③和④都可以用来收集二氧化碳6. 下列关于水的说法正确的是( )A、用肥皂水区分软水和硬水 B、明矾可以使硬水转化为软水 C、蒸馏海水和电解水的过程中水发生的变化都是物理变化 D、蒸馏水、自来水都是纯净物7. 火法炼锌主要发生的化学反应是:2C + ZnCO3 Zn +3X ,下列说法错误的是( )A、X 的化学式是 CO B、反应前后固体的质量不变 C、ZnCO3 中碳元素的化合价为+4 D、该反应中有元素的化合价发生改变8. 硼氢化钠(化学式: NaBH4 ,其中氢元素的化合价为-1)是一种安全车载氢源,常温下就可以与水反应产生氢气。下列有关硼氢化钠的说法中正确的是( )A、硼氢化钠中含2个氢分子 B、在此反应过程中,氢元素有2种不同的化合价 C、硼氢化钠中硼元素的化合价为+3 D、Na,B,H三种元素的质量比为1: 1:49. 有X,Y,Z三种金属片,分别放入稀硫酸中,X,Z表面有气泡产生,Y没有明显现象X放入ZCln溶液,没有明显现象。判断这三种金属的活动性由强到弱的顺序是( )
A、X>Y>Z B、Z>X>Y C、X>Z>Y D、Y>X>Z10. 下表对初中化学部分知识的归纳中,完全正确的一组是( )A.化学用语的含义
B.实验现象的描述
Al2O3——表示氧化铝
H2——表示一个氢分子
2Fe2+—表示两个铁离子
铁丝在氧气中燃烧——火星四射
氢气在空气中燃烧——产生淡蓝色火焰
木炭在空气中燃烧——生成黑色固体
物质性质的对应用途
D.宏观事实的微观解释
氦气密度小——填充飞艇
石墨有导电性——作润滑剂
氮气化学性质不活泼——作保护气
八月十五桂花香——分子不断运动
气体可压缩储存于钢瓶——分子间有间隔
H2O和H2O2化学性质不同——分子构成不同
A、A B、B C、C D、D11. 构建化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是( )A、元素观:电解氯化钠溶液制取氯气 B、微粒观:保持甲烷(CH4)化学性质的最小微粒是甲烷分子 C、守恒观:2g镁和10g氧气反应,一定生成12g氧化镁 D、转化观:铁和四氧化三铁在一定条件下可以相互转化12. 下列实验中,根据实验现象可得到相应结论的是( )实验操作
现象
结论
A
将AgNO3溶液和Cu(NO3)2溶液分别加入两支装有铁钉的试管中
铁钉表面分别有灰黑色固体和红色固体析出
金属活动性由强到弱:Fe>Cu>Ag
B
用拇指堵住收集了CH4的试管口,靠近火焰,移开拇指点火
发出尖锐爆鸣声
试管中CH4不纯
C
在螺旋状细铁丝下端系一根火柴,点燃火柴至快燃尽时,将铁丝插入盛有氧气的集气瓶中
铁丝剧烈燃烧,火星四射,生成黑色固体
加热时铁丝可在氧气中迅速反应生成铁锈
D
点燃某无色气体,在火焰上方罩一个冷而干燥的小烧杯
产生淡蓝色火焰,烧杯内壁有水珠
该无色气体为氢气
A、A B、B C、C D、D13. 能反映相关实验过程中量的变化的图像是( )A、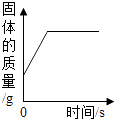 用一氧化碳还原氧化铁
B、
用一氧化碳还原氧化铁
B、 等质量镁、锌分别和足量等质量分数的盐酸反应
C、
等质量镁、锌分别和足量等质量分数的盐酸反应
C、 镁在氧气中燃烧
D、
镁在氧气中燃烧
D、 等质量、等质量分数的双氧水完全分解
14. CO和CO2的混合物气体共36g,通过足量的灼热的氧化铜,充分反应后,得到气体的质量为44g,则原混合气体中碳元素和氧元素的质量比是( )A、1:2 B、1:1 C、2:1 D、3:5
等质量、等质量分数的双氧水完全分解
14. CO和CO2的混合物气体共36g,通过足量的灼热的氧化铜,充分反应后,得到气体的质量为44g,则原混合气体中碳元素和氧元素的质量比是( )A、1:2 B、1:1 C、2:1 D、3:5二、综合题
-
15. 空气和水是维持生命的重要物质,下列实验可用于研究空气和水的组成。
 (1)、利用实验A测定空气中氧气的含量。实验中用到的红磷属于(填“单质”或“化合物")。(2)、为测定空气中氧气的含量,下列操作正确的是(填字母编号)。
(1)、利用实验A测定空气中氧气的含量。实验中用到的红磷属于(填“单质”或“化合物")。(2)、为测定空气中氧气的含量,下列操作正确的是(填字母编号)。A 检查装置的气密性
B 点燃红磷后,先让红磷在瓶内燃烧一会儿, 再塞紧橡胶塞
C 点燃红磷前,先用弹簧夹夹紧胶皮管
D 实验时取用稍过量的红磷
E 红磷熄灭后,立刻打开弹簧夹
F 实验中可以用硫代替红磷进行实验
(3)、实验过程产生的白烟与瓶内的冷水发生化合反应,生成偏磷酸(HPO3)。写出该反应的化学方程式 , 请写出偏磷酸钙的化学式:。(4)、利用实验B研究水的组成:实验过程中观察到试管内液面下降较快的是。(填“a"或"“b”)16. 草酸(乙二酸)存在于自然界的植物中,草酸钠和草酸钾易溶于水,而草酸钙难溶于水。草酸晶体( ) 无色,熔点为101C,易溶于水,受热脱水、升华,170℃以上分解。
回答下列问题:
(1)、甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置c中可观察到的现象是 , 由此可知草酸晶体分解的产物中有。装置B的主要作用是。(2)、乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。[查阅资料]①CO2+2NaOH=Na2CO3+H2O ②已知无水氯化钙具有吸水性。


①乙组同学的实验装置中,依次连接的合理顺序为A、B、、H、D、I。装置H反应管中盛有的物质是。
②能证明草酸品体分解产物中有CO的现象是。
17. 盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。(1)、增大压强, HCl由气态变为液态,从微观的角度分析该变化过程中改变的是 。(2)、金属钴(Co)在国防工业中有重要应用。钴的化学性质与铁相似,与酸反应生成+2价的钻盐,CoCl2 溶液为红色。在盐酸中加入过量的钴粉充分反应。①预测上述反应发生的现象: 。
②如图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号):

 、
、  、
、  。(3)、乙醇易燃烧,如图为乙醇(C2H5OH)在空气中完全燃烧时的微观示意图:
。(3)、乙醇易燃烧,如图为乙醇(C2H5OH)在空气中完全燃烧时的微观示意图:
①乙框中含有 种分子,其中属于氧化物的是 。(填化学式)
②甲、乙两个方框中的微观粒子均不完整,请将图中甲、乙两个方框中微观粒子的种类和数目补充完整 。
18. 2019 年是国际元素周期表年。俄国化学家门捷列夫在公布元素周期表时,就预言了当时还未发现的相对原子质量约为68的元素(镓,元素符号为Ga)的存在,且性质与铝相似,称为“类铝”。已知:氨气是一种带有刺激性气味的气体,其化学式为NH3 , 请回答下列问题:(1)、金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式是。(2)、高纯氧化镓广泛用于生产半导体材料,其一种制备方法如下:步骤1:向含有硫酸的硫酸镓溶液中通入某种气体,冷却,生成Ga(NH4)(SO4)2固体。
步骤11:在一定条件下灼烧Ga(NH4)(SO4)2固体,制得高纯氧化镓。
①Ga(NH4)(SO4)2中含有的带电的原子团(根)是 (填化学符号)。
②步骤I反应的化学方程式是Ga2(SO4)3 +2X+H2SO4 2Ga(NH4)(SO4)2↓,则 x的化学式为。
(3)、氮化镓(GaN)是第三代半导体材料,一般采用GaCl3和NH3在一定条件下制得,同时得到另一种化合物,该反应的化学方程式为。19. 实验室部分装置如下图所示,请回答:(提示:装置C的多孔隔板,可以放置颗粒大小比孔径大的固体) (1)、B装置中从 (填仪器名称)装入液体药品。(2)、检查B装置气密性的方法是:先用夹子夹住与导气管连接的胶皮管,再向a中加入水至形成一段水柱,静置,若观察到 , 说明气密性良好。(3)、实验室利用高锰酸钾制取氧气,则选取的发生装置为 , 若需制备3.2gO2至少需要消耗 gKMnO4( 已知KMnO4的相对分子质量为158)(4)、实验室用大理石与稀盐酸反应生成CO2气体的化学方程式是装置C与装置B相比,其优点有:。(5)、在实验室制取二氧化碳的研究中,进行了如下实验:
(1)、B装置中从 (填仪器名称)装入液体药品。(2)、检查B装置气密性的方法是:先用夹子夹住与导气管连接的胶皮管,再向a中加入水至形成一段水柱,静置,若观察到 , 说明气密性良好。(3)、实验室利用高锰酸钾制取氧气,则选取的发生装置为 , 若需制备3.2gO2至少需要消耗 gKMnO4( 已知KMnO4的相对分子质量为158)(4)、实验室用大理石与稀盐酸反应生成CO2气体的化学方程式是装置C与装置B相比,其优点有:。(5)、在实验室制取二氧化碳的研究中,进行了如下实验:药品
实验编号
甲
乙
丙
丁
大理石
mg,块状
mg,块状
mg,粉末状
mg,粉末状
盐酸(过量)
wg,稀盐酸
wg,浓盐酸
wg,稀盐酸
wg,浓盐酸
I、若要研究盐酸浓度大小对反应速率的影响,可选择实验甲与(填实验编号)对照。
II、除盐酸的浓度外,上述实验研究的另要一个影响反应速率的因素是。
20. 分金属于机金属板中含有Fe、 Cu、 Au、 Ni(银银白色金属等金属,如图是某工厂回收部分金属的流程图。已知2Cu+O2+2H2SO4 2CuSO4+2H2O (1)、操作①的名称是。(2)、固体A的化学式为;滤液②中所含的金属阳离子为。(3)、写出滤液③和铁粉发生反应的一个化学方程式;该反应的基本类型为 反应。(4)、Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是。(5)、另有同学乙将一定质量的锌粒投入含有Cu(NO3)2 和Fe(NO3)3的混合溶液中,充分反应后过滤,若滤液中除了水之外,只含有一种物质,则滤渣中一定含有。(6)、铝合金广泛应用于生活中,兴趣小组同学称取20g铝合金粉末于烧杯中,将400g稀硫酸分四次加入(每次加入100g),充分反应,测得实验数据如下表所示:(假设该铝合金中只有铝能与稀硫酸反应,其他成分不与稀硫酸反应)则m= , 铝合金样品中铝的质量分数为。
(1)、操作①的名称是。(2)、固体A的化学式为;滤液②中所含的金属阳离子为。(3)、写出滤液③和铁粉发生反应的一个化学方程式;该反应的基本类型为 反应。(4)、Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是。(5)、另有同学乙将一定质量的锌粒投入含有Cu(NO3)2 和Fe(NO3)3的混合溶液中,充分反应后过滤,若滤液中除了水之外,只含有一种物质,则滤渣中一定含有。(6)、铝合金广泛应用于生活中,兴趣小组同学称取20g铝合金粉末于烧杯中,将400g稀硫酸分四次加入(每次加入100g),充分反应,测得实验数据如下表所示:(假设该铝合金中只有铝能与稀硫酸反应,其他成分不与稀硫酸反应)则m= , 铝合金样品中铝的质量分数为。实验
第一次
第二次
第三次
第四次
加入稀硫酸的质量(g)
100
100
100
100
烧杯中剩余物的质量(g)
119.2
218.4
318.0
m