离子反应-2022高考化学一轮复习
试卷更新日期:2021-09-18 类型:一轮复习
一、单选题
-
1. 在酸性的无色透明溶液中能够大量共存的是( )A、NH 、Fe3+、SO 、Cl- B、Mg2+、Ag+、CO 、Cl- C、K+、NH 、Cl-、SO D、K+、Na+、NO 、HCO2. 氯气可用作自来水厂的消毒剂,但使用过程中要注意防泄漏。下图为自来水厂一种预防和处理 泄漏的方法。下列有关说法错误的是( )
 A、实验室用 和盐酸反应制取氯气的离子方程式为: B、铁屑的作用是将 还原为 C、吸收漏氯的离子方程式为: D、铁屑耗尽时溶液中可能大量存在: 、 、 、3. 常温下,用0.1mol·L-1氨水滴定10mL浓度均为0.1mol·L-1的HCl和CH3COOH的混合液,下列说法错误的是( )A、在氨水滴定前,HCl和CH3COOH的混合液中c(Cl-)>c(CH3COO-) B、当滴入氨水10mL时,c( )+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH) C、当滴入氨水20mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-) D、当溶液呈中性时,氨水滴入量大于20mL,c( )<c(Cl-)4. 常温下, 某透明溶液中,可能含有 、 、 、 、 、 、 和 中的某几种,且阳离子的物质的量相等,对该溶液进行如下实验(实验中气体体积已折算成标况下体积),下列判断错误的是( )
A、实验室用 和盐酸反应制取氯气的离子方程式为: B、铁屑的作用是将 还原为 C、吸收漏氯的离子方程式为: D、铁屑耗尽时溶液中可能大量存在: 、 、 、3. 常温下,用0.1mol·L-1氨水滴定10mL浓度均为0.1mol·L-1的HCl和CH3COOH的混合液,下列说法错误的是( )A、在氨水滴定前,HCl和CH3COOH的混合液中c(Cl-)>c(CH3COO-) B、当滴入氨水10mL时,c( )+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH) C、当滴入氨水20mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-) D、当溶液呈中性时,氨水滴入量大于20mL,c( )<c(Cl-)4. 常温下, 某透明溶液中,可能含有 、 、 、 、 、 、 和 中的某几种,且阳离子的物质的量相等,对该溶液进行如下实验(实验中气体体积已折算成标况下体积),下列判断错误的是( ) A、肯定不存在的离子是 、 B、肯定存在的阳离子是 、 、 、 、 C、肯定存在的阴离子是 、 ,且 D、 是否存在,可以取少量无色溶液甲进行焰色反应来判断5. 实验室以绿矾( )为原料制备 (难溶于水)的流程如下:
A、肯定不存在的离子是 、 B、肯定存在的阳离子是 、 、 、 、 C、肯定存在的阴离子是 、 ,且 D、 是否存在,可以取少量无色溶液甲进行焰色反应来判断5. 实验室以绿矾( )为原料制备 (难溶于水)的流程如下:
已知:“沉淀”时,生成碱式磷酸铁[ ]。下列说法错误的是( )
A、“氧化”后所得溶液中大量存在的离子有: 、 、 B、“沉淀”时,主要反应的离子方程式为 C、“过滤”时,所用的玻璃仪器主要有:烧杯、漏斗、玻璃棒 D、“转化”时,反应的化学方程式为6. 室温下,通过下列实验探究 溶液的性质。实验
实验操作和现象
1
用pH试纸测得 溶液的pH为4
2
向 溶液中加入 溶液,再滴加酚酞溶液,溶液颜色变红
3
向2中所得溶液中继续加入 溶液,溶液红色加深
4
向3中所得溶液中继续加入 溶液,出现黑色沉淀
下列说法正确的是( )
A、 溶液中存在 B、实验2所得溶液中存在 C、实验3所得溶液中存在 D、若忽略溶液混合时的体积变化,依据实验4的现象,可得出7. 下列说法错误的是( )A、叠氮酸( )与 酸性相近,则 溶液中离子浓度大小顺序为: B、①100mL0.1mol/L 、②100mL0.1mol/L 两种溶液中水电离出的 个数:②>① C、 、 、 、 溶于水,对水的电离都有促进作用 D、室温下,向0.01mol/L 溶液中滴加NaOH溶液至中性:8. 乙二酸( )俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH的变化关系如图。下列说法正确的是( )
已知:①室温下, 的 ; 的
②草酸钙( )难溶于水
A、 的草酸溶液中含有的大量粒子: 、 、 B、 溶液中: C、 的溶液中: D、向 溶液中加入足量澄清石灰水,产生白色沉淀:9. 常温下,在 溶液中逐滴滴入蒸馏水稀释,稀释过程中 和 的关系如图所示:
下列判断错误的是( )
A、随着溶液的稀释, 减小 B、 为弱碱,常温下, C、Q点微粒浓度: D、 的水解程度R点比Q点大10. 已知:25℃时, , 下列说法正确的是( )A、25℃时, 的水解常数 B、25℃时,反应 的平衡常数 C、同浓度的 溶液和NaCN溶液中, 溶液的离子总浓度较小 D、若加水稀释醋酸溶液,溶液中所有离子浓度均减小11. 类比pH,定义pC=-lgC,已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸,常温下,向1L0.1mol/L的H2A溶液中加入氢氧化钠固体,得到混合溶液的pH与pC(H2A、HA-、A2-)的关系如图所示(不考虑溶液体积和温度的变化),下列说法正确的是( ) A、曲线I、II、III分别代表的粒子为A2- , H2A,HA- B、向pH=4.19的溶液中加NaOH至溶液pH=5.57的过程中水的电离程度逐渐减小 C、滴定过程中 =101.38保持不变 D、c(Na+)=0.1mol/L时,溶液满足c(Na+)>c(HA-)>c(H2A)>c(A2-)12. H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2 O42-) =0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是( )
A、曲线I、II、III分别代表的粒子为A2- , H2A,HA- B、向pH=4.19的溶液中加NaOH至溶液pH=5.57的过程中水的电离程度逐渐减小 C、滴定过程中 =101.38保持不变 D、c(Na+)=0.1mol/L时,溶液满足c(Na+)>c(HA-)>c(H2A)>c(A2-)12. H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2 O42-) =0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是( ) A、由图可知:Ka2(H2C2O4)的数量级为10-4 B、若将0.05mol NaHC2O4和0.05mol Na2C2O4固体完全溶于水配成1L溶液,所得混合液的pH为4 C、c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) D、用标准的氢氧化钠溶液滴定H2C2O4溶液,可用酚酞做指示剂13. 常温下,向 溶液中滴加 的 溶液时, ( 、 或 )随V( 溶液)变化的曲线如图。下列叙述错误的是( )
A、由图可知:Ka2(H2C2O4)的数量级为10-4 B、若将0.05mol NaHC2O4和0.05mol Na2C2O4固体完全溶于水配成1L溶液,所得混合液的pH为4 C、c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) D、用标准的氢氧化钠溶液滴定H2C2O4溶液,可用酚酞做指示剂13. 常温下,向 溶液中滴加 的 溶液时, ( 、 或 )随V( 溶液)变化的曲线如图。下列叙述错误的是( )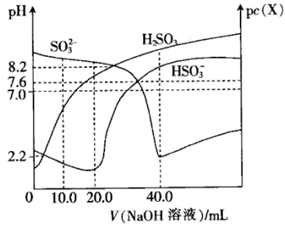 A、常温下, 的第一步电离平衡常数 B、当V( 溶液) 时, C、V( 溶液) 时,水的电离程度最大 D、常温下,当 时,有14. 某溶液中只可能含有 中的几种离子,各离子浓度均为 。某同学进行了如下实验:
A、常温下, 的第一步电离平衡常数 B、当V( 溶液) 时, C、V( 溶液) 时,水的电离程度最大 D、常温下,当 时,有14. 某溶液中只可能含有 中的几种离子,各离子浓度均为 。某同学进行了如下实验:
下列说法正确的是( )
A、无法确定原溶液中是否含有 B、原溶液中肯定存在的离子为 C、沉淀A为 ,沉淀C为 和 D、滤液X中大量存在的阳离子有 和15. 工业上为了除去锅炉中的水垢,要向锅炉里注入Na2CO3溶液浸泡一段时间,下列叙述正确的是( )A、若c(Na2CO3)=c[(NH4)2CO3],则两溶液中c(CO )也相等 B、锅炉中加入Na2CO3溶液发生反应的离子方程式为CO (aq)+CaSO4(s) CaCO3(s)+SO (aq) C、盐酸溶液中,Ksp(CaCO3)增大,Ksp(CaSO4)减小 D、向Na2CO3溶液中通入适量的CO2使溶液呈中性时,c(Na+)=c(CO )+c(HCO )16. 时,向 浓度均为 的 和 混合液中滴加 的氨水,随氨水体积(V)不断增加,溶液中离子浓度的变化趋势如图所示.下列说法错误的是(已知 , )( ) A、a点的混合溶液中 约为 B、b点的混合溶液中: C、滴定过程中 逐渐减小 D、c点溶液中:17. 下列实验一定不能达到目的的是( )
A、a点的混合溶液中 约为 B、b点的混合溶液中: C、滴定过程中 逐渐减小 D、c点溶液中:17. 下列实验一定不能达到目的的是( )选项
目的
实验
A
证明醋酸是弱酸
向醋酸钠溶液中加入酚酞溶液
B
检验Na2CO3溶液中是否混有NaCl
取样,加入过量的硝酸后,再滴加硝酸银溶液
C
检验溶液中是否含有
取少量试剂于试管中,加入浓NaOH溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体
D
制取较高浓度的次氯酸溶液
将Cl2通入小苏打溶液中
A、A B、B C、C D、D18. Na2C2O4可用作抗凝血剂。室温下,通过下列实验探究Na2C2O4溶液的性质。实验
实验操作和现象
1
测得0.1mol·L−1Na2C2O4溶液的pH≈8.4
2
向0.2mol·L−1Na2C2O4溶液中加入等体积0.2mol·L−1盐酸,测得混合后溶液的pH≈5.5
3
向0.1mol·L−1Na2C2O4溶液中滴加几滴酸性KMnO4溶液,振荡,溶液仍为无色
4
向0.1mol·L−1Na2C2O4溶液中加入等体积0.1mol·L−1CaCl2溶液,产生白色沉淀
下列有关说法错误的是( )
A、0.1mol·L−1Na2C2O4溶液中存在c(OH-)=c(H+)+2c(H2C2O4)+c(HC2O ) B、实验2得到的溶液中有c(H2C2O4)>c(Cl-)>c(C2O ) C、实验3中MnO 被还原成Mn2+ , 则反应的离子方程式为2MnO +5C2O +16H+=2Mn2++10CO2↑+8H2O D、依据实验4可推测Ksp(CaC2O4)<2.5×10−319. 室温下,通过下列实验探究NH4HCO3溶液的性质。实验
实验操作
实验现象
1
用pH试纸测定0.1mol·L-1NH4HCO3溶液的pH
pH约为8
2
向0.1mol·L-1NH4HCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液
析出白色沉淀
3
常温下,将等体积等物质的量浓度NH4HCO3与NaCl溶液混合
析出晶体
4
向0.1mol·L-1NH4HCO3溶液中加入0.1mol·L-1AlCl3溶液
有气泡产生
下列有关说法正确的是( )
A、0.1mol·L-1NH4HCO3溶液中存在c(NH )+c(NH3·H2O)+c(H+)=c(HCO )+c(CO )+c(H2CO3)+c(OH-) B、实验2反应静置后的上层清液中有c(Ba2+)·c(CO )<Ksp(BaCO3) C、实验3静置后的上层清液中有c(H+)+c(NH )>c(OH-)+c(HCO )+2c(CO ) D、实验4中产生的气体是NH3