甘肃省天水市武山县三校2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2021-09-16 类型:期中考试
一、单选题
-
1. 下列做法不利于环境保护的是( )A、开发太阳能、水能、风能、地热能等新能源 B、大力开采煤、石油和天然气,以满足人们日益增长的能源需求 C、大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 D、减少资源消耗,注重资源的重复使用、资源的循环再生2. 下列说法正确的是( )A、HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol B、CO(g)的燃烧热是ΔH=-283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol C、101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 D、反应物所具有的总能量小于生成物所具有的总能量时,△H<03. 已知H-H、Cl-Cl和H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1 , 请用此数据估计,由Cl2、H2生成2mol H-Cl时的热效应△H等于( )A、-183 kJ·mol-1 B、-91.5kJ·mol-1 C、+183kJ·mol-1 D、+ 91.5kJ·mol-14. 已知:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2和△H3的大小关系为 ( )A、△H1=△H2 B、△H2>△H1 C、△H3>△H2 D、△H1>△H35. 已知热化学反应方程式:
Zn(s)+ O2(g)= ZnO(s);ΔH=-351.5 kJ·mol-1
Hg(l)+ O2(g) =HgO(s);ΔH=-90.8 kJ·mol-1
则锌汞电池中热化学方程式:Zn(s)+HgO(s) =ZnO(s)+Hg(l)的ΔH为( )
A、ΔH= +260.7 kJ/mol B、ΔH= -260.7 kJ/mol C、ΔH= -444.2 kJ/mol D、ΔH= +444.2 kJ/mol6. 已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为( )A、2912 kJ B、2953 kJ C、3236 kJ D、3867 kJ7. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1

下列说法正确的是( )
A、CH3OH的燃烧热为192.9kJ∙mol-1 B、反应①中的能量变化如图所示 C、CH3OH转变成H2的过程一定要吸收能量 D、根据②推知反应CH3OH(l)+ O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ∙mol-18. 下列说法正确的是( )A、活化分子碰撞即发生化学反应 B、增大反应物的浓度会加快反应速率,原因是增加了活化分子的百分数 C、某一反应的活化分子的百分数是个定值不随外界条件改变而改变 D、活化分子间的碰撞不一定是有效碰撞9. 在一可变容积的密闭容器中进行反应:C(s) + H2O(g)= CO(g) + H2(g),下列条件的改变能使反应速率减慢的是( )A、增加C的量 B、将容器的体积缩小一半 C、保持体积不变,充入N2 , 使体系的压强增大 D、保持压强不变,充入N2 , 使容器的体积变大10. 反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此段时间内,该反应的速率 可表示为( )A、 B、 C、 D、11. 在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)达到平衡的标志的是( )①C的生成速率与C的分解速率相等; ②单位时间内amol A生成,同时生成3amol B;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的物质的量不再变化; ⑥单位时间消耗amol A,同时生成3amol B;⑦A 、B、C的分子数目比为1:3:2。
A、②⑤ B、①③ C、②⑦ D、⑤⑥12. 在一不可变容器中发生如下反应:2NO2 2NO + O2 ΔH >0 达到平衡后,升温,混合气体的不变( )A、密度 B、颜色 C、压强 D、总物质的量13. 反应CuO(s)+C(s)=Cu(s)+CO(g) △H>0,ΔS>0,下列说法正确的是( )A、低温下自发进行,高温下非自发进行 B、高温下自发进行,低温下非自发进行 C、任何温度下均为非自发进行 D、任何温度下均为自发进行14. 下列关于平衡常数K的说法中,正确的是( )A、在任何条件下,化学平衡常数是一个恒定值 B、改变反应物浓度或生成物浓度都会改变平衡常数K C、平衡常数K只与温度有关,与反应浓度、压强无关 D、从平衡常数K的大小不能推断一个反应进行的程度15. 反应A(g) + 3B(g) 2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的( )A、 B、
B、 C、
C、 D、
D、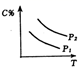 16. 可逆反应m A(s)+n B(g) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是( )
16. 可逆反应m A(s)+n B(g) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是( ) A、达平衡后,加入催化剂则C%增大 B、达平衡后,若升温,平衡左移 C、化学方程式中n>e+f D、达平衡后,增加A的量有利于平衡向右移动
A、达平衡后,加入催化剂则C%增大 B、达平衡后,若升温,平衡左移 C、化学方程式中n>e+f D、达平衡后,增加A的量有利于平衡向右移动二、填空题
-
17. 已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l);△H=﹣285kJ/mol
②H2O(g)=H2(g)+ O2(g);△H=+241.8kJ/mol
③C(s)+ O2(g)=CO(g);△H=﹣110.4kJ/mol
④C(s)+O2(g)=CO2(g);△H=﹣393.5kJ/mol
回答下列各问:
(1)、上述反应中属于放热反应的是 . (用序号填写)(2)、C的燃烧热为 .(3)、燃烧10g H2生成液态水,放出的热量为 .(4)、CO的燃烧热的热化学方程式为 .18. 已知:①N2(g)+2O2(g) 2NO2(g) △H=+67.7kJ/mol②2N2H4(g)+2O2(g) 2N2(g)+4H2O(g) △H=-1068kJ/mol
(1)、火箭发射时可用肼(N2H4)作燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。根据盖斯定律写出N2H 4和NO2反应的热化学方程式为;(2)、肼(N2H4)和氧气反应的能量变化如图所示,图中E1表示 , E2表示 , △H=-534kJ/mol表示。 19. 在容积为1.00 L的容器中,通入一定量的N2O4 , 发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
19. 在容积为1.00 L的容器中,通入一定量的N2O4 , 发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)、反应的ΔH0(填“大于”或“小于”);(2)、100 ℃时,体系中各物质浓度随时间变化如图所示。
在0~60 s时段,反应速率v(N2O4)为mol·L-1·s-1;反应的平衡常数K1为。
(3)、100 ℃时,反应达平衡后,将反应容器的容积减少一半。平衡向(填“正反应”或“逆反应”)方向移动,判断理由是。20. 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。 (1)、该反应平衡常数K的表达式为。(2)、温度降低,平衡常数K(填“增大”、“不变”或“减小”)。(3)、为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2 , 测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1 , CO2和H2的转化率比是
(1)、该反应平衡常数K的表达式为。(2)、温度降低,平衡常数K(填“增大”、“不变”或“减小”)。(3)、为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2 , 测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1 , CO2和H2的转化率比是 (4)、下列措施中能使(3)题中 增大的有___________。(填字母)A、升高温度 B、加入催化剂 C、将H2O(g)从体系中分离 D、充入He(g),使体系总压强增大 E、再充入1mol CO2和3mol H2
(4)、下列措施中能使(3)题中 增大的有___________。(填字母)A、升高温度 B、加入催化剂 C、将H2O(g)从体系中分离 D、充入He(g),使体系总压强增大 E、再充入1mol CO2和3mol H2三、计算题
-
21. 一定温度下,将4mol N2 , 10mol H2通入10L的定容密闭容器中进行反应:
N2 (g)+ 3H2(g) 2NH3(g),10 min反应达到平衡,此时测得 N2 浓度为0.2 mol/L。
(1)、10 min内,用H2浓度变化来表示的反应速率为 , 平衡时NH3的物质的量为;(2)、平衡时N2和H2的转化率之比为;该温度下平衡常数K的值为;(3)、若起始将2mol N2 , 5mol H2通入10L的定容密闭容器中进行反应,在相同温度下再达到平衡时NH3的物质的量是___________;A、4 mol B、2mol C、小于2 mol D、大于2 mol,小于4 mol22. 在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2 2NO+O2 , 反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。列式计算:
(1)、NO2的转化率为多少?(2)、该温度下反应的平衡常数。(3)、在这5分钟内,用O2来表示的平均反应速率是多少?