浙江省山水联盟2021-2022学年高三上学期化学开学考试试卷
试卷更新日期:2021-09-16 类型:开学考试
一、单选题
-
1. 下列物质属于纯净物的是( )A、刚玉 B、水玻璃 C、天然气 D、绿矾
-
2. 下列物质属于弱电解质的是( )A、NH3 B、HCOOH C、NaHCO3 D、CH3CH2OH
-
3. 下列物质对应的组成正确的是( )A、摩尔盐:(NH4)2Fe(SO4)2 B、硝化纤维:
 C、生石灰:CaSO4•2H2O
D、氯仿:CHCl3
C、生石灰:CaSO4•2H2O
D、氯仿:CHCl3
-
4. 实验室用95%乙醇溶液制备无水乙醇,通常需要用到的仪器是( )A、
 B、
B、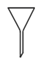 C、
C、 D、
D、
-
5. 下列表示正确的是( )A、
 的最简式:CH2
B、2,3,5-三甲基-4-乙基己烷键线式:
的最简式:CH2
B、2,3,5-三甲基-4-乙基己烷键线式:  C、氨基的电子式:
C、氨基的电子式:  D、CF4的比例模型:
D、CF4的比例模型: 
-
6. 化学与生活、社会发展息息相关。下列有关说法正确的是( )A、聚丙烯酸钠可作“尿不湿”的原料 B、植物油、石蜡油、矿物油、地沟油的化学成分完全相同 C、FeO是一种具有磁性的黑色晶体,可作录音磁带的原材料 D、PE(聚乙烯)材料因其无毒且易降解,广泛用于食品包装
-
7. 下列说法错误的是( )A、 Se和 Se是同一元素的不同核素 B、H2O2和H2O互为同素异形体 C、CH3CH2Br和CH3CHBrCH3互为同系物 D、CH3-CH2-NO2和H2N-CH2-COOH为同分异构体
-
8. O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2 , 下列说法错误的是( )A、氧气是还原产物 B、O2F2是氧化剂 C、还原剂与氧化剂的物质的量之比为1:4 D、若生成448LHF,则转移0.8mol电子
-
9. 下列有关金属及其化合物的说法正确的是( )A、Na久置于空气中最终生成NaHCO3 B、金属单质在化学反应中往往体现出还原性 C、铁元素在自然界中都是以化合态形式存在的 D、Al能与任意强酸反应生成H2
-
10. 下列说法正确的是( )A、积极开发使用可燃冰有助于减少碳排放 B、陈薇院士团队开发的腺病毒载体疫苗(Ad5—CoV疫苗)性质较稳定,该疫苗在常温下保存即可 C、“天和空间站”使用的碳纤维是一种新型有机高分子材料 D、芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下发生分子间聚合而成像,该过程是化学变化
-
11. 下列说法错误的是( )A、烫伤时如果皮肤已破,可以涂1%的高锰酸钾溶液 B、除去己烷中少量的己烯可以加入酸性高锰酸钾溶液后分液 C、可将阿司匹林的粗产品溶解在饱和碳酸氢钠溶液中,再进行过滤即得到较纯阿司匹林 D、可用纸层析法分离含少量Fe3+和Cu2+的混合溶液,亲水性强的Cu2+在滤纸条的下方
-
12. 下列“类比”合理的是( )A、铜在氧气中燃烧生成氧化铜,则铜和硫粉混合加热中生成硫化铜 B、AlCl3溶液中滴加NaAlO2溶液能产生沉淀,则FeCl3溶液中加入NaAlO2溶液也能产生沉淀 C、
 能与氢气发生加成,则
能与氢气发生加成,则  也能与氢气发生加成
D、乙醇能被氧气在铜的作用下催化氧化,则所有的醇都能被氧气在铜的作用下催化氧化
也能与氢气发生加成
D、乙醇能被氧气在铜的作用下催化氧化,则所有的醇都能被氧气在铜的作用下催化氧化
-
13. 能符合题意表示下列变化的离子方程式为( )A、用碳酸氢钠溶液检验水杨酸中的羧基:
 +2HCO →
+2HCO →  +2H2O+2CO2↑
B、用铜作电极电解MgCl2溶液:Mg2++2Cl-+2H2O H2↑+Cl2↑+Mg(OH)2↓
C、往二元弱酸亚磷酸(H3PO3)溶液中滴加过量的烧碱溶液:H3PO3+3OH-=PO +3H2O
D、Ca(HCO3)2溶液与澄清石灰水按溶质物质的量之比2:3混合:Ca2++HCO +OH-=CaCO3↓+H2O
+2H2O+2CO2↑
B、用铜作电极电解MgCl2溶液:Mg2++2Cl-+2H2O H2↑+Cl2↑+Mg(OH)2↓
C、往二元弱酸亚磷酸(H3PO3)溶液中滴加过量的烧碱溶液:H3PO3+3OH-=PO +3H2O
D、Ca(HCO3)2溶液与澄清石灰水按溶质物质的量之比2:3混合:Ca2++HCO +OH-=CaCO3↓+H2O
-
14. 下列说法正确的是( )A、石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 B、乳糖、纤维二糖、蔗糖均为二糖,分子式均为C12H22O11 , 其中蔗糖、乳糖不能发生银镜反应,麦芽糖、纤维二糖能发生银镜反应 C、氨基酸残基在蛋白质肽链中的排列顺序称为蛋白质的一级结构,英国科学家桑格因测出牛胰岛素的一级结构而获得诺贝尔化学奖 D、纤维素与乙酸酐作用生成的醋酸纤维,其中短醋酸纤维叫人造棉、长醋酸纤维叫人造丝
-
15. 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M层电子数的三倍,下列说法正确的是( )
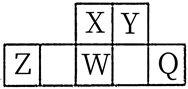 A、工业上常通过电解Z的熔融氯化物的方法制取Z的单质 B、简单离子半径:Q>Z>X>Y C、氢化物的沸点:Y>X>W D、X与Y可形成5种以上的化合物
A、工业上常通过电解Z的熔融氯化物的方法制取Z的单质 B、简单离子半径:Q>Z>X>Y C、氢化物的沸点:Y>X>W D、X与Y可形成5种以上的化合物 -
16. 已知三氟化氯(ClF3)是一种很强氧化剂和氟化剂,它能大多数有机和无机材料甚至塑料反应,可以使许多材料不接触火源就燃烧,可应用于航天工业。下列推测不合理的是( )A、ClF3与水按照1:2反应只生成一种弱酸和一种强酸 B、能与一些金属反应生成氯化物和氟化物 C、三氟化氯可用于清洁化学气相沉积的反应舱附着的半导体物质 D、可以代替H2O2充当火箭推进剂中的氧化物
-
17. 工业合成三氧化硫的反应为2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol,反应过程可用如图模拟(
 表示O2 ,
表示O2 ,  表示SO2 ,
表示SO2 ,  表示催化剂)。下列说法错误的是( )
表示催化剂)。下列说法错误的是( )  A、过程Ⅱ和过程Ⅲ决定了全部反应进行的程度 B、催化剂可降低反应的活化能,从而使单位体积中活化分子百分数增大,化学反应速率加快 C、过程Ⅱ为吸热过程,过程Ⅲ为放热过程;所以升高温度,过程Ⅱ速率加快,过程Ⅲ速率减 D、1molSO2和0.5molO2反应,放出的热量小于99kJ
A、过程Ⅱ和过程Ⅲ决定了全部反应进行的程度 B、催化剂可降低反应的活化能,从而使单位体积中活化分子百分数增大,化学反应速率加快 C、过程Ⅱ为吸热过程,过程Ⅲ为放热过程;所以升高温度,过程Ⅱ速率加快,过程Ⅲ速率减 D、1molSO2和0.5molO2反应,放出的热量小于99kJ -
18. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、常温下,1L0.5mol/LCH3COONH4溶液的pH=7,则溶液中出CH3COO-与NH 的数目均为0.5NA B、10g质量分数为46%的乙醇溶液中含有氢原子的数目为0.6NA C、17g羟基(—OH)中含有的电子数为10NA D、在密闭容器中将2molSO2和1molO2混合反应后,体系中的原子数为8NA
-
19. 下列一定能说明HClO是弱电解质的是( )A、25℃时,用pH试纸测0.01mol·L-1HClO的pH值 B、25℃时,NaClO溶液的pH值大于7 C、25℃时,若测得HClO溶液pH=a,取该溶液10.0mL,加蒸馏水稀释至100.0mL,测得pH=b,b-a<1,则HClO是弱酸 D、浓度相同的NaOH溶液分别与pH相同的次氯酸、盐酸反应呈中性,前者消耗的NaOH溶液的体积多
-
20. 一定条件下进行反应:COCl2(g) Cl2(g)+CO(g)。向2.0L恒容密闭容器中充入1.0molCOCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见表:
t/s
0
2
4
6
8
n(Cl2)/mol
0
0.30
0.39
0.40
0.40
下列说法正确的是( )
A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22mol·L-1 , 则反应的△H<0 B、若在2L恒容绝热(与外界没有热量变换)密闭容器进行该反应,化学平衡常数不变 C、保持其他条件不变,起始向容器中充入1.20molCOCl2、0.60molCl2和0.60molCO,反应达到平衡前的速率:v(正)<v(逆) D、2s时,用CO表示的化学反应速率为0.75mol·L-1·s-1 -
21. 室温下,将1molCuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1 , 将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;将1molCuSO4·5H2O加热到45℃时,失去两分子水、热效应为ΔH3;继续加热113℃时,再失去两分子水、热效应为ΔH4;最后加热到258℃以上,能脱去最后一分子水、热效应为ΔH5。下列判断一定正确的是( )A、ΔH1<ΔH3+ΔH4+ΔH5 B、ΔH2=ΔH3 C、ΔH1+ΔH3+ΔH4+ΔH5=ΔH2 D、ΔH1+ΔH2=ΔH3+ΔH4+ΔH5
-
22. 图示为一种积层型锂聚合物电池的结构。这是将正极(LiCoO2)/凝胶型聚合物电解质/碳和石墨系电池组叠加成平板,并用铝积层包封的电池结构。其中电池内的高分子聚合物能让Li+自由通过,碳和石墨系用C6表示。下列说法正确的是( )
 A、电池放电负极反应为:LiC6-e-=Li++C6 B、放电时,Li+向负极移动 C、充电时电极LiCoO2与电源负极相连 D、可用饱和的食盐水溶液代替凝胶型聚合物电解质
A、电池放电负极反应为:LiC6-e-=Li++C6 B、放电时,Li+向负极移动 C、充电时电极LiCoO2与电源负极相连 D、可用饱和的食盐水溶液代替凝胶型聚合物电解质 -
23. 以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数: ]

下列叙述正确的是( )
A、曲线①代表 ,曲线②代表 B、H2A溶液的浓度为0.2000 mol·L−1 C、HA−的电离常数Ka=1.0×10−2 D、滴定终点时,溶液中 -
24. 某杂志曾报道过某课题组利用磁性纳米Fe3O4颗粒除去水体中草甘膦污染物的方法,其原理如图所示(Fe3O4颗粒在水中表面会带-OH)。下列说法错误的是( )
 A、草甘膦能与氢氧化钠溶液反应 B、Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂 C、溶液中c(H+)越大,Fe3O4纳米颗粒除污效果越好 D、处理完成后,Fe3O4纳米颗粒可用磁铁回收,经加热活化重复使用
A、草甘膦能与氢氧化钠溶液反应 B、Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂 C、溶液中c(H+)越大,Fe3O4纳米颗粒除污效果越好 D、处理完成后,Fe3O4纳米颗粒可用磁铁回收,经加热活化重复使用 -
25. 下列实验操作、现象和所得到的结论均正确的是( )
选项
实验内容
实验结论
A
取两只试管,分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一只试管中加入0.01mol/LH2C2O4溶液2mL,向另一只试管中加入0.01mol/LH2C2O4溶液4mL,第一只试管中褪色时间长
H2C2O4浓度越大,反应速率越快
B
在试管中加入2mL0.1mol·L-1的CuSO4溶液,再加入1mL0.1mol·L-1NaOH溶液,最后加2~3滴某有机物,混合加热,无砖红色沉淀
该有机物不含醛基
C
取两只试管,分别加入等体积等浓度的双氧水,然后试管①中加入0.01mol/LFeCl3溶液2mL,向试管②中加入0.01mol/LCuCl2溶液2mL,试管①产生气泡快
加入FeCl3时,双氧水分解反应的活化能较大
D
检验FeCl2溶液中是否含有Fe2+时,将溶液滴入酸性KMnO4溶液,溶液紫红色褪去
不能证明溶液中含有Fe2+
A、A B、B C、C D、D
二、综合题
-
26. 回答下列问题:(1)、两种硼氢化物的熔点如表所示:
硼氢化物
NaBH4
Al(BH4)3
熔点/℃
400
-64.5
两种物质熔点差异的原因是。
(2)、已知NH3和水一样会发生类似的自耦电离2H2O H3O++OH- , 所以某同学认为NH3和水一样为电解质,根据这位同学的思路写出Ca(NH2)2电子式。 -
27. 将1L0.5mol·L-1CuSO4和0.2mol·L-1FeCl3混合溶液,用石墨为电极电解。一段时间后在阳极收集到8.96L(标况下)气体(不考虑氯气溶于水),电解结束后将溶液体积稀释至2L。
计算:(已知:lg2=0.3,lg3=0.5)
(1)、阳极析出气体为。(2)、计算稀释后溶液的pH(忽略溶液中离子水解)。 -
28. 氢能是解决化石能源枯竭与环境污染两大问题的理想选择,但安全和高效的储氢技术是目前氢能规模化应用的主要瓶颈。现有某固体化合物X(含有三种短周期元素)是一种络合氢化物储氢材料,某实验员对某固体化合物X作如图实验:

请回答:
(1)、化合物X的组成元素。(2)、溶液A中溶质组成:。(3)、试写出溶液B与过量CO2反应的离子方程式。(4)、试写出固体X与过量的NaOH溶液混合反应的化学方程式。(5)、利用如图装置和试剂可以测定生成A气体的体积。
①操作全部正确的条件下测出气体体积与理论值相比(填“偏大”“不变”“偏小”)。
②对实验装置如何改进能较为准确的测量出生产气体的体积。
-
29. 环戊二烯(
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题: 已知:
 (g)=
(g)=  (g)+H2(g) ΔH1=100.3kJ·mol-1①
(g)+H2(g) ΔH1=100.3kJ·mol-1①H2(g)+I2(g)=2HI(g) ΔH2=-11.0kJ·mol-1②
对于反应:
 (g)+I2(g)=
(g)+I2(g)=  (g)+2HI(g) ΔH3③(1)、关于反应③的判断(填“低温自发”、“高温自发”或者“任意条件均自发”),理由为。(2)、某温度下,等物质的量的碘和环戊烯(
(g)+2HI(g) ΔH3③(1)、关于反应③的判断(填“低温自发”、“高温自发”或者“任意条件均自发”),理由为。(2)、某温度下,等物质的量的碘和环戊烯( )在恒容容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。
)在恒容容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。 A.通入惰性气体
B.再充入碘和环戊烯各2mol
C.提高温度
D.增加环戊烯浓度
E.增加碘浓度
(3)、环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是___(填标号)。 A、T1>T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45mol·L-1(4)、环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为
A、T1>T2 B、a点的反应速率小于c点的反应速率 C、a点的正反应速率大于b点的逆反应速率 D、b点时二聚体的浓度为0.45mol·L-1(4)、环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制各原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。该电解池的总反应式为 , 电解制备需要在无水条件下进行,原因为。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制各原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。该电解池的总反应式为 , 电解制备需要在无水条件下进行,原因为。 
-
30. 苯乙酮得用于制香皂和香烟,也用作纤维素酯和树脂等的溶剂和塑料工业生产中的增塑剂等。实验室用Friedel—Craffs酰基化反应制苯乙酮的原理如下:
 +(CH3CO)2O
+(CH3CO)2O  +CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。
+CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。 
(实验步骤)
步骤一:向装有10mL分液漏斗、机械搅拌装置和回流装置(上端通过氯化钙干燥管与氯化氢气体吸收装置相连)的100mL仪器A中迅速加入13g(0.097mol)粉状无水三氯化铝和16mL(约14g,0.18mol)无水苯。在搅拌下将4mL(约4.3g,0.04mol)醋酸肝自分液漏斗慢慢滴加到A(先加几滴,待反应发生后再继续滴加),控制醋酸的滴加速度以使A稍热为宜。加完后(约10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。
步骤二:反应结束,将A中的液体倒入冷水中,经处理得到较纯净的苯乙酮。
步骤三:经称重苯乙酮产量约为4.1g,计算产率。
已知在常压下:
名称
分子质量
颜色晶型
熔点
沸点
密度
溶解度
醋酸酐
102
无色液体
-73
140
1.082
与水反应
苯
78
无色液体
5.5
80.5
0.879
不溶
苯乙酮
120
无色液体
20.5
202
1.0281
微溶
(1)、图一装置中仪器A名称是。(2)、图一装置中漏斗一半扣在水面下、一半露在水面上的原因是。(3)、制备过程中为什么要逐渐地滴加醋酸酐?。(4)、图一装置中CaCl2的作用是。(5)、步骤二为得到较纯净的苯乙酮,需要经过下列的操作:①蒸馏收集某温度下的馏分;②依次用10%的NaOH溶液、水洗分液;③用无水MgSO4干燥并过滤;④水层用苯萃取合并有机层;⑤分液。正确的顺序是___(填字母代号)。A、⑤④②③① B、⑤②③④① C、②④⑤①③ D、②④⑤③①(6)、本实验为收集产品用了减压蒸馏装置,如图二所示。装置中温度计水银球的位置是否正确?(“是”或“否”)。收集产品,需要控制一定温度,可能是(填字母代号)。A.202℃B.220℃C.175℃
(7)、经计算,该反应的产率为(保留两位有效数)。 -
31. 某课题组合成了化合物
 ,合成路线如图:
,合成路线如图: 
已知:
①RCHO+CH3CHO RCH=CHCHO+H2O
②
 +
+ 

请回答:
(1)、下列说法正确的是___。A、化合物C的分子结构中含有三种官能团 B、1H—NMR谱显示化合物F中有5种不同化学环境的氢原子 C、G→H的反应类型是取代反应 D、化合物H的分子式是C18H19O2N(2)、化合物A的化学名称是;化合物G的结构简式是。(3)、B→C的第(1)步化学方程式为。(4)、写出2种同时符合下列条件的化合物H的同分异构体的结构简式(不包括立体异构体)。①含两个苯环的一取代基
 ,且与碳碳双键直接相连;
,且与碳碳双键直接相连;②包含
 (双键两端的C不再连接H)片段;
(双键两端的C不再连接H)片段;③分子中只含有2个—CH3
(5)、以甲醛和乙烯为原料,设计制备化合物C(CH2ONO2)4的合成路线(用流程图表示,无机试剂任选)。
