辽宁省六校2021-2022学年高三上学期化学开学考试试卷
试卷更新日期:2021-09-16 类型:开学考试
一、单选题
-
1. 化学与生产、生活、科技等方面密切相关,下列有关说法错误的是( )A、修建“火神山”医院所用的高密度聚乙烯膜是一种无毒无味的高分子材料 B、“墨子号”卫星成功发射实现了光纤量子通信,生产光纤的原料为晶体二氧化硅 C、棉、麻、丝、毛等天然纤维完全燃烧都只生成CO2和H2O D、核酸检测是确认病毒类型的有效手段,核酸是一类含磷的生物高分子化合物2. 下列化学用语或模型正确的是( )A、甲烷和CCl4的空间填充模型均为
 B、水的结构式:
B、水的结构式:  C、乙烯的电子式:
C、乙烯的电子式:  D、Cr原子的价电子排布图:
D、Cr原子的价电子排布图:  3. 设NA代表阿伏加德罗常数的数值,下列有关说法正确的是( )A、3mol的NO2与H2O完全反应时转移的电子数为2NA B、46gC2H6O中一定含有NA个羟基 C、1L0.1mol/LNa2CO3溶液中含CO 数为0.1NA D、密闭容器中2molSO2与1molO2反应,生成SO3的分子数为2NA4. 下列离子方程式正确的是( )A、向Fe(OH)3中加入过量的HCl溶液:H++OH-=H2O B、向澄清石灰水中通入足量二氧化碳:CO2+OH-= C、NH4HCO3溶液中加入过量NaOH溶液:OH-+NH =NH3•H2O D、次氯酸钙溶液通入二氧化硫气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO5. 中医药是中华民族的瑰宝。有机化合物M是常用中药白芷中的活性成分之一,M的结构简式如图所示。下列说法正确的是( )
3. 设NA代表阿伏加德罗常数的数值,下列有关说法正确的是( )A、3mol的NO2与H2O完全反应时转移的电子数为2NA B、46gC2H6O中一定含有NA个羟基 C、1L0.1mol/LNa2CO3溶液中含CO 数为0.1NA D、密闭容器中2molSO2与1molO2反应,生成SO3的分子数为2NA4. 下列离子方程式正确的是( )A、向Fe(OH)3中加入过量的HCl溶液:H++OH-=H2O B、向澄清石灰水中通入足量二氧化碳:CO2+OH-= C、NH4HCO3溶液中加入过量NaOH溶液:OH-+NH =NH3•H2O D、次氯酸钙溶液通入二氧化硫气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO5. 中医药是中华民族的瑰宝。有机化合物M是常用中药白芷中的活性成分之一,M的结构简式如图所示。下列说法正确的是( ) A、M中含有三种含氧官能团 B、1molM最多与9molH2反应 C、M中碳原子的杂化方式共有三种 D、M能与Na2CO3溶液反应放出CO26. 如图是石墨、足球烯(C60)、金刚石三种晶体的结构示意图,下列说法正确的是( )
A、M中含有三种含氧官能团 B、1molM最多与9molH2反应 C、M中碳原子的杂化方式共有三种 D、M能与Na2CO3溶液反应放出CO26. 如图是石墨、足球烯(C60)、金刚石三种晶体的结构示意图,下列说法正确的是( ) A、这三种物质是碳的同分异构体,燃烧产物相同 B、这三种物质熔化时,克服的粒子间作用力完全相同 C、等物质的量的石墨、金刚石所含的C—C键数目之比为3:4 D、已知C(s,石墨)=C(s,金刚石)ΔH=+1.9kJ·mol-1 , 则金刚石比石墨稳定7. “接触法制硫酸”的主要反应是2SO2+O2 2SO3在催化剂表面的反应历程如下:
A、这三种物质是碳的同分异构体,燃烧产物相同 B、这三种物质熔化时,克服的粒子间作用力完全相同 C、等物质的量的石墨、金刚石所含的C—C键数目之比为3:4 D、已知C(s,石墨)=C(s,金刚石)ΔH=+1.9kJ·mol-1 , 则金刚石比石墨稳定7. “接触法制硫酸”的主要反应是2SO2+O2 2SO3在催化剂表面的反应历程如下:
下列说法正确的是( )
A、使用催化剂只能加快正反应速率 B、反应②的活化能比反应①大 C、该反应的催化剂是V2O4 D、过程中既有V—O键的断裂,又有V—O键的形成8. 下列实验操作规范且能达到目的的是( )A
B
C
D




得到纯净的氯气
溶液的配制
蒸发结晶NaCl
分离苯和溴苯
A、A B、B C、C D、D9. 分子式为C8H10O的芳香族化合物R可与金属钠反应且能与氯化铁溶液发生显色反应。则符合条件的R的结构(不考虑立体异构)有( )A、7种 B、8种 C、9种 D、10种10. 一种新型镁硫电池的工作原理如图所示。下列说法正确的是( ) A、该电池使用碱性电解质水溶液 B、充电时,电子从硫电极流出 C、使用的隔膜是阴离子交换膜 D、放电时,正极反应包括3Mg2++MgS8-6e-=4MgS211. “医用酒精"和84消毒液”混合,产生QW、Y2X4Z、YX3W等多种物质,已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素。下列叙述正确的是( )A、Y2X4Z中σ键和π键数目之比5:1 B、简单离子半径:Q+>Z2->X+ C、氧化物对应水化物的酸性:W>Y D、Z与Q形成的常见化合物中阴阳离子个数比1:212. 关于下列各装置图的叙述错误的( )
A、该电池使用碱性电解质水溶液 B、充电时,电子从硫电极流出 C、使用的隔膜是阴离子交换膜 D、放电时,正极反应包括3Mg2++MgS8-6e-=4MgS211. “医用酒精"和84消毒液”混合,产生QW、Y2X4Z、YX3W等多种物质,已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素。下列叙述正确的是( )A、Y2X4Z中σ键和π键数目之比5:1 B、简单离子半径:Q+>Z2->X+ C、氧化物对应水化物的酸性:W>Y D、Z与Q形成的常见化合物中阴阳离子个数比1:212. 关于下列各装置图的叙述错误的( ) A、图①装置可实现铁上镀铜,则a极为铜,b极为铁 B、图②装置可实现粗铜的精炼,则X极为正极 C、图①装置可用于氯碱工业,则电极总反应式为:2Cl-+2H2O H2↑+Cl2↑+2OH- D、图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法13. 表中,陈述Ⅰ、Ⅱ均正确及两者间具有因果关系( )
A、图①装置可实现铁上镀铜,则a极为铜,b极为铁 B、图②装置可实现粗铜的精炼,则X极为正极 C、图①装置可用于氯碱工业,则电极总反应式为:2Cl-+2H2O H2↑+Cl2↑+2OH- D、图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法13. 表中,陈述Ⅰ、Ⅱ均正确及两者间具有因果关系( )选项
陈述Ⅰ
陈述Ⅱ
A
小苏打可用于治疗胃酸过多
NaHCO3受热易分解
B
Na2O2可作潜水艇的供氧剂
Na2O2能和CO2、H2O反应生成O2
C
硫单质在纯氧中完全燃烧有少量SO3生成
二氧化硫在纯氧中易被氧化为SO3
D
氨气是电解质
NH3的水溶液显碱性
A、A B、B C、C D、D14. 金刚砂与金刚石具有相似的晶体结构,硬度为9.5,熔点为2700℃,其晶胞结构如图所示。下列说法错误的是( ) A、金刚砂的化学式为SiC B、SiC品体中碳原子和硅原子均采用sp3杂化 C、距离碳原子最近的碳原子数为12 D、金刚石的熔点低于2700℃15. 常温下,分别向25mL0.3mol/LNa2CO3溶液和25mL0.3mol/LNaHCO3溶液中逐滴滴加0.3mol/L稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示,下列说法正确的是( )
A、金刚砂的化学式为SiC B、SiC品体中碳原子和硅原子均采用sp3杂化 C、距离碳原子最近的碳原子数为12 D、金刚石的熔点低于2700℃15. 常温下,分别向25mL0.3mol/LNa2CO3溶液和25mL0.3mol/LNaHCO3溶液中逐滴滴加0.3mol/L稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示,下列说法正确的是( ) A、Y曲线为NaHCO3溶液的滴定曲线 B、b、c两点溶液中水的电离程度:b>c C、a点溶液中:c(Na+)+c(H+)>c(OH-)+c(HCO )+2c(CO ) D、c→d段离子方程式为:CO +2H+=CO2↑+H2O
A、Y曲线为NaHCO3溶液的滴定曲线 B、b、c两点溶液中水的电离程度:b>c C、a点溶液中:c(Na+)+c(H+)>c(OH-)+c(HCO )+2c(CO ) D、c→d段离子方程式为:CO +2H+=CO2↑+H2O二、综合题
-
16. 用含铬不锈钢废渣(含SiO2、Cr2O3、Fe2O3、Al2O3等)制取Cr2O3(铬绿)的工艺流程如图所示:
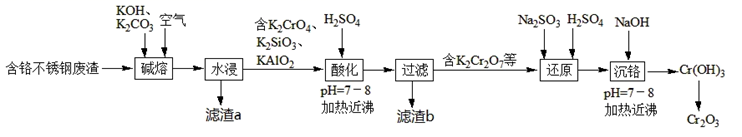
回答下列问题:
(1)、Cr在元素周期表中的位置:。(2)、K2CO3中的CO 的空间构型为。(3)、“水浸”时,碱熔渣中的KFeO2强烈水解生成的难溶物的化学式为。(4)、常温下,“酸化”时溶液的pH=8,则c(Al3+)=mol/L。(已知:常温下,Ksp[Al(OH)3]=1.3×10-33)(5)、滤渣b的主要成分为。(6)、“还原”时发生反应的离子方程式为。(7)、若在实验室里完成Cr(OH)3制取铬绿的操作,需要的主要仪器有铁架台、玻璃棒、。17. NaClO是生活中常用消毒剂,某同学用如图所示装置制备NaClO溶液,并进行成分测定。请回答下列问题: (1)、Ⅰ.NaClO的制备:
(1)、Ⅰ.NaClO的制备:该学习小组按如图装置进行实验(部分夹持装置已省去),反应一段时间后,测得C中溶液的 ;已知:饱和NaClO溶液pH为11。
仪器a的名称为 , 装置A中发生反应的离子方程式为。
(2)、C瓶溶液中c(ClO-)+c(Cl-)c(Na+) (填“>”、“<”或“=”)。(3)、装置B的作用为。(4)、Ⅱ.测定NaCl的浓度:取C瓶溶液20.00mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应: 。用0.1000mol/LNa2S2O3标准溶液滴定该锥形瓶中的溶液,常选用作指示剂,当加入最后一滴Na2S2O3标准溶液时,其现象为 , 重复操作2~3次,Na2S2O3溶液的平均用量为20.00mL(已知: )。计算C瓶溶液中NaClO的物质的量浓度为mol/L。
(5)、若滴定结束时俯视滴定管读数,则测定的NaClO的物质的量浓度将(填“偏高”、“偏低”或“无影响”)。18. 为实现我国承诺的“碳达峰、碳中和”目标,中国科学院提出了“液态阳光”方案,即将工业生产过程中排放的二氧化碳转化为甲醇,其中反应之一是:CO(g)+2H2(g) CH3OH(g)△H。回答下列问题:(1)、该反应的能量变化如图Ⅰ所示,反应的△H= , 曲线(填“a”或“b”)表示使用了催化剂。 (2)、下列措施既能加快反应速率,又能提高CO转化率的是___。A、升高温度 B、增大压强 C、及时分离出产品 D、增加CO投料量(3)、在恒温恒容密闭容器中按 =2,加入起始反应物。
(2)、下列措施既能加快反应速率,又能提高CO转化率的是___。A、升高温度 B、增大压强 C、及时分离出产品 D、增加CO投料量(3)、在恒温恒容密闭容器中按 =2,加入起始反应物。Ⅰ.下列描述不能说明反应达到平衡状态的是。
A.容器内压强不再变化B.氢气的转化率达到最大值
C.容器内CO与H2的浓度相等D.容器内CO的体积分数不再变化
Ⅱ.若CO的平衡转化率[α(CO)]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:Kp(R)Kp(S)(填“>”、“=”或“<”);若T1温度下达到平衡时体系总压为P,则Kp(R)=。
19. 烃A是基本有机化工原料,其分子式为C3H6 , 由A制备聚合物C和 合成路线如图所示(部分条件略去)
合成路线如图所示(部分条件略去) 
已知:
 +
+ 

R—C≡N RCOOH
(1)、E中含氧官能团名称为。(2)、C的结构简式为。(3)、D的分子式为。(4)、D→E的反应类型为。(5)、下列物质不能与 发生反应的是___(填序号)。 A、NaOH溶液 B、溴水 C、FeCl3溶液 D、金属Na(6)、写出E→F的化学方程式为。(7)、满足以下条件,化合物B的同分异构体有种。
发生反应的是___(填序号)。 A、NaOH溶液 B、溴水 C、FeCl3溶液 D、金属Na(6)、写出E→F的化学方程式为。(7)、满足以下条件,化合物B的同分异构体有种。①与B具有相同官能团②能发生银镜反应
写出其中核磁共振氢谱有3组峰,且峰面积之比为6:1:1的结构简式。