河北省邯郸市2021-2022学年高三上学期化学开学考试试卷
试卷更新日期:2021-09-16 类型:开学考试
一、单选题
-
1. 化学与生产生活密切相关,下列与化学有关的说法正确的是( )A、鲜花的香味来源于乙醇 B、食品加工时往往添加抗氧化剂,与化学反应速率有关 C、“嫦娥”系列卫星使用的碳纤维属于新型有机高分子材料 D、在酒化酶的作用下葡萄糖能水解为乙醇和二氧化碳2. 下列化学用语的表述正确的是( )A、甘油的结构简式
 B、溴乙烷的键线式:
B、溴乙烷的键线式:  C、四氯化碳的比例模型:
C、四氯化碳的比例模型:  D、三氟化硼的电子式:
D、三氟化硼的电子式:  3. 莽草酸酯是一种莽草的提取物,临床中可用于很多病症的治疗。下列有关莽草酸甲酯的说法正确的是( )
3. 莽草酸酯是一种莽草的提取物,临床中可用于很多病症的治疗。下列有关莽草酸甲酯的说法正确的是( ) A、属于芳香族化合物 B、分子式为C7H10O5 C、能发生氧化、消去和取代反应 D、1mol该有机物最多消耗2molH24. 某学习小组从海带中提取碘单质并进行纯化。下列实验装置和操作能达到目的的是( )
A、属于芳香族化合物 B、分子式为C7H10O5 C、能发生氧化、消去和取代反应 D、1mol该有机物最多消耗2molH24. 某学习小组从海带中提取碘单质并进行纯化。下列实验装置和操作能达到目的的是( ) A、装置甲灼烧海带 B、装置乙用苯萃取碘水中的I2 C、装置丙从碘苯溶液中提取I2 D、装置丁精制单质碘5. 白磷(P4)通常是白色或黄色蜡状固体,几乎不溶于水,易溶于有机溶剂,可与热的浓碱反应,其反应的化学方程式为P4+3NaOH+3H2O=3NaH2PO2+PH3↑。次磷酸钠(NaH2PO2)是一种正盐,水溶液呈碱性(设NA为阿伏加德罗常数的值)。下列有关说法正确的是( )A、H3PO2是一元弱酸 B、生成1molPH3时,有4NAP—P键断裂 C、次磷酸钠的水溶液呈碱性的原因是H2PO 的水解大于H2PO 的电离 D、白磷与热的浓碱反应时,氧化剂和还原剂的物质的量之比为3∶16. 某实验小组模拟海水淡化的同时制备H2、Cl2和NaOH溶液,装置如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
A、装置甲灼烧海带 B、装置乙用苯萃取碘水中的I2 C、装置丙从碘苯溶液中提取I2 D、装置丁精制单质碘5. 白磷(P4)通常是白色或黄色蜡状固体,几乎不溶于水,易溶于有机溶剂,可与热的浓碱反应,其反应的化学方程式为P4+3NaOH+3H2O=3NaH2PO2+PH3↑。次磷酸钠(NaH2PO2)是一种正盐,水溶液呈碱性(设NA为阿伏加德罗常数的值)。下列有关说法正确的是( )A、H3PO2是一元弱酸 B、生成1molPH3时,有4NAP—P键断裂 C、次磷酸钠的水溶液呈碱性的原因是H2PO 的水解大于H2PO 的电离 D、白磷与热的浓碱反应时,氧化剂和还原剂的物质的量之比为3∶16. 某实验小组模拟海水淡化的同时制备H2、Cl2和NaOH溶液,装置如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( ) A、甲室产生的气体能使湿润的淀粉—KI试纸变蓝 B、膜①是阴离子交换膜 C、淡水的出口只有c D、随着电解的进行,戊室溶液的pH不断增大7. 下列过程涉及的离子方程式的书写正确的是( )A、KAl(SO4)2溶液中滴加过量的Ba(OH)2溶液:Al3++2SO +2Ba2++4OH-=2BaSO4↓+2H2O+AlO B、电解MgCl2溶液:2H2O+2Cl- Cl2↑+H2↑+2OH- C、Fe2(SO4)3溶液与H2S反应:2Fe2++3H2S=2FeS↓+S↓+6H+ D、纯碱溶液中滴加溴水:2OH-+Br2=Br-+BrO-+H2O8. 已知X、Y、Z、M、N均为短周期主族元素。25℃时,各元素最高价氧化物对应水化物的溶液(浓度均为0.01mol·L-1)的pH和原子序数的关系如图所示。下列说法正确的是( )
A、甲室产生的气体能使湿润的淀粉—KI试纸变蓝 B、膜①是阴离子交换膜 C、淡水的出口只有c D、随着电解的进行,戊室溶液的pH不断增大7. 下列过程涉及的离子方程式的书写正确的是( )A、KAl(SO4)2溶液中滴加过量的Ba(OH)2溶液:Al3++2SO +2Ba2++4OH-=2BaSO4↓+2H2O+AlO B、电解MgCl2溶液:2H2O+2Cl- Cl2↑+H2↑+2OH- C、Fe2(SO4)3溶液与H2S反应:2Fe2++3H2S=2FeS↓+S↓+6H+ D、纯碱溶液中滴加溴水:2OH-+Br2=Br-+BrO-+H2O8. 已知X、Y、Z、M、N均为短周期主族元素。25℃时,各元素最高价氧化物对应水化物的溶液(浓度均为0.01mol·L-1)的pH和原子序数的关系如图所示。下列说法正确的是( ) A、原子半径大小顺序:Z>Y>X B、五种元素的氢化物均为共价化合物 C、最高价氧化物对应的水化物的酸性:M>N D、Z的常见氧化物中阴、阳离子个数比均为1∶29. 常温下,下列溶液中的微粒浓度关系错误的是( )A、氯水与NaOH溶液混合:c(Cl-)=c(HClO)+c(ClO-) B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) C、0.2mol·L-1NaHCO3溶液与0.1mol·L-1NaOH溶液等体积混合:c(CO )>c(HCO )>c(OH-)>c(H+) D、物质的量浓度相等的NH3·H2O和NH4Cl溶液等体积混合:c(NH3·H2O)+c(OH-)=c(H+)+c(Cl-)10. 下表中根据实验操作和现象所得出的结论正确的是( )
A、原子半径大小顺序:Z>Y>X B、五种元素的氢化物均为共价化合物 C、最高价氧化物对应的水化物的酸性:M>N D、Z的常见氧化物中阴、阳离子个数比均为1∶29. 常温下,下列溶液中的微粒浓度关系错误的是( )A、氯水与NaOH溶液混合:c(Cl-)=c(HClO)+c(ClO-) B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) C、0.2mol·L-1NaHCO3溶液与0.1mol·L-1NaOH溶液等体积混合:c(CO )>c(HCO )>c(OH-)>c(H+) D、物质的量浓度相等的NH3·H2O和NH4Cl溶液等体积混合:c(NH3·H2O)+c(OH-)=c(H+)+c(Cl-)10. 下表中根据实验操作和现象所得出的结论正确的是( )选项
实验操作
实验现象
结论
A
向某溶液中滴加少量酚酞
溶液变红
该溶液一定是碱溶液
B
向某溶液中滴加少量盐酸
产生白色沉淀
原溶液中一定含有Ag+
C
将某气体通入品红溶液中
溶液褪色
该气体一定是SO2
D
向饱和AgCl溶液中加入NaCl固体
产生白色沉淀
AgCl溶液中存在沉淀溶解平衡
A、A B、B C、C D、D11. 常温下用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2R溶液,所得溶液的pH与离子浓度变化的关系如图所示。下列说法错误的是( ) A、曲线L1表示pH与lg 的变化关系 B、常温下H2R的第二步电离平衡常数Ka2的数量级为10-8 C、水的电离程度:M>N D、0.01mol·L-1H2R溶液的pH约为3.5
A、曲线L1表示pH与lg 的变化关系 B、常温下H2R的第二步电离平衡常数Ka2的数量级为10-8 C、水的电离程度:M>N D、0.01mol·L-1H2R溶液的pH约为3.5二、多选题
-
12. 一种由前20号元素组成的化合物甲,其结构如图所示。已知:X、Y、Z、W的原子序数依次增大,且处于不同的周期。下列有关说法错误的是( )
 A、化合物甲中Y的化合价均为-2价 B、简单氢化物的稳定性:Y>Z C、化合物甲中含有离子键、极性键和非极性键 D、元素Z的氧化物中各原子均满足8电子稳定结构13. 苯与Br2的催化反应历程如图所示。下列说法正确的是( )
A、化合物甲中Y的化合价均为-2价 B、简单氢化物的稳定性:Y>Z C、化合物甲中含有离子键、极性键和非极性键 D、元素Z的氧化物中各原子均满足8电子稳定结构13. 苯与Br2的催化反应历程如图所示。下列说法正确的是( ) A、
A、 是总反应的催化剂
B、
是总反应的催化剂
B、 转化为
转化为 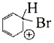 是总反应的决速步骤
C、苯与Br2的催化反应是放热反应
D、反应生成的有机产物中,取代产物所占比例更大
是总反应的决速步骤
C、苯与Br2的催化反应是放热反应
D、反应生成的有机产物中,取代产物所占比例更大
三、综合题
-
14. 硼酸(H3BO3)是一种重要的化工原料。工业上以硼镁矿(主要成分为Mg2B2O5·H2O和SiO2 , 还含有少量的Fe3O4、Al2O3等杂质)为原料生产硼酸和MgCl2·6H2O,其工艺流程如图:

已知:H3BO3能溶于水,且其溶解度随温度的升高而升高。回答下列问题:
(1)、为加快“加热溶解”的速率,可采取的措施是(请写出两条),“加热溶解”时主要反应的化学方程式为。(2)、滤渣Ⅰ和滤渣Ⅱ的主要成分分别为、(填化学式)。(3)、“趁热过滤”的目的是 , 操作Ⅰ为。(4)、“氧化”时反应的离子方程式为。(5)、室温下,“除杂”时调节pH=5,则此时溶液中c(Fe3+)=mol·L-1。已知:室温下Ksp[Fe(OH)3]=2.8×10-39。15. 亚氯酸钠(NaClO2)具有强氧化性,主要用于棉纺、亚麻、纸浆漂白、食品消毒、水处理、杀菌灭藻和鱼药制造等方面。某兴趣小组利用如图装置制备亚氯酸钠,并对其性质进行探究。
已知:二氧化硫与氯酸钠在酸性条件下反应生成二氧化氯气体。
回答下列问题:
(1)、实验证明装置A中使用70%的浓硫酸效果最好,原因为。(2)、装置B中,盛放氯酸钠溶液和稀硫酸的仪器名称为。(3)、一段时间后,C装置中有NaClO2晶体析出,则C装置中发生的化学反应方程式为 , 装置C采用冷水浴的原因为。(4)、装置D的作用为。(5)、取ag装置C中的晶体,加水溶解,配成100mL溶液。取25mL加入稀硫酸酸化的足量的KI溶液中充分反应,再加入淀粉作指示剂,用浓度为cmol·L-1的硫代硫酸钠标准溶液滴定,滴定终点消耗硫代硫酸钠溶液VmL(已知:I2+2S2O =S4O +2I-)。①NaClO2与稀硫酸酸化的KI溶液反应的离子方程式为。
②滴定终点的现象为。
③晶体中NaClO2的质量分数为(用含a、c和V字母的式子表示)。
16. 甲醇是重要的化工原料,合成甲醇的研究和探索,在国际上一直受到重视。工业上常用CO2和H2为原料,在Cu/ZnO催化剂的作用下,合成甲醇。回答下列问题:(1)、常温下,H2和甲醇的燃烧热分别为285.8kJ·mol-1和726.4kJ·mol-1 , 1mol甲醇汽化需要吸收82.0kJ的热量,则CO2和H2在Cu/ZnO催化作用下合成气态甲醇的热化学方程式为。(2)、在Cu/ZnO催化作用下,CO2和H2合成甲醇的总反应分两步进行:第一步为(写化学方程式);
第二步为Cu/ZnO*+2H2+CO2=Cu/ZnO+CH3OH。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能(填“大于”“小于”或“等于”)第一步反应活化能。
(3)、恒温恒容下,CO2和H2按物质的量1∶3混合发生上述反应制气态甲醇和液态水。下列事实能说明该反应一定达到平衡状态的是___(填选项字母)。A、CO2和H2的转化率之比不再改变 B、甲醇的体积分数不再改变 C、气体密度不再改变 D、平衡常数不再改变(4)、将物质的量之比为1∶3的CO2与H2的混合气体,以一定流速通过装有Cu/ZnO的反应器。反应相同的时间,甲醇的产率随温度的变化曲线如图所示。
270~280℃甲醇产率随温度变化的可能原因;由图可知,在Cu/ZnO催化剂的作用下,CO2和H2合成甲醇的最佳温度范围为。
(5)、将物质的量之比为1∶3的CO2和H2的混合气体充入压强为p0 , 温度为320℃的恒容密闭容器中,发生反应合成气态甲醇和气态水,则该温度下反应的平衡常数Kp=(用含p0的式子表示,平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(6)、熔融Na2CO3条件下,甲醇燃料电池的负极反应为。17. 碳、氮和铬的相关化合物在药物化学及催化化学等领域应用广泛。请回答下列问题:(1)、基态铬原子价电子排布式为 , 未成对电子数为。(2)、铬的一种含氧酸——铬酸(H2CrO4),结构和硫酸类似。其阴离子CrO 的立体构型为 , 铬酸是一种二元强酸,原因是。(3)、含铬的化合物吡啶甲酸铭是一种用于二型糖尿病的保健药,其结构如图所示。
①该化合物中H、C、N、O的电负性由大到小的顺序为 , N原子的杂化轨道类型为。
②该化合物中含有的化学键类型有(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)、铬的某种氧化物晶胞如图所示(灰球代表铬原子,黑球代表氧原子)。
该氧化物的化学式为 , 铬原子的配位数是;该晶体的密度为g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即)。
18. 白柠檬素(有机化合物I)是一种重要的有机化工原料,可广泛用于医药、农药、香料及其他精细化工行业。可通过以下路线合成白柠檬素:
已知:①CH3CN CH3COOH
②
 +CH3CHO
+CH3CHO 
回答下列问题:
(1)、A的名称是。(2)、F的结构简式为。(3)、G→H反应的化学方程式为。(4)、H→I的反应类型为 , 白柠檬素(I)中所含的含氧官能团是。(5)、芳香族化合物M是B的同分异构体,符合下列条件的结构共有种。①三取代芳香族化合物
②官能团只有羟基
③1molM最多能与2molNaOH反应
其中,核磁共振氢谱共有6种吸收峰,且吸收峰面积比为1∶1∶2∶2∶2∶2的同分异构体的结构简式为。
(6)、根据上述合成路线中的相关知识,设计一种以 和
和  为主要原料制备
为主要原料制备  的合成路线(其他无机试剂任选):。
的合成路线(其他无机试剂任选):。