河北省2021-2022学年高三上学期化学开学考试试卷
试卷更新日期:2021-09-16 类型:开学考试
一、单选题
-
1. 2021年6月11日,国家航天局举行“天问一号”探测器着陆火星首批科学影像图揭幕仪式,公布了由“祝融号”火星车拍摄的“着巡合影”“中国印迹”等影像图。“祝融号”火星车使用的下列材料中,属于金属材料的是( )
 A、隔热降噪材料三胺泡沫 B、SiC颗粒 C、新型镁锂合金 D、有机热控涂层2. 下列化学用语表示正确的是( )A、N2H4的结构式:
A、隔热降噪材料三胺泡沫 B、SiC颗粒 C、新型镁锂合金 D、有机热控涂层2. 下列化学用语表示正确的是( )A、N2H4的结构式: B、Al3+的结构示意图:
B、Al3+的结构示意图:  C、BF3的电子式:
C、BF3的电子式:  D、异戊二烯的球棍模型:
D、异戊二烯的球棍模型:  3. 利用如图所示的装置制备气体可以控制反应,下列气体制备能选用如图所示装置的是( )
3. 利用如图所示的装置制备气体可以控制反应,下列气体制备能选用如图所示装置的是( )
选项
试剂
制备气体
A
和
B
和稀硫酸
C
生石灰和浓氨水
D
和浓
A、A B、B C、C D、D4. 下列过程与氧化还原反应无关的是( )A、聚丙烯用于制造汽车保险杠 B、食品包装袋中还原铁粉防氧化的过程 C、三星堆出土的青铜文物表面生成Cu2(OH)3Cl的过程 D、《淮南万毕术》记载:“白青,得铁即化为铜”5. 下列离子方程式书写正确的是( )A、向 溶液中通入足量 : B、将过量的镁粉加入氯化铁溶液中: C、向偏铝酸钠溶液中滴加过量的 溶液: D、澄清石灰水与 反应:6. 有机物 是合成药物 的中间体, 的结构简式如图所示。下列有关 的叙述正确的是( ) A、能发生酯化反应,不能发生加聚反应 B、既是乙酸乙酯的同系物,又是乙烯的同系物 C、 与足量钠反应能生成 (标准状况) D、 苯环上的一氯代物有3种7. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1molO2与足量钾反应生成KO2时,转移的电子数为4NA B、1L0.1mol·L-1NH4HSO4溶液中阴离子的数目大于0.1NA C、标准状况下,22.4L癸烷中含非极性键的数目为9NA D、78g由Na2S和Na2O2组成的混合物中含阴离子的总数为1.5NA8. 某金属有机多孔材料( )在常温常压下具有超高的 吸附能力(吸附时会放出热量),并能高效催化 和
A、能发生酯化反应,不能发生加聚反应 B、既是乙酸乙酯的同系物,又是乙烯的同系物 C、 与足量钠反应能生成 (标准状况) D、 苯环上的一氯代物有3种7. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1molO2与足量钾反应生成KO2时,转移的电子数为4NA B、1L0.1mol·L-1NH4HSO4溶液中阴离子的数目大于0.1NA C、标准状况下,22.4L癸烷中含非极性键的数目为9NA D、78g由Na2S和Na2O2组成的混合物中含阴离子的总数为1.5NA8. 某金属有机多孔材料( )在常温常压下具有超高的 吸附能力(吸附时会放出热量),并能高效催化 和 的反应,其工作原理如图所示。下列说法错误的是( )
的反应,其工作原理如图所示。下列说法错误的是( )  A、升温将不利于 的吸附 B、该过程中有非极性共价键的断裂 C、该过程总反应的化学方程式为
A、升温将不利于 的吸附 B、该过程中有非极性共价键的断裂 C、该过程总反应的化学方程式为 D、
D、 可与 溶液反应
9. 下列实验操作能达到目的的是( )
可与 溶液反应
9. 下列实验操作能达到目的的是( )选项
目的
实验操作
A
证明 溶液与盐酸反应后的溶液中盐酸过量
向 溶液与盐酸反应后的溶液中,滴加紫色石蕊溶液
B
用 固体配制 的 溶液
在适量的浓硝酸中溶解一定质量的 固体,加水稀释至指定体积
C
除去 中少量的
气体先通过饱和 溶液,后通过浓硫酸
D
检验植物油中含有碳碳双键
向植物油中加入 溶液,煮沸
A、A B、B C、C D、D10. 双极膜电渗析法制备缩水甘油( )的原理:将 氯 , 丙二醇的水溶液通过膜 与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。已知:由一张阳膜和一张阴膜复合制成的阴、阳复合膜为双极膜。在直流电场的作用下,双极膜复合层间的 解离成 和 并分别通过阴膜和阳膜。下列说法错误的是( )
)的原理:将 氯 , 丙二醇的水溶液通过膜 与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。已知:由一张阳膜和一张阴膜复合制成的阴、阳复合膜为双极膜。在直流电场的作用下,双极膜复合层间的 解离成 和 并分别通过阴膜和阳膜。下列说法错误的是( )  A、装置工作时, 氯 , 丙二醇被氧化 B、通电前后,电渗析室内溶液的 几乎不变 C、膜 为阴离子交换膜 D、装置工作时,阴极上发生的电极反应:11. 以氟磷灰石[含 ,和少量的 、 ]为原料制取( (氯化磷酸三钠)的工艺流程如下:
A、装置工作时, 氯 , 丙二醇被氧化 B、通电前后,电渗析室内溶液的 几乎不变 C、膜 为阴离子交换膜 D、装置工作时,阴极上发生的电极反应:11. 以氟磷灰石[含 ,和少量的 、 ]为原料制取( (氯化磷酸三钠)的工艺流程如下:
下列说法错误的是( )
A、分解氟磷灰石产生的气体为 B、滤渣1和滤渣2的成分相同 C、“制磷酸钠”的离子方程式为 D、“急速冷却”的目的是减少次氯酸盐的热分解二、多选题
-
12. 短周期主族元素 、 、 、 的原子序数依次增大, 的阴离子与锂离子具有相同的电子层结构, 的一种核素常用于考古断代, 原子的最外层电子数是内层电子数的3倍, 、 、 原子的最外层电子数总和等于 的原子序数。下列推断错误的是( )A、原子半径: B、化合物 中既含离子键又含共价键 C、最简单气态氢化物的稳定性: D、由上述四种元素组成的化合物的水溶液不可能呈碱性13. 已知:常温下, 。某温度下,饱和溶液中 与 、 的关系如图所示。
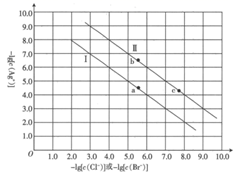
下列说法正确的是( )
A、曲线Ⅱ代表 的沉淀溶解平衡曲线 B、常温下, 的 C、常温下,当 时,饱和溶液中 D、加入 固体可使溶液由 点沿直线变为 点三、综合题
-
14. 高纯硅被誉为“信息革命的催化剂”。某小组同学模拟工业上用 与 在 的条件下制备高纯硅,实验装置如图所示(加热及夹持装置已略去)。
已知:① 的沸点为 ,密度为 ,易溶于有机溶剂,能与 剧烈反应,在空气中易被氧化;
② ;
③银氨溶液中存在: 。

实验步骤:
①打开 ,向安全漏斗中加入足量乙醇,使装置 中的反应进行一段时间;
②加热装置 ,打开 ,滴加 ;
③加热装置 至 ;
④关闭 ;
⑤关闭 。
回答下列问题:
(1)、仪器 的名称为。(2)、相比长颈漏斗,安全漏斗使用时的优点是。(3)、干燥管 中盛装的试剂是。(4)、加热装置 之前,先进行装置 中的反应,这样操作的目的是。(5)、装置 中发生反应的化学方程式为。(6)、 中 的作用是 , 实验过程中, 的上层溶液中观察到的现象是 , 尾气的主要成分是(填化学式)。(7)、根据下列数据可以计算出 的利用率的是(填标号)。a.钠的质量b.乙醇的体积和密度c.硅的质量
15. 某工厂以废料(主要含 ,还含少量的 、 、 )为原料制备碳酸铈、氯化铈等铈产品的流程如下:
已知: 具有强氧化性,通常情况下不和无机酸反应。
回答下列问题:
(1)、为加快“酸浸1”的速率,可采取的措施是(写一条即可)。(2)、检验“浸液 ”中含有 的试剂是(填化学式,下同)溶液,“浸渣 ”的主要成分为。(3)、“酸浸2”中双氧水的作用是(用离子方程式回答)。(4)、获得 的方法:将 和 混合灼烧,得到 并放出能使品红溶液褪色的气体。加入 的原因是。(5)、已知醋酸铵溶液呈中性,则 溶液中: (填“ ”、“ ”或“ ”) 。(6)、测定 的纯度:
①已知 与 反应后的产物为 ,则该反应中氧化产物( )与还原产物( )的物质的量之比为。
② 的纯度为 。[已知: 的摩尔质量为 ]
③若其他操作均正确,滴定后俯视读数,则测得 的纯度(填“偏高”“偏低”或“无影响”)。
16. 一种新型煤气化燃烧集成制氢发生的主要反应如下:Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.
副反应:
Ⅴ.
Ⅵ.
回答下列问题:
(1)、已知反应Ⅰ、Ⅱ的平衡常数 、 随温度的变化如图1、图2所示。
①由反应Ⅴ和反应Ⅵ可知, ;反应Ⅰ的 (填“>”或“<”)0。
②温度小于800℃时, ,原因是。
③为提高反应Ⅱ中 的转化率,可采取的措施是(写一条)。
④T℃时,向密闭容器中充入1 和3 ,只发生反应Ⅱ,此时该反应的平衡常数 , 的平衡转化率为。
(2)、从环境保护角度分析,该制氢工艺中设计反应Ⅲ的优点是。(3)、起始时在气化炉中加入1 C、2 及1 ,在2.5 下,气体的组成与温度的关系如图3所示。
①200~725℃时, 的量不断减少的原因是。
②725~900℃时, 的物质的量分数快速减小,其原因是。
17. 近年来,科学家研究的以复合过渡金属镍的氢氧化物为催化剂、三乙醇胺为电子给体以及 为光敏剂的催化体系,在可见光驱动下可高效催化还原 。(1)、下列有关 原子的叙述正确的是___________ (填标号)。A、第一电离能比钙的大 B、基态 原子的核外价电子排布式为 C、基态 原子形成基态 时,先失去 轨道上的电子(2)、三乙醇胺的制备:3 。
。 ①三乙醇胺所含的元素中,电负性由小到大的顺序为。
② 的空间结构为。
③键角: (填“ ”、“ ”或“ ”) 。
(3)、 能转化为高价值化学品,如 、 、 。上述3种物质中,沸点最高的是 ,原因是。(4)、 的结构如图所示。 原子的杂化类型为 , 配体 分子中含有 键的数目为 。 (5)、 的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置。已知晶胞的底边长为 ,高为 ,阿伏加德罗常数的值为 ,则该晶胞的密度为 (列出表达式)。
(5)、 的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置。已知晶胞的底边长为 ,高为 ,阿伏加德罗常数的值为 ,则该晶胞的密度为 (列出表达式)。
 18. Ramelteon是首个没有被列为特殊管制的非成瘾失眠症治疗药物,其一种合成路线如下:
18. Ramelteon是首个没有被列为特殊管制的非成瘾失眠症治疗药物,其一种合成路线如下:

已知:RCOOH RCOOCl

 (R-为烃基)。
(R-为烃基)。回答下列问题:
(1)、 中的官能团的名称为。(2)、 反应生成 至少需要 。(3)、由 生成 分两步进行,反应1)的化学方程式为 , 该反应的反应类型为。(4)、 的结构简式为。(5)、 与 发生加成反应的产物 ( )的同分异构体中能同时满足下列条件的有种。
)的同分异构体中能同时满足下列条件的有种。 a.能发生银镜反应;
b.除苯环外,不含其他环;
c.核磁共振氢谱显示有四组峰,且峰面积之比为 。
(6)、根据上述路线中的相关知识,以 为主要原料设计合成
为主要原料设计合成  。
。