广东省惠州市惠城区2021-2022学年高三上学期化学开学考试试卷
试卷更新日期:2021-09-16 类型:开学考试
一、单选题
-
1. 化学与生活密切相关,下列说法错误的是( )A、硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂 B、厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大 C、酒精能使蛋白质变性,预防新冠肺炎病毒使用的酒精纯度越高越好 D、使用氯气对自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害2. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、15.6gNa2O2与过量的CO2反应时,转移的电子数为0.4NA B、1L1mol·L-1FeCl3溶液中含有铁离子的数目为NA C、TK时,1LpH=6的纯水中含有1×10-6NA个OH- D、6.8g熔融的KHSO4中含有0.1NA个阳离子3. R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是( )(m、n均为正整数)A、若R(OH)n为强碱,则W(OH)n+1也为强碱 B、若X的最高正化合价为+5,则五种元素都是非金属元素 C、若Y的最低化合价为-2,则Z的最高正化合价为+6 D、若HnXOm为强酸,则Y是活泼非金属元素4. 下列指定反应的离子方程式正确的是( )A、NH4HCO3溶液和过量Ca(OH)2溶液混合:Ca2++NH +HCO +2OH-=CaCO3↓+H2O+NH3·H2O B、NaClO溶液与HI溶液反应:2ClO-+2H2O+2I-=I2+Cl2↑+4OH- C、磁性氧化铁溶于足量稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O D、明矾溶液中滴入Ba(OH)2溶液使SO 恰好完全沉淀:2Ba2++3OH-+Al3++2SO =2BaSO4↓+Al(OH)3↓5. 某有机物X的结构如图所示,下列说法正确的是( )
 A、X的分子式为C9H12O3 B、X中所有碳原子均可能共面 C、X可与氧气发生催化氧化反应 D、1molX最多能消耗2 mol NaOH6. 以下实验设计能达到实验目的的是
A、X的分子式为C9H12O3 B、X中所有碳原子均可能共面 C、X可与氧气发生催化氧化反应 D、1molX最多能消耗2 mol NaOH6. 以下实验设计能达到实验目的的是选项
实验目的
实验设计
A
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
B
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
D
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
A、A B、B C、C D、D7. 下列说法正确的是( )A、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0 B、已知2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1 , 则CO的燃烧热ΔH=-283 kJ C、已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热ΔH=2×(-57.3) kJ·mol-1 D、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,则热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-18. 用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)( ) A、用装置甲检验溶液中是否有K+ B、用装置乙制取并收集少量NH3 C、用装置丙进行喷泉实验 D、用装置丁加热熔融NaOH固体9. 已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g) ΔH=-24.2kJ·mol-1 , 在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析合理的是( )
A、用装置甲检验溶液中是否有K+ B、用装置乙制取并收集少量NH3 C、用装置丙进行喷泉实验 D、用装置丁加热熔融NaOH固体9. 已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g) ΔH=-24.2kJ·mol-1 , 在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析合理的是( ) A、前10min内,用v(NO2)表示的反应速率为0.02mol·L-1·min-1 B、反应进行到10min时,体系吸收的热量为9.68kJ C、a、b、c、d四点中v(正)与v(逆)均相等 D、25min时,正反应速率减小10. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图,下列说法错误的是( )
A、前10min内,用v(NO2)表示的反应速率为0.02mol·L-1·min-1 B、反应进行到10min时,体系吸收的热量为9.68kJ C、a、b、c、d四点中v(正)与v(逆)均相等 D、25min时,正反应速率减小10. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图,下列说法错误的是( ) A、反应消耗的NH3与O2的物质的量之比为4:5 B、溶液中OH-向电极a移动 C、O2在电极b上发生还原反应 D、负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O11. 反应 可用于纯硅的制备。下列有关该反应的说法正确的是( )A、该反应 、 B、该反应的平衡常数 C、高温下反应每生成1 mol Si需消耗 D、用E表示键能,该反应12. W、X、Y、Z为短周期原子序数依次增大的主族元素,其中W元素形成的单质密度最小,且W与X、Y、Z都能形成共价化合物,Y、W形成的常见化合物溶于水显碱性,Z、W形成的化合物溶于水显酸性。四种元素原子序数之和为30,可形成的某种化合物结构式为
A、反应消耗的NH3与O2的物质的量之比为4:5 B、溶液中OH-向电极a移动 C、O2在电极b上发生还原反应 D、负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O11. 反应 可用于纯硅的制备。下列有关该反应的说法正确的是( )A、该反应 、 B、该反应的平衡常数 C、高温下反应每生成1 mol Si需消耗 D、用E表示键能,该反应12. W、X、Y、Z为短周期原子序数依次增大的主族元素,其中W元素形成的单质密度最小,且W与X、Y、Z都能形成共价化合物,Y、W形成的常见化合物溶于水显碱性,Z、W形成的化合物溶于水显酸性。四种元素原子序数之和为30,可形成的某种化合物结构式为 。下列说法正确的是( ) A、该化合物中所有原子均满足8电子稳定结构 B、X和Z的最高价氧化物的水化物都是一元强酸 C、简单氢化物的沸点:Y>Z D、W与Y、Z三种元素形成的化合物中一定不含离子键13. 含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述错误的是( )
。下列说法正确的是( ) A、该化合物中所有原子均满足8电子稳定结构 B、X和Z的最高价氧化物的水化物都是一元强酸 C、简单氢化物的沸点:Y>Z D、W与Y、Z三种元素形成的化合物中一定不含离子键13. 含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述错误的是( ) A、该过程中可得到化工产品 B、该工艺流程是除去煤燃烧时产生的 C、该过程中化合价发生改变的元素只有O和S D、图中涉及的反应之一为:14. CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是( )
A、该过程中可得到化工产品 B、该工艺流程是除去煤燃烧时产生的 C、该过程中化合价发生改变的元素只有O和S D、图中涉及的反应之一为:14. CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是( ) A、途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 B、生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③ C、硫酸铜在1100℃分解的方程式为:2CuSO4 Cu2O+SO2↑+SO3↑+O2↑ D、当Y为葡萄糖时,葡萄糖发生还原反应15. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A、途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 B、生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量: ①=②<③ C、硫酸铜在1100℃分解的方程式为:2CuSO4 Cu2O+SO2↑+SO3↑+O2↑ D、当Y为葡萄糖时,葡萄糖发生还原反应15. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( ) A、a 和 b 分别为 T1、T2温度下CdS 在水中的溶解度 B、图中各点对应的 Ksp 的关系为: Ksp(m) = Ksp(n) < Ksp(p) < Ksp(q) C、向 m 点的溶液中加入少量Na2S 固体,溶液组成由m 沿 mpn 线向 p 方向移动 D、温度降低时,q 点的饱和溶液的组成由 q 沿 qp 线向p 方向移动16. 某文献报道,乙腈的某种催化水化反应机理如图所示:
A、a 和 b 分别为 T1、T2温度下CdS 在水中的溶解度 B、图中各点对应的 Ksp 的关系为: Ksp(m) = Ksp(n) < Ksp(p) < Ksp(q) C、向 m 点的溶液中加入少量Na2S 固体,溶液组成由m 沿 mpn 线向 p 方向移动 D、温度降低时,q 点的饱和溶液的组成由 q 沿 qp 线向p 方向移动16. 某文献报道,乙腈的某种催化水化反应机理如图所示:
下列有关该反应机理的说法错误的是( )
A、总反应的化学方程式为CH3CN+H2O CH3CONH2 B、 是反应的中间产物
C、
是反应的中间产物
C、 和
和  可为本反应的催化剂
D、
可为本反应的催化剂
D、 属于加成反应
属于加成反应
二、综合题
-
17. CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
 (1)、制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
(1)、制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):①装置a中反应发生的操作为 ;装置b中盛放的试剂是 。
②装置c中的长直导管的作用是。
(2)、制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是;该反应的化学方程式为。(3)、探究硫脲的性质:①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是(填化学式,下同)②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 。
③可用酸性KMnO4溶液滴定硫脲,已知MnO 被还原为Mn2+ , CS(NH2)2被反应为CO2、N2及SO , 该反应中氧化剂与还原剂的物质的量之比为。
18. 废旧可充电电池主要含有Fe、Ni、Cd、Co等金属元素,一种混合处理各种电池回收金属的新工艺如下图所示。
已知:Ⅰ.滤液①中含有Ni(NH3)62+、Cd(NH3)42+、Co(NH3) 62+等物质。
Ⅱ.萃取和反萃取的反应原理分别为:
Ni(NH3)62++ 2HR NiR2+2NH4++4NH3 ;NiR2+2H+ Ni2+ +2HR
(1)、为了加快浸取速率,可采取的措施为(任写一条)。(2)、已知浸取过程中NH3和NH4+的物质的量之和与Ni、Cd、Co浸取率的关系如表2所示。表2浸取过程中氨总量与各离子浸取率的关系
编号
n(NH3)+
n(NH4+)/mol
Ni浸取率/%
Cd浸取率/%
Co浸取率/%
①
2.6
97.2
88.6
98.1
②
3.5
86.0
98.8
86.7
③
4.8
98.4
98.8
94.9
④
5.6
97.7
85.1
96.8
⑤
9.8
95.6
84.1
96.1
则可采用的最佳实验条件编号为。
(3)、Co(OH)3与盐酸反应产生气体单质,该反应的化学方程式。(4)、操作①的名称为、过滤、洗涤。(5)、向有机相中加入H2SO4能进行反萃取的原因为(结合平衡移动原理解释)。(6)、将水相加热并通入热水蒸气会生成CdCO3沉淀,并产生使红色石蕊试纸变蓝的气体,该反应的离子方程式为。(7)、上述工艺流程中可能循环使用的物质为。(8)、已知Ksp(CdCO3)=1.0×10-12 , Ksp(NiCO3)=1.4×10-7。若向物质的量浓度均为0.2mol/L的Cd2+和Ni2+溶液中滴加Na2CO3溶液(设溶液体积增加1倍),使Cd2+恰好沉淀完全,即溶液中c(Cd2+)=1.0×10-5mol/L时,是否有NiCO3沉淀生成(填“是”或者“否”)。19. 合成氨是目前最有效工业固氮的方法,解决数亿人口生存问题。回答下列问题:(1)、科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
由图可知合成氨反应 N2(g)+ H2(g) NH3(g)的∆H= kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为。
(2)、工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
①500℃时,反应平衡常数Kp(30MPa) Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为(保留2位有效数字),Kp=(MPa)-2(列出计算式)。
(3)、科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
①阴极区生成NH3的电极方程式为。
②下列说法正确的是(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.该装置用金(Au)作催化剂目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
20. (CdSe)n小团簇(CdnSen,n=1~16)为Ⅱ-Ⅵ族化合物半导体材料,具有独特的光学和电学性质,常应用于发光二极管、生物系统成像与诊断等方面。回答下列问题:
(1)、基态Se原子的价层电子排布式为。(2)、Cd的第一电离能大于同周期相邻元素,原因是。(3)、CdS、CdSe、CdTe均为重要的Ⅱ-Ⅵ族化合物半导体材料,熔点分别为1750℃、1350℃、1041℃,上述熔点呈规律性变化的原因是。(4)、利用有机配体PH3、N(CH3)3等修饰(CdSe)2可改善其光致发光效率。其中PH3的空间构型是。N(CH3)3中参与形成配位键的孤电子对占据的轨道是。(5)、CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为( , , ),则B、C的原子坐标参数分别为。该晶胞中CdSe键的键长为。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为。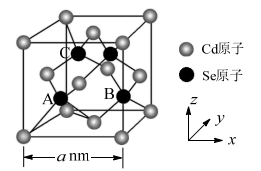 21. 氟班色林(F)可用于抑郁症的治疗,以下是氟班色林的合成路线:
21. 氟班色林(F)可用于抑郁症的治疗,以下是氟班色林的合成路线:
回答下列问题:
(1)、A的结构简式为 , 的反应类型为。(2)、 过程中,还生成一种烃的含氧衍生物J,J的相对分子质量为58.J的结构简式为。(3)、结构中含1个六元环且核磁共振氢谱中峰面积比为1∶1∶1∶2的G的同分异构体有种,写出其中一种的结构简式:。(4)、H可由环氧乙烷( )和 反应制得,试写出制备H的化学方程式:。 (5)、请完成以甲苯为原料合成
)和 反应制得,试写出制备H的化学方程式:。 (5)、请完成以甲苯为原料合成 的反应路线:
的反应路线: 