四川省成都市大邑县2020-2021学年九年级上学期化学期中考试试卷
试卷更新日期:2021-09-16 类型:期中考试
一、单选题
-
1. 以下事例属于化学变化的是( )A、水的沸腾
 B、研碎胆矾
B、研碎胆矾  C、石灰石与盐酸反应
C、石灰石与盐酸反应  D、玻璃片上出现水雾
D、玻璃片上出现水雾  2. 下列对空气的相关叙述正确的是( )A、空气是由空气分子构成的 B、空气中的氧气可以作燃料 C、空气的成分按质量计算,氮气大约占78% D、空气中的氮气、氧气经混合,它们的化学性质未改变3. 下图所示的实验操作正确的是( )A、加热液体
2. 下列对空气的相关叙述正确的是( )A、空气是由空气分子构成的 B、空气中的氧气可以作燃料 C、空气的成分按质量计算,氮气大约占78% D、空气中的氮气、氧气经混合,它们的化学性质未改变3. 下图所示的实验操作正确的是( )A、加热液体 B、熄灭酒精灯
B、熄灭酒精灯  C、闻气味
C、闻气味  D、滴加液体
D、滴加液体  4. 下列关于水的说法错误的是( )A、水是一种化学资源 B、园林浇灌改为喷灌、滴灌可节约水资源 C、过滤能将硬水软化 D、不合理使用农药、化肥会造成水污染5. 下列化学用语的书写正确的是( )A、铜元素CU B、两个氢原子2H C、锌元素zN D、氯元素cl6. 下列各图中
4. 下列关于水的说法错误的是( )A、水是一种化学资源 B、园林浇灌改为喷灌、滴灌可节约水资源 C、过滤能将硬水软化 D、不合理使用农药、化肥会造成水污染5. 下列化学用语的书写正确的是( )A、铜元素CU B、两个氢原子2H C、锌元素zN D、氯元素cl6. 下列各图中 和
和  分别表示不同元素的原子,则其中表示化合物的是( ) A、
分别表示不同元素的原子,则其中表示化合物的是( ) A、 B、
B、 C、
C、 D、
D、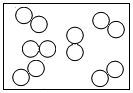 7. 对下列事实的解释,不合理的是( )A、水与过氧化氢化学性质不同——分子的构成不同 B、固体、液体不易被压缩——构成固体、液体的微粒之间间隔较小 C、水蒸发变成水蒸气——状态变化,分子大小随之变化 D、品红在热水中扩散更快——温度越高,分子运动速率越大8. 下图是处理汽车尾气的反应微观示意图,有关说法正确的是( )
7. 对下列事实的解释,不合理的是( )A、水与过氧化氢化学性质不同——分子的构成不同 B、固体、液体不易被压缩——构成固体、液体的微粒之间间隔较小 C、水蒸发变成水蒸气——状态变化,分子大小随之变化 D、品红在热水中扩散更快——温度越高,分子运动速率越大8. 下图是处理汽车尾气的反应微观示意图,有关说法正确的是( ) A、反应前后分子种类不变 B、反应前后均为纯净物 C、反应前后原子种类发生变化 D、该反应可以减少二氧化氮的排放9. 下列关于过氧化氢(H2O2)说法正确的是( )A、过氧化氢是由氢气和氧气混合而成的 B、过氧化氢分子是由氢、氧两种元素组成的 C、过氧化氢是由过氧化氢分子构成的 D、过氧化氢是由2个氢原子和2个氧原子构成的10. 一种有趣的钟表式元素周期表如图所示,关于时针所对应的元素说法正确的是( )
A、反应前后分子种类不变 B、反应前后均为纯净物 C、反应前后原子种类发生变化 D、该反应可以减少二氧化氮的排放9. 下列关于过氧化氢(H2O2)说法正确的是( )A、过氧化氢是由氢气和氧气混合而成的 B、过氧化氢分子是由氢、氧两种元素组成的 C、过氧化氢是由过氧化氢分子构成的 D、过氧化氢是由2个氢原子和2个氧原子构成的10. 一种有趣的钟表式元素周期表如图所示,关于时针所对应的元素说法正确的是( ) A、12:00对应的元素为非金属元素 B、2:00对应的元素化学性质不稳定 C、6:00对应元素的原子电子数为12 D、该钟表的整点时间数值与该元素的质子数目相等11. 下列说法正确的是( )A、带电的微粒都是离子 B、含有氧元素的化合物不一定是氧化物 C、物质的化学性质均由分子保持 D、仅含有一种元素的物质一定是单质12. 有关如图实验的说法正确的是( )
A、12:00对应的元素为非金属元素 B、2:00对应的元素化学性质不稳定 C、6:00对应元素的原子电子数为12 D、该钟表的整点时间数值与该元素的质子数目相等11. 下列说法正确的是( )A、带电的微粒都是离子 B、含有氧元素的化合物不一定是氧化物 C、物质的化学性质均由分子保持 D、仅含有一种元素的物质一定是单质12. 有关如图实验的说法正确的是( )
 A、两个实验都可证明水的组成 B、a、b管产生气体质量比约为1:2 C、点燃氢气前不用检验氢气的纯度 D、b管收集的气体能使带火星的木条复燃13. 下列关于过滤操作的叙述错误的是( )A、滤纸的边缘要低于漏斗口 B、液面不要低于滤纸的边缘 C、玻璃棒要靠在三层滤纸的一边 D、漏斗下端的管口要紧靠烧杯内壁14. 关于蜡烛燃烧的探究实验,下列有关说法正确的是( )A、熄灭后冒出的白烟是一种可燃性的气体 B、取刚清洗过的烧杯罩在蜡烛火焰上方,烧杯内有水珠出现,说明蜡烛燃烧产生水 C、燃烧后产生使澄清石灰水变浑浊的气体,说明蜡烛中含有二氧化碳 D、在密闭容器中,蜡烛燃烧一段时间后熄灭,说明物质燃烧通常需要氧气
A、两个实验都可证明水的组成 B、a、b管产生气体质量比约为1:2 C、点燃氢气前不用检验氢气的纯度 D、b管收集的气体能使带火星的木条复燃13. 下列关于过滤操作的叙述错误的是( )A、滤纸的边缘要低于漏斗口 B、液面不要低于滤纸的边缘 C、玻璃棒要靠在三层滤纸的一边 D、漏斗下端的管口要紧靠烧杯内壁14. 关于蜡烛燃烧的探究实验,下列有关说法正确的是( )A、熄灭后冒出的白烟是一种可燃性的气体 B、取刚清洗过的烧杯罩在蜡烛火焰上方,烧杯内有水珠出现,说明蜡烛燃烧产生水 C、燃烧后产生使澄清石灰水变浑浊的气体,说明蜡烛中含有二氧化碳 D、在密闭容器中,蜡烛燃烧一段时间后熄灭,说明物质燃烧通常需要氧气二、填空题
-
15. 根据图文回答问题。
 (1)、氧气经压缩能储存在钢瓶中是因为(从分子的角度回答);氧气能用于医疗急救是利用了氧气的(填“物理”或“化学”)性质。(2)、葡萄糖酸钙口服溶液可用于人体补钙。这里的“钙”是指(填“单质”、“元素”或“原子”),钙的符号为。(3)、氢燃料电池是将能转化为电能的装置,其优点是(填序号)。
(1)、氧气经压缩能储存在钢瓶中是因为(从分子的角度回答);氧气能用于医疗急救是利用了氧气的(填“物理”或“化学”)性质。(2)、葡萄糖酸钙口服溶液可用于人体补钙。这里的“钙”是指(填“单质”、“元素”或“原子”),钙的符号为。(3)、氢燃料电池是将能转化为电能的装置,其优点是(填序号)。a、产物是水,不污染环境b、使用氢能源成本低
(4)、直饮水机的工作原理如下图:
①“可直接饮用的水”属于(填“混合物”或“纯净物”)。取水样加入适量的肥皂水并振荡,可观察到 , 证明其为软水。
②自来水厂常用的方法处理水中的不溶物。图中炭罐的作用(填序号)。
a、过滤b、脱色除味c、消毒杀菌
16. 根据下图回答问题。 (1)、从A中可知,钨的相对原子质量是 , 属于元素(填“金属”或“非金属”)。(2)、B~E四种粒子中:
(1)、从A中可知,钨的相对原子质量是 , 属于元素(填“金属”或“非金属”)。(2)、B~E四种粒子中:①属于同种元素的是(填序号,下同);
②具有相对稳定结构的原子是;
③与B化学性质相似的是;
④属于阴离子的是。
(3)、图2是溴(Br)原子结构示意图,x=;通过对图1分析可知,溴元素位于元素周期表的第周期,它的离子符号为。

三、综合题
-
17. 实验室利用下图装置进行相关实验,请回答下列问题。
 (1)、写出图中标号仪器的名称 ① ;② 。(2)、装入药品前首先要进行的实验操作是。(3)、若用图A作为实验室制取氧气的发生装置,则反应的文字表达式为 , 该反应所属的基本反应类型为。要收集较纯的气体,收集装置应选择(填序号),收集完毕放置好气体后,紧接着要进行的正确操作是;若用该收集装置(气密性良好)收集到的氧气不纯,其可能原因是(写一点)。(4)、若实验室用过氧化氢溶液和二氧化锰制取氧气,应选择的发生装置是(填序号),二氧化锰在该反应中起作用。(5)、SO2是易溶于水、密度比空气大的有毒气体。若用Na2SO3固体与浓硫酸(液体)常温下反应制取SO2 , 可选用发生装置(填序号,下同),宜选用收集装置。18. 已知:氮气和氢气在高温、高压和催化剂的作用下,可以合成氨气。下图为工业合成氨的生产流程示意图。
(1)、写出图中标号仪器的名称 ① ;② 。(2)、装入药品前首先要进行的实验操作是。(3)、若用图A作为实验室制取氧气的发生装置,则反应的文字表达式为 , 该反应所属的基本反应类型为。要收集较纯的气体,收集装置应选择(填序号),收集完毕放置好气体后,紧接着要进行的正确操作是;若用该收集装置(气密性良好)收集到的氧气不纯,其可能原因是(写一点)。(4)、若实验室用过氧化氢溶液和二氧化锰制取氧气,应选择的发生装置是(填序号),二氧化锰在该反应中起作用。(5)、SO2是易溶于水、密度比空气大的有毒气体。若用Na2SO3固体与浓硫酸(液体)常温下反应制取SO2 , 可选用发生装置(填序号,下同),宜选用收集装置。18. 已知:氮气和氢气在高温、高压和催化剂的作用下,可以合成氨气。下图为工业合成氨的生产流程示意图。 (1)、过程①属于(填“物理”或“化学”)变化;过程②通电分解水得到氢气的文字表达式为。(2)、利用氮气和氢气合成的氨气的反应类型是反应;氨气中含有种元素。19. 下图表示几种常见物质的转化关系(反应条件己略去)。已知:A、B、C、D、E是单质,甲、乙、丙、丁是化合物;A的组成元素在地壳中含量最多;B、乙是黑色固体,D是淡黄色固体,丁是无色液体。请回答下列问题。
(1)、过程①属于(填“物理”或“化学”)变化;过程②通电分解水得到氢气的文字表达式为。(2)、利用氮气和氢气合成的氨气的反应类型是反应;氨气中含有种元素。19. 下图表示几种常见物质的转化关系(反应条件己略去)。已知:A、B、C、D、E是单质,甲、乙、丙、丁是化合物;A的组成元素在地壳中含量最多;B、乙是黑色固体,D是淡黄色固体,丁是无色液体。请回答下列问题。 (1)、写出对应物质的名称:甲、丁。(2)、A→丙反应的文字表达式。(3)、A→乙反应的实验现象。(4)、写出图中四个化学反应的共同点:(写一点)。20. 某化学兴趣小组拟对“测定空气中氧气含量”的实验进行进一步的探究。
(1)、写出对应物质的名称:甲、丁。(2)、A→丙反应的文字表达式。(3)、A→乙反应的实验现象。(4)、写出图中四个化学反应的共同点:(写一点)。20. 某化学兴趣小组拟对“测定空气中氧气含量”的实验进行进一步的探究。

 (1)、(实验回顾)
(1)、(实验回顾)图1是实验室测定空气中氧气含量的装置。红磷燃烧的主要现象是 , 反应的文字表达式为。
(2)、该实验的原理是:红磷燃烧消耗了瓶内空气中的氧气,使气体减少,压强减小,烧杯中的水倒吸进入瓶内,进入瓶内水的体积就是的体积;能否用木炭替代红磷?(填“能”或“否”)。(3)、将该装置与压强传感器相连接,测得集气瓶内气压的变化如图2所示。反应开始时,集气瓶内压强瞬间变大的原因主要是。(4)、(查阅资料)①红磷在空气中燃烧,当氧气含量(体积分数)低于7%时燃烧就无法继续进行。通过图1装置测得的结果与理论值相差较大。
②常温下,铁能与空气中的氧气、水发生氧化反应生成铁锈且反应放热。在有氯化钠、炭粉存在的条件下反应较快。
(提出问题)怎样才能较准确地测定空气中氧气的含量呢?
(实验改进)
根据铁生锈的原理,同学们设计了如下实验(如图3),再次测定空气中氧气的含量,主要实验步骤如下:
①用水量法测出集气瓶的容积约是320mL,然后在量筒里装入100mL水。
②将4g铁粉、5g炭粉混合均匀,再滴入适量的食盐溶液,制成耗氧物,装入布袋。
③按图3连好装置,关闭弹簧夹并将耗氧物放入瓶中充分反应,待后,打开弹簧夹,观察到 , 最终量筒中剩余水的体积是39mL。依据该方法测出空气中氧气的体积分数约是 (计算结果精确到 0.1%)。
(5)、(结论与交流)根据计算结果,(填“图1”或“图3”)的测定方法更准确,主要原因是。
(6)、为提高实验的准确性,以上两个实验都需要注意的事项是 (写一点)。(7)、食盐中的氯化钠由、(填粒子符号)构成。(8)、若按图3进行实验,下列观点有误的是______ (填序号)。A、在实验过程中,该反应是剧烈氧化 B、若证明实验后的耗氧物中还有铁,可用磁铁吸引 C、若将耗氧物均匀散布在集气瓶内壁上,可以加快实验进程 D、若考虑集气瓶里耗氧物等的体积,导管里空气的体积,实验结果会更准确