山东省淄博市张店区2020-2021学年九年级上学期化学期中考试试卷
试卷更新日期:2021-09-16 类型:期中考试
一、单选题
-
1. 能使紫色石蕊试液变红的是( )A、水 B、石灰水 C、食盐水 D、稀盐酸2. 下表列出了生活中一些常见的物质的pH,其中显碱性的是( )
食物
鸡蛋清
牛奶
葡萄汁
食醋
pH
7.6~8.0
6.3~6.6
3.5~4.5
2.4~3.0
A、鸡蛋清 B、牛奶 C、葡萄汁 D、食醋3. 下列化学用语表述正确的是( )A、2个硝酸根:2NO2 B、1个氯分子:Cl C、硫酸钾的化学式:K2SO4 D、铜离子:4. 下列关于溶液的叙述中,正确的是( )A、溶液一定是液态、无色的 B、溶液中一定含有水 C、溶液是均一、稳定的混合物 D、只有固体和液体可以作为溶质5. 下列物质露置于空气中,质量会减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠6. 下列实验操作正确的是( )A、测溶液的pH B、读取数据
B、读取数据  C、称量固体
C、称量固体  D、取用固体药品
D、取用固体药品  7. 一定温度下,把1g熟石灰加入到100g水中、振荡后发现仍有少许熟石灰未溶解,对于静置后得到的上层澄清溶液,下列说法中正确的是( )A、它不是饱和溶液 B、它是该温度下的饱和溶液 C、溶液的质量为101g D、它是浓溶液8. pH能定量描述溶液酸碱性的强弱。同学们对pH的含义有如下猜测,其中正确的是( )A、pH表示的是溶液中所含酸或碱的质量分数 B、pH与溶液中所含H+和OH-没有任何关系 C、pH与溶液中所含H+的数量成正比 D、pH大小与一定溶液中所含H+或OH-的数量多少有关9. 下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是( )A、Na2CO3溶液 B、MgCl2溶液 C、Ba(NO3)2溶液 D、酚酞溶液10. 20 ℃时,把36 g氯化钠放入64 g水中,使其充分溶解(20 ℃时氯化钠的溶解度为36 g)。对所得溶液的有关说法错误的是 ( )A、该溶液是饱和溶液 B、溶液中Na+和Cl-个数一定相等 C、溶液质量为100 g D、溶质与溶剂质量比为9∶2511. 含有下列离子的溶液中,溶质全部属于碱的是( )A、H+、Na+、 B、OH-、Na+、Ba+ C、K+、OH-、Cl- D、Ag+、Mg2+、12. 25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )
7. 一定温度下,把1g熟石灰加入到100g水中、振荡后发现仍有少许熟石灰未溶解,对于静置后得到的上层澄清溶液,下列说法中正确的是( )A、它不是饱和溶液 B、它是该温度下的饱和溶液 C、溶液的质量为101g D、它是浓溶液8. pH能定量描述溶液酸碱性的强弱。同学们对pH的含义有如下猜测,其中正确的是( )A、pH表示的是溶液中所含酸或碱的质量分数 B、pH与溶液中所含H+和OH-没有任何关系 C、pH与溶液中所含H+的数量成正比 D、pH大小与一定溶液中所含H+或OH-的数量多少有关9. 下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是( )A、Na2CO3溶液 B、MgCl2溶液 C、Ba(NO3)2溶液 D、酚酞溶液10. 20 ℃时,把36 g氯化钠放入64 g水中,使其充分溶解(20 ℃时氯化钠的溶解度为36 g)。对所得溶液的有关说法错误的是 ( )A、该溶液是饱和溶液 B、溶液中Na+和Cl-个数一定相等 C、溶液质量为100 g D、溶质与溶剂质量比为9∶2511. 含有下列离子的溶液中,溶质全部属于碱的是( )A、H+、Na+、 B、OH-、Na+、Ba+ C、K+、OH-、Cl- D、Ag+、Mg2+、12. 25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )编号
①
②
③
④
水的质量/g
50
50
50
50
加入固体质量/g
5
10
15
20
现象
固体完全溶解
固体完全溶解
剩余少量固体
剩余较多固体
A、实验①所得溶液质量分数为10% B、实验说明25℃时该物质的溶解度是20g C、实验③④所得溶液质量分数相同 D、实验④所得溶液中含溶质20g13. 将pH=10的氢氧化钠溶液加水稀释后,所得溶液的pH可能是( )A、6 B、8 C、11 D、1414. 如图为甲、乙两种固体在水中的溶解度曲线。下列说法正确的是() A、甲物质的溶解度比乙物质的大 B、t2℃时,ag甲溶于100g水形成甲的不饱和溶液 C、t1℃时,甲、乙的饱和溶液溶质的质量分数都是25% D、将t1℃时甲和乙的饱和溶液升温至t2℃,仍然都是饱和溶液15. 如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )
A、甲物质的溶解度比乙物质的大 B、t2℃时,ag甲溶于100g水形成甲的不饱和溶液 C、t1℃时,甲、乙的饱和溶液溶质的质量分数都是25% D、将t1℃时甲和乙的饱和溶液升温至t2℃,仍然都是饱和溶液15. 如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( ) A、反应后溶液的pH大于7 B、反应前两种溶液均能导电,反应后的溶液不导电 C、反应后溶液中微观粒子只有Na+和Cl- D、反应前后各元素的化合价均无变化16. 在20℃时,某固体物质(不含结晶水)的水溶液,经历如下变化
A、反应后溶液的pH大于7 B、反应前两种溶液均能导电,反应后的溶液不导电 C、反应后溶液中微观粒子只有Na+和Cl- D、反应前后各元素的化合价均无变化16. 在20℃时,某固体物质(不含结晶水)的水溶液,经历如下变化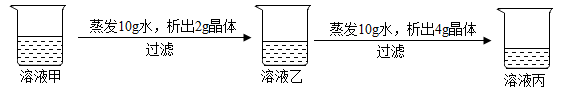
下列说法你认为正确的( )
A、溶液甲是饱和溶液 B、20℃时,该固体物质的溶解度是40g C、溶液丙若蒸发10g水,析出的晶体一定大于4g D、溶液乙溶质的质量分数小于溶液丙溶质的质量分数17. 下列图象能正确反映其对应关系的是( )A、向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系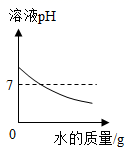 B、向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜的质量与加入稀盐酸质量的关系
B、向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜的质量与加入稀盐酸质量的关系  C、一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
C、一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系  D、向稀盐酸中滴加过量的氢氧化钠溶液,溶液pH的变化
D、向稀盐酸中滴加过量的氢氧化钠溶液,溶液pH的变化 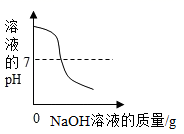 18. 推理是化学学习中常用的思维方法。下列推理正确的是( )A、酸能使紫色石蕊试液变红。通入CO2后的紫色石蕊试液变红,所以CO2是酸 B、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 C、酸与碱作用生成盐和水是中和反应,所以生成盐和水的反应一定是中和反应 D、酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7
18. 推理是化学学习中常用的思维方法。下列推理正确的是( )A、酸能使紫色石蕊试液变红。通入CO2后的紫色石蕊试液变红,所以CO2是酸 B、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 C、酸与碱作用生成盐和水是中和反应,所以生成盐和水的反应一定是中和反应 D、酸性溶液的pH小于7。食醋是酸性溶液,所以食醋的pH小于7二、填空题
-
19. 化学在生产、生活中有着广泛应用。现有①盐酸②熟石灰③烧碱④氯化钠,选择适当的物质填空。(填序号)(1)、改良酸性土壤的是;(2)、可除去铁锈的是;(3)、可用于配制生理盐水的是;(4)、溶于水放出大量热的是。20. 氯是一种重要的“成盐元素”,在海水、盐湖和盐矿中广泛存在。(1)、卤水点豆腐时常用到氯化镁,氯化镁的化学式为。(2)、构成氯化钙的基本微粒是离子,则钙离子的化学符号为。(3)、次氯酸钠(NaClO)溶液吸收二氧化硫可生成一种常见的酸,反应的化学方程式为:NaClO+SO2+H2O=NaCl+X,则X的化学式为。21. 氯化氢(HCl)是极易溶于水的无色气体,1体积水能够溶解500体积的氯化氢,其水溶液叫盐酸。
 (1)、在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是。(2)、向盛有碳酸钠粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是;发生反应的化学方程式是。(3)、在上图中画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注。(水分子不用画出)22. 硫酸、盐酸是重要的化工原料。(1)、浓硫酸在实验室常用作干燥剂,因为浓硫酸有性。(2)、用小木棍蘸少量浓硫酸,放置一会儿后,可观察到。(3)、写出稀硫酸与下列物质反应的化学方程式:
(1)、在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是。(2)、向盛有碳酸钠粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是;发生反应的化学方程式是。(3)、在上图中画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注。(水分子不用画出)22. 硫酸、盐酸是重要的化工原料。(1)、浓硫酸在实验室常用作干燥剂,因为浓硫酸有性。(2)、用小木棍蘸少量浓硫酸,放置一会儿后,可观察到。(3)、写出稀硫酸与下列物质反应的化学方程式:①与铁粉反应:;
②与氯化钡溶液反应:
(4)、盐酸的下列用途中,不能用硫酸代替盐酸的是。(填编号)①金属表面除锈 ②制造药物氯化锌 ③除去NaCl中的少量NaOH
23. 溶液与人类生产、生活密切相关。(1)、把少量下列物质分别放入水中,充分搅拌,能得到溶液的是______(填序号)。A、硝酸钾 B、植物油 C、面粉(2)、下列有关溶液的说法中,正确的是______(填序号)。A、凡是均一的、稳定的液体一定是溶液 B、溶液是均一的、稳定的混合物 C、溶液一定是无色的,且溶剂一定是水(3)、如图为甲、乙、丙三种固体物质的溶解度曲线。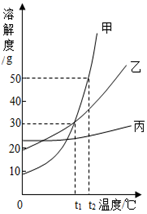
①t1℃时,甲、乙两种物质的溶解度。(填“相等”或“不相等”)
②t2℃时,甲物质饱和溶液中溶质与溶剂的质量比为。(填最简比)
③现有t1℃时甲、乙、丙三种物质的饱和溶液,将这三种溶液分别升温到t2℃,所得溶液中溶质质量分数大小关系是。(填序号)
A.甲>乙>丙 B.甲=乙<丙 C.甲=乙>丙
(4)、若用50g溶质质量分数为6%的氯化钠溶液配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为g。24. 现有如下药品:NaOH溶液、浓H2SO4、Na2CO3溶液、Mg条、酚酞试液、蒸馏水用来进行酸碱中和实验。请回答: (1)、实验时涉及如图所示的实验操作,其中正确的是。(填序号)(2)、小明进行酸碱中和实验:在一支试管中加入NaOH溶液,再向其中滴加稀硫酸,振荡,最后滴加2滴酚酞试液,振荡,溶液不变色。小明据此判断酸和碱恰好完全反应。
(1)、实验时涉及如图所示的实验操作,其中正确的是。(填序号)(2)、小明进行酸碱中和实验:在一支试管中加入NaOH溶液,再向其中滴加稀硫酸,振荡,最后滴加2滴酚酞试液,振荡,溶液不变色。小明据此判断酸和碱恰好完全反应。①反应的化学方程式为。
②小红认为小明的结论不一定正确,理由是。
③请在小明实验的基础上,选用提供的药品继续实验,判断酸和碱是否恰好完全反应,实验方案为。
(3)、实验结束后,废液处理方法正确的是______(填序号)。A、倒入下水道 B、倒入废液缸 C、带出实验室三、综合题
-
25. 从如图选择仪器,配制60g溶质质量分数为10%的NaCl溶液。其中配制溶液的基本步骤是:称取氯化钠固体一量取水一溶解一装瓶一贴标签。
 (1)、需要称量NaCl的质量为g。(2)、量取水用到的仪器有(写名称)。(3)、装瓶后贴标签,在标签上填写:。(4)、从配好的溶液中倒出10g,其中溶质和溶剂的质量比为:。(5)、配制氯化钠溶液时,下列操作会导致结果偏小的是______。
(1)、需要称量NaCl的质量为g。(2)、量取水用到的仪器有(写名称)。(3)、装瓶后贴标签,在标签上填写:。(4)、从配好的溶液中倒出10g,其中溶质和溶剂的质量比为:。(5)、配制氯化钠溶液时,下列操作会导致结果偏小的是______。①称量的氯化钠固体中含有不溶性杂质;②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A、①② B、①③ C、②④ D、③④26. “庄稼一枝花,全靠肥当家”。近年来,随着农业生产的不断发展,对硫酸镁(MgSO4)肥料的需求量逐年上升。以氧化镁矿粉(主要成分氧化镁,还含有少量氧化铁、烧碱等杂质)和浓硫酸为原料,生产MgSO4的部分生产流程如图1所示。已知氧化镁与硫酸发生反应的化学方程式为: 。分析制备过程,回答下列问题: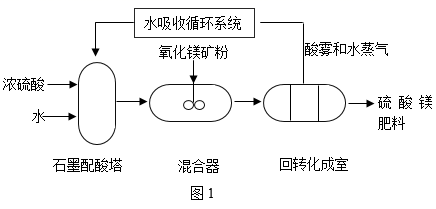
 (1)、图1中,石墨配酸塔由石墨制成,说明石墨具有的性质是(合理即可)。(2)、生产中,稀硫酸与杂质发生反应的化学方程式为:。(3)、回转化成室中发生的化学反应会(填“吸收热量”或“放出热量”)。(4)、分析图2,使用硫酸的最佳浓度为。(5)、生产过程无废物排放,符合绿色化学要求,其中可循环利用的物质是。
(1)、图1中,石墨配酸塔由石墨制成,说明石墨具有的性质是(合理即可)。(2)、生产中,稀硫酸与杂质发生反应的化学方程式为:。(3)、回转化成室中发生的化学反应会(填“吸收热量”或“放出热量”)。(4)、分析图2,使用硫酸的最佳浓度为。(5)、生产过程无废物排放,符合绿色化学要求,其中可循环利用的物质是。四、计算题
-
27. 某化学小组同学要测定某石灰石样品中碳酸钙的质量分数,进行如下实验:取25g石灰石样品放入烧杯,然后向里面逐滴加入一定质量、某溶质质量分数的稀盐酸,直至与样品充分反应(杂质不反应)。产生二氧化碳质量随反应时间的变化关系如图所示。请分析并完成下列问题:
 (1)、反应生成二氧化碳的质量是;(2)、从图中可看出,随着反应的进行,产生二氧化碳的速率越来越慢。请分析原因:;(3)、计算石灰石样品中碳酸钙的质量分数。
(1)、反应生成二氧化碳的质量是;(2)、从图中可看出,随着反应的进行,产生二氧化碳的速率越来越慢。请分析原因:;(3)、计算石灰石样品中碳酸钙的质量分数。