山东省日照市五莲县2020-2021学年高一上学期化学期中考试试卷
试卷更新日期:2021-09-09 类型:期中考试
一、单选题
-
1. 化学是一门充满神奇色彩而又非常实用的科学,下列叙述错误的是( )A、探索原子、分子的特征和行为,从而控制原子、分子之间的反应 B、分析自然界物质构成,以便在工厂中实现规模生产 C、漂白粉在空气中久置变质,是因为其中的CaCl2与空气中的CO2反应生成CaCO3 D、CCl4和钠在700℃时反应生成纳米级金刚石和另一种化合物,其可能是NaCl2. 顺铂是一种用于治疗癌症的药物,它的结构如下图所示。关于1 mol顺铂的下列说法中,正确的是( )
 A、含氮元素的质量为14g B、含铂原子的数目约为6.02×1024 C、含氯元素的质量为35.5g D、含氢原子的物质的量6 mol3. 下列有关钠、氯及其化合物的说法错误的是( )A、用KI-淀粉溶液可检验中HCl气体中是否混有Cl2 B、Na2CO3可用于制作膨松剂 C、钠在氯气中燃烧产生大量白烟 D、将Na放入CuSO4溶液中不会生成红色金属4. 用 NA 表示阿伏加德罗常数的数值,下列说法正确的是( )A、1 mol Cl2 与足量的铁反应转移的电子数是 2NA B、常温常压下 22.4 L HCl气体含有的分子数是NA C、0.1 mol • L-1 CuCl2 溶液中 Cl-数目是 0.2 NA D、32 gO2 中含有的原子数是NA5. 分类是科学研究的重要方法,下列物质分类错误的是( )A、化合物:干冰、冰水混合物、烧碱 B、同素异形体:石墨、C60、金刚石 C、非电解质:乙醇、四氯化碳、氯气 D、混合物:漂白粉、纯净矿泉水、盐酸6. 磁流体是电子材料的新秀,它是由直径为纳米量级(1到10 nm之间)的磁性固体颗粒、基载液以及界面活性剂三者混合而成的分散系,既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁流体的说法中错误的是( )A、纳米Fe3O4属于胶体 B、纳米Fe3O4磁流体可以通过半透膜得到提纯 C、当一束可见光通过该磁流体时会出现光亮的通路 D、纳米Fe3O4磁流体比较稳定7. 下列实验方案能够达到目的的是 ( )
A、含氮元素的质量为14g B、含铂原子的数目约为6.02×1024 C、含氯元素的质量为35.5g D、含氢原子的物质的量6 mol3. 下列有关钠、氯及其化合物的说法错误的是( )A、用KI-淀粉溶液可检验中HCl气体中是否混有Cl2 B、Na2CO3可用于制作膨松剂 C、钠在氯气中燃烧产生大量白烟 D、将Na放入CuSO4溶液中不会生成红色金属4. 用 NA 表示阿伏加德罗常数的数值,下列说法正确的是( )A、1 mol Cl2 与足量的铁反应转移的电子数是 2NA B、常温常压下 22.4 L HCl气体含有的分子数是NA C、0.1 mol • L-1 CuCl2 溶液中 Cl-数目是 0.2 NA D、32 gO2 中含有的原子数是NA5. 分类是科学研究的重要方法,下列物质分类错误的是( )A、化合物:干冰、冰水混合物、烧碱 B、同素异形体:石墨、C60、金刚石 C、非电解质:乙醇、四氯化碳、氯气 D、混合物:漂白粉、纯净矿泉水、盐酸6. 磁流体是电子材料的新秀,它是由直径为纳米量级(1到10 nm之间)的磁性固体颗粒、基载液以及界面活性剂三者混合而成的分散系,既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁流体的说法中错误的是( )A、纳米Fe3O4属于胶体 B、纳米Fe3O4磁流体可以通过半透膜得到提纯 C、当一束可见光通过该磁流体时会出现光亮的通路 D、纳米Fe3O4磁流体比较稳定7. 下列实验方案能够达到目的的是 ( )实验目的
实验方案
A
除去氯气中的水蒸气
将混合气体通过盛有碱石灰的干燥管
B
检验钠与H2O的反应产物NaOH
将绿豆粒大小的钠投入盛有适量水的培养皿中,加入稀盐酸
C
鉴别碳酸钠和碳酸氢钠溶液
向溶液中分别滴加稀盐酸
D
检验新制氯水中含有HClO
向新制氯水中加入少量CaCO3
A、A B、B C、C D、D8. 氢化钠(NaH)可在野外用作生氢剂,有关的化学反应原理为NaH+H2O=NaOH+H2↑。下列关于该反应的说法中正确的是( )A、NaH中H的化合价为+1 B、H2O是氧化剂,其中的氧元素被还原 C、NaH是还原剂,失去电子 D、转移1mol电子时生成11.2L(标况)H29. 同温同压下等质量的SO2气体和NO2气体,下列比较正确的是( )A、密度之比为32∶23 B、物质的量之比为23∶16 C、氧原子数之比为1∶1 D、体积之比为1∶110. 某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法正确的是( ) A、该实验说明Cl2分子具有漂白性 B、该实验说明H+扩散速度比HClO分子快 C、实验中pH试纸呈浅红色说明HClO为弱酸 D、若用久置的氯水进行实验,会产生相同的实验现象11. 下列叙述不涉及氧化还原反应的是( )A、过氧化钠在呼吸面具里作供氧剂 B、高炉炼铁 C、用澄清石灰水检验二氧化碳 D、电解氧化铝制备金属铝12. 在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是( )A、NaOH B、NaCl C、NaClO D、Na2CO313. 在含有大量Fe3+、H+、SO42—的溶液中还能大量共存的离子是( )A、Ba2+ B、OH- C、HCO D、NO14. 下列反应的离子方程式书写正确的是( )A、往碳酸镁中滴加稀盐酸:CO +2H+=H2O+CO2↑ B、CuO与稀盐酸反应:CuO+2H+=Cu2++H2O C、氢氧化钡溶液与稀H2SO4反应:Ba2++SO +H++OH-=BaSO4↓+H2O D、铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑15. 在0.2L由NaCl、MgCl2 、CaCl2组成的混合液中,部分离子浓度物质的量浓度大小如图所示,下列判断正确的是( )
A、该实验说明Cl2分子具有漂白性 B、该实验说明H+扩散速度比HClO分子快 C、实验中pH试纸呈浅红色说明HClO为弱酸 D、若用久置的氯水进行实验,会产生相同的实验现象11. 下列叙述不涉及氧化还原反应的是( )A、过氧化钠在呼吸面具里作供氧剂 B、高炉炼铁 C、用澄清石灰水检验二氧化碳 D、电解氧化铝制备金属铝12. 在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是( )A、NaOH B、NaCl C、NaClO D、Na2CO313. 在含有大量Fe3+、H+、SO42—的溶液中还能大量共存的离子是( )A、Ba2+ B、OH- C、HCO D、NO14. 下列反应的离子方程式书写正确的是( )A、往碳酸镁中滴加稀盐酸:CO +2H+=H2O+CO2↑ B、CuO与稀盐酸反应:CuO+2H+=Cu2++H2O C、氢氧化钡溶液与稀H2SO4反应:Ba2++SO +H++OH-=BaSO4↓+H2O D、铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑15. 在0.2L由NaCl、MgCl2 、CaCl2组成的混合液中,部分离子浓度物质的量浓度大小如图所示,下列判断正确的是( ) A、混合液中NaCl的物质的量为1.0mol B、将混合液加水稀释至1L,稀释后溶液中Ca2+的物质的量浓度为0.1mol·L-1 C、混合液中CaCl2的物质的量0.5mol D、混合液中MgCl2的质量为4.75g16. 某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2 , 则下列说法错误的是( )A、Cl2是该反应的氧化产物 B、氧化剂和还原剂的物质的量之比为1∶14 C、当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol D、由该反应可知还原性:HCl>CrCl317. 常温下20滴水为1mL,水的密度为1g/mL,每滴水含有a个水分子,则阿伏加德罗常数可表示为( )A、a B、2a C、18a D、360a18. 某氯化钾样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先 将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( )
A、混合液中NaCl的物质的量为1.0mol B、将混合液加水稀释至1L,稀释后溶液中Ca2+的物质的量浓度为0.1mol·L-1 C、混合液中CaCl2的物质的量0.5mol D、混合液中MgCl2的质量为4.75g16. 某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2 , 则下列说法错误的是( )A、Cl2是该反应的氧化产物 B、氧化剂和还原剂的物质的量之比为1∶14 C、当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol D、由该反应可知还原性:HCl>CrCl317. 常温下20滴水为1mL,水的密度为1g/mL,每滴水含有a个水分子,则阿伏加德罗常数可表示为( )A、a B、2a C、18a D、360a18. 某氯化钾样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先 将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( ) A、试剂Ⅰ是Ba(NO3)2溶液,试剂Ⅲ是HCl溶液 B、①②③的操作均为过滤 C、步骤②中加入试剂Ⅱ的目的是除去Ba2+ D、Y和Z中都含有BaSO419. 实验室配制500 mL0.2 mol·L-1的Na2CO3溶液,下列说法错误的是( )A、称量时,若将Na2CO3固体置于托盘天平右盘,将导致所配溶液浓度偏小 B、将Na2CO3固体置于烧杯中溶解,冷却后转移到容量瓶中 C、定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线 D、将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中20. 列关于氯气的实验装置能达到实验目的的是( )
A、试剂Ⅰ是Ba(NO3)2溶液,试剂Ⅲ是HCl溶液 B、①②③的操作均为过滤 C、步骤②中加入试剂Ⅱ的目的是除去Ba2+ D、Y和Z中都含有BaSO419. 实验室配制500 mL0.2 mol·L-1的Na2CO3溶液,下列说法错误的是( )A、称量时,若将Na2CO3固体置于托盘天平右盘,将导致所配溶液浓度偏小 B、将Na2CO3固体置于烧杯中溶解,冷却后转移到容量瓶中 C、定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线 D、将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中20. 列关于氯气的实验装置能达到实验目的的是( )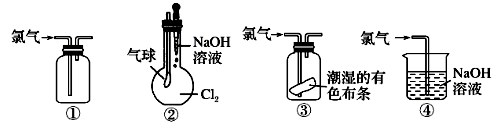
①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A、①② B、①③ C、②③ D、①④二、填空题
-
21. 根据所学知识填写下列空白。(1)、在标准状况下,1.7 g氨气与同条件下mol H2S含有相同的氢原子数。(2)、有8种物质①二氧化碳 ②氯气 ③碳酸氢钠 ④氯化氢 ⑤氨气 ⑥硫酸氢钠 ⑦稀硫酸 ⑧水。其中属于非电解质的是(填序号),写出物质⑥溶于水的电离方程式:。(3)、过氧化钠可用作制氧剂,写出过氧化钠与二氧化碳反应的化学方程式:。(4)、氮化铝(AlN)广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO,请用双线桥法在化学方程式上标出该反应中电子转移的方向和数目。22. 某化学课外小组用Cl2和NaOH固体制取84消毒液。请回答下列问题:(1)、制取84消毒液的离子方程式为。(2)、制取时需要0.4 mol·L-1的NaOH溶液450mL,配制时用托盘天平称量NaOH固体的质量为 , 配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、。(3)、该消毒液也可用于漂白,为增强漂白性向消毒液中滴加几滴稀盐酸,写出化学反应方程式:。(4)、该消毒液在空气中久置后,NaClO会转化为HClO,HClO分解失效,某同学向溶液中滴加紫色石蕊试液,出现现象,证明消毒液已失效。
三、综合题
-
23. 某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:

已知:几种盐的溶解度
物质
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度
36.0
21.7
9.6
37.2
(1)、①写出装置I中反应的化学方程式。②操作①的名称是。
(2)、写出装置II中发生反应的化学方程式。(3)、该流程中可循环利用的物质是。(填化学式)(4)、用该纯碱配制的溶液中可能含有Cl- , 请设计实验检验含有Cl-:。24. 某同学通过查阅资料得知,常温下KClO3和浓盐酸可以制备氯气。为此该同学和小组其他同学利用如图装置在实验室制取Cl2并探究其有关性质: (1)、装置A中存在一处不正确,改正这处不正确:。(2)、配平装置A中发生反应的化学方程式:KClO3+HCl(浓) =KCl+Cl2↑+H2O。(3)、为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入。(填试剂名称),为了探究有色布条褪色的原理,需再添加装置E,其中加入浓硫酸,在整套装置中的添加位置为(填序号)。
(1)、装置A中存在一处不正确,改正这处不正确:。(2)、配平装置A中发生反应的化学方程式:KClO3+HCl(浓) =KCl+Cl2↑+H2O。(3)、为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入。(填试剂名称),为了探究有色布条褪色的原理,需再添加装置E,其中加入浓硫酸,在整套装置中的添加位置为(填序号)。a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
(4)、将氯气通入冷的石灰乳中,即可制得以(填化学式)为有效成分的漂白粉,发生反应的化学方程式为。(5)、有同学认为,上述装置还有另外一处的缺陷,并给出了改进措施。该改进措施是。