河南省洛阳市2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2021-09-09 类型:期中考试
一、单选题
-
1. 下列关于能源的说法错误的是( )A、地球上最基本的能源是太阳能 B、氢气是重要的绿色能源,贮氢金属、薄膜金属氢化物、某些无机物和某些有机液体氢化物等材料的发展,为解决氢气的贮存问题指明了方向 C、利用植物的秸秆等制沼气、利用玉米制乙醇、使用太阳能热水器、利用生活垃圾发电等过程都涉及了生物质能的利用 D、化石燃料仍是目前世界上能源的最主要来源2. 下列变化过程,属于放热反应的是( )
①金属钠与水 ②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌 ③H2在Cl2中燃烧 ④液态水变成水蒸气 ⑤酸碱中和 ⑥碳酸钙热分解
A、①②⑤ B、①③⑤ C、③④⑤ D、②④⑥3. 海洋面积占地球表面积的71%,海水中主要含有Na+、K+、Ca2+、Cl-、 、Br-、 、 等离子,下列说法正确的是( )A、海水呈弱酸性 B、冬天时海水的pH会升高 C、海水中的Ca2+、 有利于海洋生物形成介壳 D、海水的自然淡化过程涉及物理变化和化学变化4. 下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )A、向溴水中加入AgNO3溶液后,溶液颜色变浅 B、铁在潮湿的空气中易生锈 C、合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 D、热的纯碱溶液比冷的纯碱溶液洗条油污效果更好5. 常温下,将0.1 mol·L─1盐酸溶液与0.06 mol·L─1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )A、1.7 B、2.0 C、12.0 D、12.46. CH3COOH溶液是实验室常用的试剂,下列说法不能说明CH3COOH是弱电解质的是( )A、常温下,用CH3COOH溶液进行导电性实验,灯泡很暗 B、常温下,测得0.1 mol·L-1CH3COOH溶液的pH=4 C、常温下,将pH=1的CH3COOH溶液稀释1000倍,测得pH<4 D、常温下,测得CH3COONa溶液的pH>77. 一定温度下H2(g)与I2(g)反应,生成HI(g),反应的能量变化如图所示。对下对该反应体系的描述中,正确的是( ) A、该反应正反应的活化能大于逆反应的活化能 B、反应物的总能量比生成物的总能量低13 kJ C、反应物化学键中储存的总能量比生成物化学键中储存的总能量低 D、从图中可知氢气的燃烧热为13 kJ/mol8. 煤焦与水蒸气的反应是煤气化过程中的主要反应之一,C(s)+H2O(g) CO(g)+H2(g)。已知:该反应为吸热反应,K(700℃)=0.2,若该反应在恒温(700℃)、恒容的密闭容器中进行,700℃测得的下列数据中,可以作为判断t时刻反应是否达到平衡状态的依据是( )A、t时刻,容器的压强 B、t时刻,H2O(g)、CO(g)、H2(g)的浓度 C、t时刻,消耗 H2O(g)的速率与生成CO(g)的速率 D、t时刻,气体的平均摩尔质量9. 下列说法中错误的是( )A、凡是放热反应而且熵增加的反应,就更易自发进行 B、对于同一物质在不同状态时的熵值是:气态>液态>固态 C、平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大 D、凡是能量达到活化能的分子发生的碰撞均为有效碰撞10. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、无色透明的溶液:Na+、Cu2+、 、 B、 的溶液: 、Ca2+、Cl-、 C、c(Fe2+)=1mol·L-1的溶液:K+、 、 、 D、水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、 、11. 已知断开1 mol Cl2(g)中Cl-Cl键需要吸收243 kJ能量。根据能量变化示意图,下列说法或热化学方程式正确的是( )
A、该反应正反应的活化能大于逆反应的活化能 B、反应物的总能量比生成物的总能量低13 kJ C、反应物化学键中储存的总能量比生成物化学键中储存的总能量低 D、从图中可知氢气的燃烧热为13 kJ/mol8. 煤焦与水蒸气的反应是煤气化过程中的主要反应之一,C(s)+H2O(g) CO(g)+H2(g)。已知:该反应为吸热反应,K(700℃)=0.2,若该反应在恒温(700℃)、恒容的密闭容器中进行,700℃测得的下列数据中,可以作为判断t时刻反应是否达到平衡状态的依据是( )A、t时刻,容器的压强 B、t时刻,H2O(g)、CO(g)、H2(g)的浓度 C、t时刻,消耗 H2O(g)的速率与生成CO(g)的速率 D、t时刻,气体的平均摩尔质量9. 下列说法中错误的是( )A、凡是放热反应而且熵增加的反应,就更易自发进行 B、对于同一物质在不同状态时的熵值是:气态>液态>固态 C、平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大 D、凡是能量达到活化能的分子发生的碰撞均为有效碰撞10. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、无色透明的溶液:Na+、Cu2+、 、 B、 的溶液: 、Ca2+、Cl-、 C、c(Fe2+)=1mol·L-1的溶液:K+、 、 、 D、水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、 、11. 已知断开1 mol Cl2(g)中Cl-Cl键需要吸收243 kJ能量。根据能量变化示意图,下列说法或热化学方程式正确的是( ) A、H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol-1 B、生成1 mol H2(g)中的H-H键放出121.5 kJ能量 C、断开1 mol HCl(g)中的H-Cl键要吸收864 kJ能量 D、HCl(g)= H2(g)+ Cl2(g) △H=-92.5 kJ·mol-112. 0.2 mol·L-1的NaOH溶液与0.4 mol·L-1的NH4NO3溶液等体积混合并加热使NH3全部逸出,溶液中各离子的物质的量浓度大小关系正确的是( )A、c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) B、c(Na+)>c(NH4+)>c(NO3-)>c(OH-)>c(H+) C、c(NO3-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) D、c(NO3-)>c(Na+)>c(NH4+)>c(H+)>c(OH-)13. 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。
A、H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol-1 B、生成1 mol H2(g)中的H-H键放出121.5 kJ能量 C、断开1 mol HCl(g)中的H-Cl键要吸收864 kJ能量 D、HCl(g)= H2(g)+ Cl2(g) △H=-92.5 kJ·mol-112. 0.2 mol·L-1的NaOH溶液与0.4 mol·L-1的NH4NO3溶液等体积混合并加热使NH3全部逸出,溶液中各离子的物质的量浓度大小关系正确的是( )A、c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) B、c(Na+)>c(NH4+)>c(NO3-)>c(OH-)>c(H+) C、c(NO3-)>c(NH4+)>c(Na+)>c(H+)>c(OH-) D、c(NO3-)>c(Na+)>c(NH4+)>c(H+)>c(OH-)13. 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。
根据以上规律判断,下列结论正确的是( )
A、反应Ⅰ:ΔH>0,p2>p1 B、反应Ⅱ:ΔH<0,T1<T2 C、反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1 D、反应Ⅳ:ΔH<0,T2>T114. 下列说法正确的是( )A、在相同温度下,反应CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) 比反应CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) 的反应热大 B、在相同条件下,反应C2H4(g)+H2(g) = C2H6(g)和反应C3H6(g)+H2(g) = C3H8(g)释放的能量几乎相等 C、常温下,稀H2SO4和稀Ba(OH)2溶液反应生成1mol H2O,放出57.3kJ 的热量 D、“可燃冰”(化学组成为CH4·nH2O)是将水变为油的新型燃料15. 在557℃密闭容器中进行反应:CO(g)+H2O(g) CO2(g)+H2(g)。若CO起始浓度为2.0 mol·L-1 , 水蒸气起始浓度为3.0 mol·L-1 , 达到平衡后,测得CO2浓度为1.2 mol·L-1 , 下列说法错误的是( )A、该反应达到平衡状态时,CO的转化率为60% B、557℃时,该反应的平衡常数K=1 C、反应达到平衡时,再充入1.0molCO和1.5 molH2O(g),达到新的平衡时,CO2体积分数与原平衡相同 D、若以1.0mol/LCO(g),1.5mol/LH2O(g),0.5mol/LCO2(g),0.5mol/LH2(g)为起始浓度,平衡逆向进行16. 某学生用0.1023mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸,测定中使用耐酸、碱和强氧化剂腐蚀的“特氟龙”旋钮的滴定管。其操作可分解为如下几步:①移取20.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入3滴酚酞溶液
②用标准氢氧化钠溶液润洗滴定管3次
③把盛有标准氢氧化钠溶液的滴定管固定好,调节滴定管尖嘴使之充满溶液
④取标准氢氧化钠溶液注入滴定管至“0”刻度以上约2mL
⑤调节液面至“0”或“0”刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
下列有关上述中和滴定操作步骤的正确顺序是( )
A、①②③④⑤⑥ B、②④③⑤①⑥ C、③①②⑥④⑤ D、⑤①②③④⑥17. 常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( ) A、HA为弱酸 B、在N到K间任意一点对应的溶液中:c(M+)+c(H+) = c(OHˉ)+c(Aˉ) C、K点对应的溶液中:c(M+)+c(MOH)=c(Aˉ) D、常温下,MA溶液的pH>718. 下列实验操作、现象及根据现象得出的结论,都正确的是( )
A、HA为弱酸 B、在N到K间任意一点对应的溶液中:c(M+)+c(H+) = c(OHˉ)+c(Aˉ) C、K点对应的溶液中:c(M+)+c(MOH)=c(Aˉ) D、常温下,MA溶液的pH>718. 下列实验操作、现象及根据现象得出的结论,都正确的是( )选项
实验操作
实验现象
结论
A
用食醋浸泡水垢,[水垢主要成分:CaCO3与Mg(OH)2]
水垢溶解,有无色气泡产生
碱性:CH3COONa>Na2CO3
B
向浓度均为0.1mol/L的NaCl和NaI混合溶液中滴加少量AgNO3溶液
先出现黄色沉淀
Ksp(AgI)>Ksp(AgCl)
C
向CH3COONa溶液中滴加酚酞,加热
溶液红色加深
水解是吸热过程
D
用广范pH试纸测定新制氯水的pH
pH=3.0
氯水呈酸性
A、A B、B C、C D、D19. 高铁酸钾 (K2FeO4)是一种优良的水处理剂,将其溶于水中缓慢发生发应 4FeO42-+10H2O 4Fe (OH)3+8OH -+3O2↑。在 pH=4.7 的溶液中,配成 c (K2FeO4)=1.0×10-3mol·L-1 试样,分别置于 20-60℃的恒 温水浴中,测定 K2FeO4 总量的变化如图,纵坐标为试样的浓度, 则下列说法错误的是( )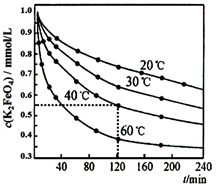 A、试样溶液的酸性越强,K2FeO4 越不稳定 B、40℃时,在 0~120 min 内,K2FeO4 的分解速率为3.75×10-3 mol·Lˉ1·minˉ1 C、由图可知,反应体系温度越高,分解速率越快 D、当分解足够长时间后,四份试样的分解率相等20. 下列有关说法正确的是( )A、CaCO3(s) =CaO(s)+CO2(g) 在室温下不能自发进行,说明该反应 H<0 B、水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 C、0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应 D、蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
A、试样溶液的酸性越强,K2FeO4 越不稳定 B、40℃时,在 0~120 min 内,K2FeO4 的分解速率为3.75×10-3 mol·Lˉ1·minˉ1 C、由图可知,反应体系温度越高,分解速率越快 D、当分解足够长时间后,四份试样的分解率相等20. 下列有关说法正确的是( )A、CaCO3(s) =CaO(s)+CO2(g) 在室温下不能自发进行,说明该反应 H<0 B、水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 C、0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应 D、蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体二、综合题
-
21. 工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:(1)、为除去溶液中的Fe2+ , 可先加入 , (从下面四个选项选择)将Fe2+氧化为Fe3+ , 反应的离子方程式为 , 然后加入适量的 , (从下面四个选项选择)调整溶液的pH为 , 使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)、甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38 , Cu(OH)2的溶度积Ksp=3×10-20 , 通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1 , 则Cu(OH)2开始沉淀时溶液的pH为 , Fe3+完全沉淀时溶液的pH为 , 通过计算确定上述方案 (填“可行”或“不可行”)。22. 滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。(1)、I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图象分析:
HCl溶液的浓度是;NaOH溶液的浓度是;
(2)、x =。(3)、ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,滴定的实验数据如下所示:
实验编号
待测血液的体积/mL
滴入KMnO4溶液的体积/mL
1
20.00
11.95
2
20.00
13.00
3
20.00
12.05
①滴定时,盛放高锰酸钾溶液的仪器名称为确定反应达到终点的现象。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2 + 5H2C2O4 + 6H+ ═ 2Mn2+ + 10CO2↑ + 8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为mg/cm3
23. 研究大气中含硫化合物(主要是SO2和H2S)的转化率具有重要意义。(1)、土壤中的微生物可将大气中的H2S经两步反应氧化成 ,两步反应的能量变化示意图如下:
1 mol H2S(g) 全部氧化成 (aq) 的热化学方程式为。
(2)、SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2 L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+ O2(g) 2SO3(g),ΔH = −196 kJ·mol−1 , 过程中测定的部分数据见表:时间/min
n(SO2)/mol
n(O2)/mol
0
0.10
0.050
4
0.050
0.025
5
0.040
8
0.020
①反应在0~4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K = ;
③研究表明,SO2催化氧化的反应速率方程为:v = k( −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v ~ t曲线,如图所示。

曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。下列说法正确的是
A.v达到最大值时,SO2平衡转化率α最大
B.t < tm时,v逐渐提高,原因是升高温度,k逐渐增大
C.t > tm后,v逐渐下降,原因是升高温度,α逐渐降低
D.温度是影响反应速率的主要因素,温度越高,反应速率越快
(3)、将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示:
①该循环过程中 Fe3+起的作用是:
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:CuS:Ksp=6.3×10﹣36; H2S:Ka1=1.0×10﹣7 , Ka2=7.0×10﹣15 , 计算反应CuS(s)+ 2H+(aq)= Cu2+(aq)+ H2S(aq)反应的平衡常数K= , 则该反应进行(填“难”、“易”)。
24. 研究电解质在水溶液中的平衡能了解它的存在形式。(1)、已知部分弱酸的电离常数如下表:弱酸
HF
CH3COOH
H2CO3
H2S
电离平衡常数(25℃)
Ka=7.2×10-4
Ka=1.75×10-5
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=9.1×10-8
Ka2=1.1×10-12
①写出H2S的Ka1的表达式:。
②常温下,浓度相同的三种溶液NaF、Na2CO3、CH3COONa,pH由大到小的顺序是。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是。
(2)、室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.100 mol·L-1的氨水溶液,滴定曲线如图所示。
(忽略溶液体积的变化,①②填“>”“<”或“=”)
①a点所示的溶液中c (NH3·H2O)c (Cl-)。
②b点所示的溶液中c (Cl-)c (NH )。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c (H+)之比为。
(3)、雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH 关系如下图所示:
①人体血液的pH在7.35 -7.45之间,用药后人体中含砷元素的主要微粒是 。
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11 时发生反应的离子方程式是。
③下列说法正确的是(填字母序号)
a.n(H3AsO3)∶n(H2AsO )=1∶1时,溶液显碱性
b.pH=12时,溶液中c(H2AsO )+2c(HAsO )+3c(AsO )+c(OH-)=c(H+)
c.在K3AsO3溶液中,c(AsO )>c(HAsO )>c(H2AsO )