江苏扬州市2020-2021学年高三上学期化学期中考试试卷
试卷更新日期:2021-09-02 类型:期中考试
一、单选题
-
1. 北宋沈括《梦溪笔谈》中记载:“信州铅山县有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )A、胆矾能溶于水 B、胆矾受热不分解 C、“熬之则成胆矾”包含蒸发浓缩、结晶 D、胆矾溶液能与铁发生置换反应2. 磷的氢化物有 、 等。 能和碱反应生成 , 。下列说法正确的是( )A、PH3的沸点比 的高 B、 中只含离子键 C、 分子的结构式:
 D、 分子的电子式:
D、 分子的电子式:  3. 下列有关钠及其化合物的性质与用途具有对应关系的是( )A、Na易与 应,可用作高压钠灯 B、 受热易分解,可用作抗酸药 C、 具有漂白性,可用作供氧剂 D、 溶液显碱性,可用于清洗油污4. 下列实验操作能达到实验目的的是( )
3. 下列有关钠及其化合物的性质与用途具有对应关系的是( )A、Na易与 应,可用作高压钠灯 B、 受热易分解,可用作抗酸药 C、 具有漂白性,可用作供氧剂 D、 溶液显碱性,可用于清洗油污4. 下列实验操作能达到实验目的的是( ) A、用如图仪器和98%的硫酸( )配制60mL约 溶液 B、向热的 溶液中滴加2滴饱和 溶液,可制得 胶体 C、向2%稀氨水中滴加过量的2% 溶液,可以配成银氨溶液 D、用玻璃棒蘸取 溶液点在湿润的pH试纸上,测定该溶液的pH5. 为探究 的性质,向 溶液中分别滴加少量试剂X。
A、用如图仪器和98%的硫酸( )配制60mL约 溶液 B、向热的 溶液中滴加2滴饱和 溶液,可制得 胶体 C、向2%稀氨水中滴加过量的2% 溶液,可以配成银氨溶液 D、用玻璃棒蘸取 溶液点在湿润的pH试纸上,测定该溶液的pH5. 为探究 的性质,向 溶液中分别滴加少量试剂X。实验序号
实验装置
试剂X
实验现象
①

酸性 溶液(橙色)
溶液由无色变为绿色
②
稀硫酸
无明显现象
③
稀溶液
出现白色浑浊
④
酚酞试液
溶液由无色变为红色
由上述实验现象不能得出的结论是( )
A、 、 、 不能大量共存 B、 、 能大量共存 C、 、 不能大量共存 D、 水解呈碱性:6. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列有关化学反应的叙述正确的是( ) A、[O]表示还原剂 B、 能与 反应生成 和NO C、 能与 溶液反应生成 D、物质X一定为7. 下列说法正确的是( )A、常温下,向稀醋酸溶液中缓慢通入少量 ,溶液中 值增大 B、工业合成氨 ,为提高 产率,选择较低温度下进行 C、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 D、电解精炼铜时,阳极泥中含有Zn、Ag、Au等金属单质8. 、 、 都具有杀菌消毒的作用。 溶液、NaClO溶液分别与浓盐酸混合反应都能生成 ,下列关于K、Na、S、Cl、O元素及其化合物的说法正确的是( )A、酸性: B、碱性: C、原子半径r: D、稳定性:9. 下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、10. 化合物Y是一种药物中间体,可由X制得。下列有关化合物X、Y的说法正确的是( )
A、[O]表示还原剂 B、 能与 反应生成 和NO C、 能与 溶液反应生成 D、物质X一定为7. 下列说法正确的是( )A、常温下,向稀醋酸溶液中缓慢通入少量 ,溶液中 值增大 B、工业合成氨 ,为提高 产率,选择较低温度下进行 C、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 D、电解精炼铜时,阳极泥中含有Zn、Ag、Au等金属单质8. 、 、 都具有杀菌消毒的作用。 溶液、NaClO溶液分别与浓盐酸混合反应都能生成 ,下列关于K、Na、S、Cl、O元素及其化合物的说法正确的是( )A、酸性: B、碱性: C、原子半径r: D、稳定性:9. 下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、10. 化合物Y是一种药物中间体,可由X制得。下列有关化合物X、Y的说法正确的是( ) A、1molX最多能与3mol 反应 B、Y分子中所有碳原子可能处于同一平面 C、用 溶液可以区分X、Y D、X、Y分子中手性碳原子数目不相等
A、1molX最多能与3mol 反应 B、Y分子中所有碳原子可能处于同一平面 C、用 溶液可以区分X、Y D、X、Y分子中手性碳原子数目不相等二、多选题
-
11. 根据下列实验操作和现象所得出的结论一定正确的是( )
选项
实验操作和现象
结论
A
将燃着的镁条迅速伸入集满CO2的集气瓶,剧烈反应,发光发热,瓶内产生大量白烟,瓶壁上有黑色颗粒
CO2在一定条件下能支持燃烧
B
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
C
室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色
Fe3+的氧化性比I2的强
D
将少量铁粉、5mL苯和1mL液溴混合后产生的气体通入AgNO3溶液中,产生淡黄色沉淀
苯和液溴发生了取代反应
A、A B、B C、C D、D12. 室温时,Ka1(H2C2O4)=5.4×10-2 , Ka2(H2C2O4)=5.4×10-5。下列指定溶液中微粒物质的量浓度关系正确的是( )A、0.1mol/L H2C2O4溶液:c(H+)>c(HC2O )>c(C2O ) B、0.1mol/L NaHC2O4溶液:c(C2O )>c(HC2O )>c(H2C2O4) C、0.1mol/L Na2C2O4溶液:c(OH-)-c(H+)=2c(H2C2O4)+ c(HC2O ) D、0.1mol/L NaHC2O4溶液和0.1mol/L Na2C2O4溶液等体积混合:c(HC2O )+2 c(C2O )<0.15mol/L13. 将一定量的 与 通入某密闭容器中合成甲醇,在催化剂作用下发生下述反应:Ⅰ.
Ⅱ.
催化反应相同时间,测得不同温度下 的转化率如图1所示(图中虚线表示相同条件下 的平衡转化率随温度的变化), 的产率如图2所示。

下列有关说法正确的是( )
A、 B、250℃时,容器内反应达平衡 C、250℃前,随着温度升高, 的平衡转化率减小,是因为该温度范围内仅发生反应Ⅰ D、250℃后,随着温度升高, 的产率减小,可能是因为催化剂对反应Ⅰ的活性降低三、综合题
-
14. 含氯化合物广泛用作水处理剂及漂白剂等。
已知:25℃时NaClO溶液中HClO、 的物质的量分数随pH的分布如下图所示。
 (1)、工业上将Cl2通入 的NaOH溶液中制备NaClO。
(1)、工业上将Cl2通入 的NaOH溶液中制备NaClO。①该反应的离子方程式为;
②当溶液 时,该溶液中主要存在的阴离子有(填化学式);
③25℃时,反应 的平衡常数K=(填数值)。
(2)、工业常用石灰乳和 反应制取漂白粉,反应放热,温度过高时会发生副反应生成 。反应过程中缓缓通入Cl2的目的是。(3)、实验室将Cl2通入含水8%的 固体中可制备Cl2O,生成的气体仅为Cl2O,该反应的化学方程式为。15. 储氢材料、燃料电池等方面具有重要应用。(1)、 中H元素的化合价为 ,具有强还原性,一定条件下,向 溶液中滴加碱性 溶液,溶液中 与 反应生成纳米铁粉、 和 ,参加反应的 与生成的纳米铁粉的物质的量之比为。(2)、 燃料电池中, 转化为 ,电解 溶液又可制得 ,实现物质的循环利用,电解装置示意图如图所示。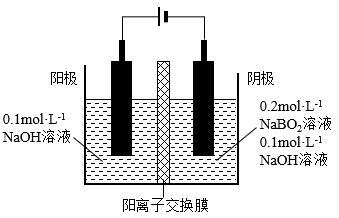
①电解池阴极的电极反应式为。
②两电极区间使用阳离子交换膜,不允许阴离子通过的原因是。
(3)、 催化释氢。在催化剂作用下, 与水反应生成 ,可能的反应机理如图所示。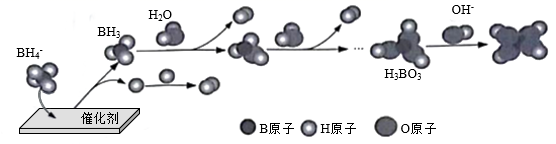
①其他条件不变时,以 代替 催化释氢,所得气体的分子式为。
②已知: 为一元弱酸, 水溶液呈酸性的原因是(用离子方式表示)。
(4)、在催化剂的作用下, 与水反应,释氢体积及温度随反应时间的变化如图所示。
①0~20min内,温度随时间快速升高的原因是。
②20min后,氢气体积在增加,而温度却下降的原因是。
16. 化合物G是合成某种抗精神病药物的重要中间体,其合成路线如下: (1)、E中的含氧官能团名称为。(2)、C→D的反应类型为。(3)、已知R—NH2+F—R′→RNH—R′+HF,G在一定条件下能反应生成H(分子式为 ),H的结构简式为。(4)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。
(1)、E中的含氧官能团名称为。(2)、C→D的反应类型为。(3)、已知R—NH2+F—R′→RNH—R′+HF,G在一定条件下能反应生成H(分子式为 ),H的结构简式为。(4)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。①有一个六元环,该六元环含一个О原子和一个N原子。
②能发生银镜反应。
③核磁共振氢谱有四组峰,峰面积之比为6∶4∶2∶1。
(5)、已知:RCOCl+R′NH2→ ;
; 
①设计A→B步骤的目的是。
②写出以
 和
和  为原料制备
为原料制备  的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。17. 工业生产中常常需要对混合气体中的 ,含量进行测定,其中一种方法的操作如下:
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。17. 工业生产中常常需要对混合气体中的 ,含量进行测定,其中一种方法的操作如下:①将0.200 气样通入酸化的 溶液中,使 完全被氧化为 ;(气样中的其它气体不参与反应),加水稀释至100.00mL;
②微热,除去过量的 ;
③量取20.00mL该溶液,加入20.00mL 溶液,充分反应;
④用 溶液滴定剩余的 ,终点时消耗 溶液20.00mL,
已知: (未配平);
(未配平)
(1)、若 主要为NO,写出NO被 氧化为 的离子方程式。(2)、若气体中仅含 、NO和 ,由于发生反应 ,气体中也存在一定量的 以 表示该混合气体的组成,增大压强时,x的值将(填“增大”“不变”或”减小”)。(3)、若缺少步骤②,混合气体中 含量的测定结果将(填“偏大”“偏小”或“无影响”)。(4)、气样中 中N的含量为 。(保留3位有效数字,写出计算过程)18. 实验室合成三苯基膦(C6H5)3P,并从反应后的废渣中获取MgCl2∙6H2O。(1)、I.合成三苯基膦(C6H5)3P反应装置如图所示(夹持仪器已略去)。先向三颈烧瓶中加入氯苯和溶剂(四氢呋喃),然后加入镁屑,反应制得C6H5MgCl;再从滴液漏斗中缓慢加入PCl3 , 控制反应温度在40~50℃。

相关物质的部分性质如下表:
物质
熔点/℃
沸点/℃
部分性质
三苯基膦
78.5
377
与水剧烈反应
四氢呋喃
−108.5
65.4
对环境有污染
三氯化磷
−111.8
76
与水剧烈反应
装置中仪器A的名称为。与普通分液漏斗比较,使用恒压滴液漏斗的优点是:使漏斗内液体顺利滴下、。
(2)、实验宜使用的加热方法为。(3)、II.获取MgCl2∙6H2O提取(C6H5)3P后的废渣中含MgCl2、四氢呋喃、(C6H5)3P等。以该废渣为原料,获取MgCl2∙6H2O的主要实验流程如下:

其他条件相同时,水浸相同时间,水浸温度与MgCl2∙6H2O获取率关系如下图所示,分析曲线在不同温度段趋势变化的原因:A→B段;D→E段。
 (4)、过滤后得到的滤液中主要含MgCl2、四氢呋喃。结晶温度与MgCl2∙6H2O回收率的关系如下图所示。补充完整获取MgCl2∙6H2O的实验方案:取酸浸后滤液,。
(4)、过滤后得到的滤液中主要含MgCl2、四氢呋喃。结晶温度与MgCl2∙6H2O回收率的关系如下图所示。补充完整获取MgCl2∙6H2O的实验方案:取酸浸后滤液,。