江苏省盐城市2020-2021学年高三上学期化学期中考试试卷
试卷更新日期:2021-09-02 类型:期中考试
一、单选题
-
1. 绿色化学助力可持续发展。下列不属于绿色化学范畴的是( )A、利用二氧化碳和环氧化合物合成可生物降解塑料 B、开发光、电催化技术用H2O和O2直接合成H2O2 C、推进大气污染治理、固体废物处置和资源化利用 D、发展用水代替有机溶剂作为物质制备的分散介质2. 制取肼的反应为2NH3+NaClO=N2H4+NaCl+H2O,下列相关微粒的化学用语错误的是( )A、中子数为12的钠原子: Na B、NaClO的电子式:
 C、Cl-的结构示意图:
C、Cl-的结构示意图:  D、N2H4的结构式:
D、N2H4的结构式:  3. 下列有关物质的性质与用途具有对应关系的是( )A、FeSO4易溶于水,可用于制造红色颜料 B、FeS是黑色粉末,可用于去除水体中Cu2+等重金属 C、Fe2(SO4) 3水溶液显酸性,可用于去除天然气中H2S D、Fe在冷的浓硫酸中钝化,可用于制造贮存浓硫酸的贮罐4. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L-1HCl溶液:Al3+、Fe2+、SO 、Br- B、0.1mol·L-1Ca(ClO)2溶液:K+、H+、Cl-、SO C、0.1mol·L-1Ba(OH)2溶液:Na+、NH 、NO 、HCO D、0.1mol·L-1NaHSO3溶液:NH 、K+、CH3COO-、MnO5. 从酸性蚀刻废液(含Fe3+、Cu2+、Fe2+、H+及Cl-)中回收Cu并制取FeCl3·6H2O,下列图示装置和原理不能达到实验目的的是( )
3. 下列有关物质的性质与用途具有对应关系的是( )A、FeSO4易溶于水,可用于制造红色颜料 B、FeS是黑色粉末,可用于去除水体中Cu2+等重金属 C、Fe2(SO4) 3水溶液显酸性,可用于去除天然气中H2S D、Fe在冷的浓硫酸中钝化,可用于制造贮存浓硫酸的贮罐4. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1mol·L-1HCl溶液:Al3+、Fe2+、SO 、Br- B、0.1mol·L-1Ca(ClO)2溶液:K+、H+、Cl-、SO C、0.1mol·L-1Ba(OH)2溶液:Na+、NH 、NO 、HCO D、0.1mol·L-1NaHSO3溶液:NH 、K+、CH3COO-、MnO5. 从酸性蚀刻废液(含Fe3+、Cu2+、Fe2+、H+及Cl-)中回收Cu并制取FeCl3·6H2O,下列图示装置和原理不能达到实验目的的是( ) A、用装置甲从废液中还原出Cu B、用装置乙进行固液分离 C、用装置丙将Fe2+氧化为Fe3+ D、用装置丁将丙中反应后的溶液蒸干制取FeCl3·6H2O6. 下列有关化学反应的叙述正确的是( )A、Cu与稀硝酸反应生成NO B、Fe与H2O(g)加热生成Fe2O3 C、Mg在CO2中燃烧生成MgCO3 D、室温下,氨水中通入过量SO2生成(NH4)2SO37. 下列指定反应的离子方程式正确的是( )A、Na加入H2O中:Na + 2H2O=Na+ + 2OH-+ H2↑ B、Fe(CH3COO)2溶液中加入稀硝酸:CH3COO-+H+ = CH3COOH C、[Ag(NH3)2]OH溶液中加入过量盐酸:[Ag(NH3)2]+ +OH- +3H+ +Cl-=AgCl↓+2NH +H2O D、Na2SO3溶液中通入过量Cl2:3SO +Cl2 + H2O = 2HSO +2Cl-+SO8. 一种合成HCN的反应原理为NH3(g)+C(s) HCN(g)+H2(g)。下列叙述正确的是( )A、该反应的 <0、 <0 B、该反应的平衡常数K = C、单位时间内断裂N-H键数目是断裂H-H键数目的3倍时,该反应达到平衡状态 D、强热下该反应每生成22.4LHCN气体转移电子数目为2×6.02×10239. 一种基于光催化剂MeOx(某金属氧化物)催化氮还原制取氨的反应过程如图所示(图中h+表示空穴),下列说法错误的是( )
A、用装置甲从废液中还原出Cu B、用装置乙进行固液分离 C、用装置丙将Fe2+氧化为Fe3+ D、用装置丁将丙中反应后的溶液蒸干制取FeCl3·6H2O6. 下列有关化学反应的叙述正确的是( )A、Cu与稀硝酸反应生成NO B、Fe与H2O(g)加热生成Fe2O3 C、Mg在CO2中燃烧生成MgCO3 D、室温下,氨水中通入过量SO2生成(NH4)2SO37. 下列指定反应的离子方程式正确的是( )A、Na加入H2O中:Na + 2H2O=Na+ + 2OH-+ H2↑ B、Fe(CH3COO)2溶液中加入稀硝酸:CH3COO-+H+ = CH3COOH C、[Ag(NH3)2]OH溶液中加入过量盐酸:[Ag(NH3)2]+ +OH- +3H+ +Cl-=AgCl↓+2NH +H2O D、Na2SO3溶液中通入过量Cl2:3SO +Cl2 + H2O = 2HSO +2Cl-+SO8. 一种合成HCN的反应原理为NH3(g)+C(s) HCN(g)+H2(g)。下列叙述正确的是( )A、该反应的 <0、 <0 B、该反应的平衡常数K = C、单位时间内断裂N-H键数目是断裂H-H键数目的3倍时,该反应达到平衡状态 D、强热下该反应每生成22.4LHCN气体转移电子数目为2×6.02×10239. 一种基于光催化剂MeOx(某金属氧化物)催化氮还原制取氨的反应过程如图所示(图中h+表示空穴),下列说法错误的是( ) A、光能转变为化学能 B、H+是反应的中间体 C、导带上发生的反应为2H2O +4h+= 4H++ O2↑ D、该过程总反应可表示为N2 +3H2 2NH310. 下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、11. 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,X、Z同主族,Y与W形成的盐的水溶液呈中性。下列说法正确的是( )A、原子半径:r(Y)>r(Z)>r(X) B、简单气态氢化物的热稳定性:X>Z>W C、X、Y形成的化合物中一定不含共价键 D、Z的氧化物的水化物与W的氧化物的水化物之间一定不能发生反应12. 根据下列实验操作和现象所得到的结论正确的是( )
A、光能转变为化学能 B、H+是反应的中间体 C、导带上发生的反应为2H2O +4h+= 4H++ O2↑ D、该过程总反应可表示为N2 +3H2 2NH310. 下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、11. 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,X、Z同主族,Y与W形成的盐的水溶液呈中性。下列说法正确的是( )A、原子半径:r(Y)>r(Z)>r(X) B、简单气态氢化物的热稳定性:X>Z>W C、X、Y形成的化合物中一定不含共价键 D、Z的氧化物的水化物与W的氧化物的水化物之间一定不能发生反应12. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
向盛有BaCl2溶液的试管中通入SO2 , 振荡,出现白色沉淀
白色沉淀为BaSO4
B
向含碘废液X中加入FeCl3溶液,振荡,滴入淀粉溶液变蓝
X中一定含有I-
C
向盛有乙醇的试管中放入新切的钠块,平缓放出气体,钠块未熔化
钠与乙醇的反应为吸热反应
D
向试管中加入2mL10%CuSO4溶液,滴入4~5滴5%NaOH溶液,加入2mL10%麦芽糖溶液,加热,无红色沉淀
麦芽糖无还原性
A、A B、B C、C D、D二、多选题
-
13. Apralactone A的结构简式如图所示,下列有关该化合物的叙述错误的是( )
 A、分子中有3种含氧官能团 B、分子中有2个手性碳原子 C、1mol该化合物至多与1molBr2发生反应 D、1mol该化合物至多与含2mol NaOH的水溶液反应14. 25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示:
A、分子中有3种含氧官能团 B、分子中有2个手性碳原子 C、1mol该化合物至多与1molBr2发生反应 D、1mol该化合物至多与含2mol NaOH的水溶液反应14. 25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示: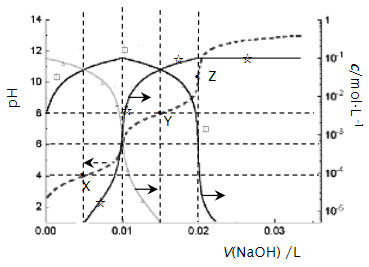
下列说法错误的是( )
A、H2A的Ka1=1×10-4 B、溶液在X点和Z点时水的电离程度相同 C、在Y点时,c(Na+)>3c(A2-) D、0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)15. HCOOH在Pd催化剂表面脱氢的反应机理、反应历程与能量的关系如图所示:
下列说法正确的是( )
A、在Pd催化剂表面HCOOH脱氢反应的 H >0 B、在Pd催化剂表面离解O-H键比C-H键的活化能低 C、在历程Ⅰ~Ⅴ中,生成Ⅴ的反应速率最慢 D、用DCOOH或HCOOD代替HCOOH,得到的产物都有HD和CO2三、综合题
-
16. NaClO用途非常广泛。NaClO溶液中微粒的物质的量分布分数与溶液pH的关系如图-1所示,某NaClO溶液中有效氯含量与温度的关系如图-2所示。
 (1)、工业上常用NaOH溶液与Cl2反应制备NaClO。Cl2与冷的NaOH溶液反应的离子方程式为 , 当通入Cl2至溶液pH=5时,溶液中浓度最大的微粒是(填“Cl2”“ClO-”或“HClO”)。(2)、NaClO溶液在空气中易失效,其与空气中CO2反应的化学方程式为(已知H2CO3的Ka1、Ka2依次为4.47×10-7、4.68×10-11)。(3)、NaClO溶液可用于脱除黄磷生产尾气中PH3等有害气体。脱除PH3机理为:
(1)、工业上常用NaOH溶液与Cl2反应制备NaClO。Cl2与冷的NaOH溶液反应的离子方程式为 , 当通入Cl2至溶液pH=5时,溶液中浓度最大的微粒是(填“Cl2”“ClO-”或“HClO”)。(2)、NaClO溶液在空气中易失效,其与空气中CO2反应的化学方程式为(已知H2CO3的Ka1、Ka2依次为4.47×10-7、4.68×10-11)。(3)、NaClO溶液可用于脱除黄磷生产尾气中PH3等有害气体。脱除PH3机理为:H3O+ + ClO-= HClO + H2O
PH3 + HClO= [PH3O] + H++Cl-
[PH3O]+ClO-= H3PO2 + Cl-
室温下,用3%的NaClO溶液分别在pH=9、pH=11时处理含PH3的尾气,PH3的脱除率如图-3所示:

①下列措施能提高尾气中PH3的脱除率的是(填标号)。
A.增大尾气的流速
B.将吸收液加热到40℃以上
C.采用气、液逆流的方式吸收尾气
D.吸收尾气的过程中定期补加适量NaClO并调节合适的溶液pH
②已知PH3几乎不与NaOH溶液反应,黄磷生产尾气中除PH3外,还有大量的H2S等有害气体。黄磷尾气通过NaClO吸收液前需预先用30%NaOH溶液吸收处理,其目的是。
③pH=9时PH3的脱除率总是比pH=11的大,其原因是。
17. 制备天然化合物antofine的中间体F的一种合成路线如下:
注:PCC为吡啶和CrO3在盐酸溶液中的络合盐,
 。(1)、A中的含氧官能团名称为和。(2)、X的分子式为C8H8O2 , C→D是两苯环间脱2H成稠环,则X的结构简式为。(3)、B→C的反应类型为。(4)、F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:(只写一种)。
。(1)、A中的含氧官能团名称为和。(2)、X的分子式为C8H8O2 , C→D是两苯环间脱2H成稠环,则X的结构简式为。(3)、B→C的反应类型为。(4)、F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:(只写一种)。①分子中只有两种含氧官能团。
②碱性水解后酸化,得到碳原子数相等的芳香化合物P和Q;P既能发生银镜反应又能与FeCl3溶液发生显色反应;P、Q中均只有四种不同化学环境的氢。
(5)、写出以 为原料制备
为原料制备  的合成路线流程图(无机试剂、PCC和有机溶剂任用,合成路线流程图示例见本题题干)。 18. 钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。(1)、Co基态核外电子排布式为。(2)、NO 的空间结构为。(3)、bte的分子式为C6H8N6 , 其结构简式如图所示。
的合成路线流程图(无机试剂、PCC和有机溶剂任用,合成路线流程图示例见本题题干)。 18. 钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。(1)、Co基态核外电子排布式为。(2)、NO 的空间结构为。(3)、bte的分子式为C6H8N6 , 其结构简式如图所示。
①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是和(填元素符号)。
②C、H、N的电负性从大到小顺序为。
③bte分子中碳原子轨道杂化类型为和。
④1mol bte分子中含 键的数目为mol。
19. 从铬铜废催化剂(主要含CuO·Cr2O3、少量有机物及水)中回收铬和铜的实验流程如下: (1)、700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是。(2)、配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、和;为使研碎的烧渣中CuO充分溶解,应采取的措施是。(3)、为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液(Cr2O +6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
(1)、700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是。(2)、配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、和;为使研碎的烧渣中CuO充分溶解,应采取的措施是。(3)、为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液(Cr2O +6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。根据上述实验数据,确定xNa2SO4·yCr2(SO4)3·zH2O的化学式(写出计算过程)。
(4)、已知反应2[Cu(NH3)4]2+ + N2H4·H2O +4OH-= 2Cu↓+ N2↑+ 8NH3 + 5H2O。请补充完整由CuSO4溶液制备纯净铜粉的实验方案: , 干燥得铜粉(实验中须使用的试剂有:12 mol·L-1氨水、2 mol·L-1 N2H4·H2O溶液)。20. 脱除烟气中SO2有电化学法及液相催化氧化法等。(1)、Dennis等设计的电化学膜法脱除SO2的工艺如图-1所示。
多孔阳极上发生的电极反应为;多孔阴极一侧发生的反应包括:
2S2O +2e-=3SO +SO2(g) 、和2SO3 +2SO = 2S2O 。
(2)、研究FeSO4液相催化氧化脱硫的实验流程如图-2所示,循环槽中循环液的pH变化如图-3所示(起始时在脱硫塔中加入9LFeSO4溶液并向循环槽中鼓入空气5min)。
①图-2中设置分析取样点A和B的目的是。
②脱硫塔中发生的主要反应为;循环槽中产生的气体为。
③图-3中430min后脱硫率基本稳定在93.5%左右的原因是。