河南省南阳市2020-2021学年高三上学期化学期中考试试卷
试卷更新日期:2021-09-02 类型:期中考试
一、单选题
-
1. 垃圾分类有利于资源回收利用,下列垃圾归类不合理的是( )
A
B
C
D
垃圾
废易拉罐
废塑料瓶
废荧光灯管
不可再生废纸
垃圾分类

可回收物

其他垃圾

有害垃圾

可燃垃圾
A、A B、B C、C D、D2. 下列实验结果不能作为相应定律或原理的证据是( )A
B
C
D
勒夏特列原理
元素周期律
盖斯定律
阿伏加德罗定律
实
验
方
案



结果
左球气体颜色加深
右球气体颜色变浅
烧瓶中冒气泡,
试管中出现浑浊
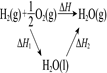
测得ΔH为ΔH1、ΔH2的和
H2与O2的体积比约为2︰1
A、A B、B C、C D、D3. 甲、乙、丙、丁4种物质均含有两种元素,其分子均含有18个电子,下列说法正确的是( )A、若气体乙的摩尔质量与O2相同,则乙一定可以做燃料 B、若气体甲的水溶液在常温下的pH<7,则甲一定是HCl C、若丙分子结构为空间正四面体,则丙一定比甲烷稳定 D、若丁为四原子分子,则一定含有非极性共价键4. 习主席在2020年新年贺词中强调“5G商用加速推出,凝结着新时代奋斗者的心血和汗水,彰显了不同凡响的中国风采、中国力量”,制造芯片用到高纯硅,用SiHCl3与过量H2在1100~1200℃反应制备高纯硅的装置如下图所示(热源及夹持装置略去)。
已知: SiHCl3 遇水H2O 强烈水解,在空气中易自燃。下列说法错误的是( )
A、装置 B 中的试剂是浓硫酸 B、实验时先打开装置C中分液漏斗的旋塞 C、装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的SiHCl3气化 D、装置D不能采用普通玻璃管的原因是在反应温度下,普通玻璃管会软化5. 以菱镁矿(主要成分为MgCO3 , 含少量SiO2 , Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2 , Fe(OH)3和Al(OH)3。下列说法错误的是( )
A、浸出镁的反应为 B、浸出和沉镁的操作均应在较高温度下进行 C、流程中可循环使用的物质有NH3、NH4Cl D、分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同6. 根据表中信息 , 判断下列叙述中正确的是( )序号
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
/
、
②
/
③
A、表中①组的反应可知:通入Cl2的量不同,氧化产物可能不同 B、氧化性强弱的比较: C、表中②组反应的还原产物是KCl,生成1molKCl时转移电子的物质的量是6mol D、表中③组反应的离子方程式为:7. 硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )A、Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存 B、向0.1mo1·L-1该物质的溶液中滴加0.1mol·L-1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C、检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 D、向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓ 8. PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X是元素周期表中原子半径最小的元素,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )A、Z的阳离子与R的阴离子在溶液中因发生氧化还原反应无法共存 B、WY2能与碱反应,但不能与任何酸反应 C、原子半径按X、Y、R、W、Z的顺序依次增大 D、熔沸点:X2R>X2Y9. 将30.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成11.2L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为( )A、39.3g B、40.7g C、56.3g D、34.2g10. 如下图所示,△H1=-393.5 kJ•mol-1 , △H2=-395.4 kJ•mol-1 , 下列说法或表示式正确的是( )
8. PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X是元素周期表中原子半径最小的元素,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )A、Z的阳离子与R的阴离子在溶液中因发生氧化还原反应无法共存 B、WY2能与碱反应,但不能与任何酸反应 C、原子半径按X、Y、R、W、Z的顺序依次增大 D、熔沸点:X2R>X2Y9. 将30.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成11.2L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为( )A、39.3g B、40.7g C、56.3g D、34.2g10. 如下图所示,△H1=-393.5 kJ•mol-1 , △H2=-395.4 kJ•mol-1 , 下列说法或表示式正确的是( ) A、C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1 B、石墨和金刚石的转化是物理变化 C、金刚石的稳定性强于石墨 D、1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ11. 氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知H2O2足量,下列说法正确的是( )
A、C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1 B、石墨和金刚石的转化是物理变化 C、金刚石的稳定性强于石墨 D、1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ11. 氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知H2O2足量,下列说法正确的是( ) A、正极的电极反应式为2H++2e-=H2↑ B、电池工作时,H+通过质子交换膜向负极移动 C、电池工作时,正、负极分别放出H2和NH3 D、工作足够长时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子12. 下列指定反应的离子方程式正确的是( )A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- B、Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH- C、酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O D、NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O13. 合成药物异搏定路线中某一步骤如图所示,下列说法错误的是( )
A、正极的电极反应式为2H++2e-=H2↑ B、电池工作时,H+通过质子交换膜向负极移动 C、电池工作时,正、负极分别放出H2和NH3 D、工作足够长时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子12. 下列指定反应的离子方程式正确的是( )A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- B、Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH- C、酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O D、NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O13. 合成药物异搏定路线中某一步骤如图所示,下列说法错误的是( ) A、物质X的分子中存在2种含氧官能团 B、物质Y可以发生水解和消去反应 C、1molZ最多可与2molBr2发生加成反应 D、等物质的量的X、Y分别与NaOH溶液反应,最多消耗的NaOH的物质的量之比为1:114. pH=1的某溶液X中还含有 、Al3+、Ba2+、Fe2+、Fe3+、 、 、 、Cl-、 中的一种或几种(忽略水的电离及离子的水解),取该溶液进行如下实验:
A、物质X的分子中存在2种含氧官能团 B、物质Y可以发生水解和消去反应 C、1molZ最多可与2molBr2发生加成反应 D、等物质的量的X、Y分别与NaOH溶液反应,最多消耗的NaOH的物质的量之比为1:114. pH=1的某溶液X中还含有 、Al3+、Ba2+、Fe2+、Fe3+、 、 、 、Cl-、 中的一种或几种(忽略水的电离及离子的水解),取该溶液进行如下实验:
下列有关推断错误的是( )
A、根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- B、溶液X中一定含有 、Al3+、Fe2+、 、H+ C、沉淀H为Al(OH)3、BaCO3的混合物 D、若溶液X为100mL,产生的气体A为44.8mL(标况),则X中c(Fe2+)=0.06mol/L15. 向体积为1L,物质的量浓度均为2mol/L的K[Al(OH)4]、Ba(OH)2的混合溶液中缓缓地通入CO2至过量,则下列说法正确的是( ) A、整个过程中溶液最多吸收CO25mol B、整个过程中通入的CO2(x轴)与生成沉淀(y轴)的关系如图所示 C、当沉淀达到最大值时,至少通入标准状况下的CO2的体积为89.6L D、反应结束时沉淀的质量为156g16. 磷烯(如图)是由磷原子六元环组成的蜂巢状褶皱二维晶体,它是白磷(
A、整个过程中溶液最多吸收CO25mol B、整个过程中通入的CO2(x轴)与生成沉淀(y轴)的关系如图所示 C、当沉淀达到最大值时,至少通入标准状况下的CO2的体积为89.6L D、反应结束时沉淀的质量为156g16. 磷烯(如图)是由磷原子六元环组成的蜂巢状褶皱二维晶体,它是白磷( )的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是( )
)的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是( )  A、3.1g白磷中含P—P键的数目为0.3NA B、6.2g磷烯中含六元环的数目为0.1NA C、0.1molP4与0.6molH2在密闭容器中发生反应P4+6H2 4PH3 , 生成PH3分子的数目为0.4NA D、0.1molP4发生反应P4+5O2=2P2O5 , 转移的电子数为20NA
A、3.1g白磷中含P—P键的数目为0.3NA B、6.2g磷烯中含六元环的数目为0.1NA C、0.1molP4与0.6molH2在密闭容器中发生反应P4+6H2 4PH3 , 生成PH3分子的数目为0.4NA D、0.1molP4发生反应P4+5O2=2P2O5 , 转移的电子数为20NA二、综合题
-
17. A、B、C、D、E是中学常见的几种化合物,相关物质间的关系如下图所示:

已知:X、Y是生活中常见的金属单质,A、B都是氧化物且A是红棕色粉末。回答下列问题:
(1)、单质X与A反应的化学方程式是;(2)、若试剂1和试剂2均是强电解质。①若试剂1和试剂2的酸碱性相同,则C溶液显(填"酸性"、"碱性"或"中性");
②若试剂1和试剂2的酸碱性不同,试剂1和B的离子反应方程式是;
(3)、若试剂2是稀硝酸。①Y单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式。
②D的阳离子检验可以用试剂检验。
18. 有A、B、C、D、E五种短周期元素,已知:①C+、D3+均与E的气态氢化物分子含有相同的电子数;A2-、B-与B的气态氢化物分子含有相同的电子数:②A单质在空气中燃烧产生气体R;③B的气态氢化物与E的气态氢化物相遇时有白烟生成。请回答下列问题:
(1)、元素A在元素周期表中的位置是。(2)、A,B,C,D的简单离子半径从大到小顺序为(用离子符号表示)。(3)、B的气态氢化物与E的气态氢化物相遇时生成白烟,该白烟的电子式为。(4)、D的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为。(5)、A元素和B元素以原子个数比1∶1形成化合物Q,Q的结构式为。已知Q是种黄色油状液体,常温下遇水易反应,产生R气体,且溶液出现浑浊,请写出Q与水反应的化学方程式。19. 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2 , 装置如下图所示(有些夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾。 (1)、仪器a的名称:。(2)、C中发生的反应方程式是:。(3)、仪器c(注:小写字母表示)的作用是。(4)、A是实验室制无色气体甲的装置,其离子反应方程式:。(5)、分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静置得到无色溶液乙。写出该反应的离子方程式:。20. 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料,以重品石(BaSO4)为原料,可按如下工艺生产立德粉:
(1)、仪器a的名称:。(2)、C中发生的反应方程式是:。(3)、仪器c(注:小写字母表示)的作用是。(4)、A是实验室制无色气体甲的装置,其离子反应方程式:。(5)、分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静置得到无色溶液乙。写出该反应的离子方程式:。20. 立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料,以重品石(BaSO4)为原料,可按如下工艺生产立德粉:
回答下列问题:
(1)、在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应为将其转化为CO2和一种清洁能源气体,该反应的化学方程式为。(2)、在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的(填化学式)。(3)、沉淀器中反应的离子方程式为。(4)、成品中S2-的含量可以用"碘量法"测得。称取mg样品,置于碘量瓶中,移取25.00mL0.1000mol/L的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000mol/LNa2S2O3溶液滴定,反应式为 。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为 , 样品中S2-的含量为(写出表达式)。21. 丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。回答下列问题。(1)、已知:Ⅰ.Ⅱ.
则丙烷脱氢制丙烯反应C3H8(g) C3H6(g)+H2(g)的∆H=。
(2)、如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。
104Pa时,图中表示丙烯的曲线是(填"a"、“b”、"c"或"d")。
(3)、一定温度下,向恒容密闭容器中充入1molC3H8 , 开始压强为pkPa,发生丙烷脱氢制丙烯反应。①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是(填字母)。
A.该反应的焓变(∆H)保持不变
B.气体平均摩尔质量保持不变
C.气体密度保持不变
D.C3H8分解速率与C3H6消耗速率相等
②欲使丙烯的平衡产率提高,应采取的措施是(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
③为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则丙烧脱氢反应的K(填"增大"、"减小"或"不变")。
(4)、利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
图中催化剂为 , 该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是。