辽宁省辽南协作体2020-2021学年高一上学期化学期中考试试卷
试卷更新日期:2021-08-31 类型:期中考试
一、单选题
-
1. 下列说法错误的是( )A、波义耳提出化学元素的概念,标志着近代化学的诞生 B、瑞典化学家舍勒在实验中意外地发现了一种黄绿色气体,并将该气体的组成元素命名为氯 C、我国化学家侯德榜创立的“侯氏制法”将氨碱法和合成氨联合起来,降低了制碱成本 D、人们对氧化还原反应的认识经历了一个漫长的过程,现在将原子失去电子(或电子对偏离)的过程叫做氧化反应2. 利用焰色试验原理,人们在烟花中有意识地加入特定金属元素,使火焰更加绚丽多彩,下列说法中正确的是( )A、焰色试验时,如果没有铂丝,可以用玻璃棒代替 B、做焰色试验时,最好选择本身颜色较浅的火焰 C、可以用焰色试验鉴别所有金属元素 D、非金属单质燃烧时火焰均无色3. 下列关于金属钠的叙述中,正确的是( )A、钠与氯化铁溶液反应时,钠浮在水面上四处游动,并置换出金属铁 B、钠着火时用干燥的沙土灭火 C、钠在空气中受热时,熔化成银白色小球,产生黄色火花,生产白色粉末 D、钠在空气中长期放置,最终主要产物为过氧化钠4. 下列离子反应方程式相对应的化学方程式正确的是( )A、 ; B、 ; C、 ; D、 ;5. 实验室制备纯净的氯气并回收剩余药品,下列图示装置和原理能达到实验目的的是( )A、制备氯气
 B、去除杂质
B、去除杂质  C、干燥氯气
C、干燥氯气  D、回收固体MnO2
D、回收固体MnO2  6. 如图所示,在A处通入未经干燥的氯气,当关闭B阀时,C处的红布条看不到明显现象:当打开B阀后,C处的红布条逐渐褪色:则D瓶中盛放的溶液可能是( )
6. 如图所示,在A处通入未经干燥的氯气,当关闭B阀时,C处的红布条看不到明显现象:当打开B阀后,C处的红布条逐渐褪色:则D瓶中盛放的溶液可能是( )①饱和NaCl溶液
②NaOH溶液
③H2O
④浓硫酸
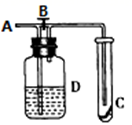 A、①② B、①③ C、②④ D、③④7. 在下列各溶液中,离子一定能大量共存的是( )A、在无色溶液中: 、 、 、 B、在含大量 的溶液中: 、 、 、 C、在强碱溶液中: 、 、 、 D、含有 的溶液中: 、 、 、8. 关于氯气的性质下列说法错误的是( )A、新制氯水的颜色是因为氯水中含有氯气分子导致 B、氢气在氯气中安静燃烧,发出黄色火焰 C、储存氯气的钢瓶,为防止腐蚀,装氯气前必须先充分干燥 D、根据氯气能与碱反应,可用氢氧化钠溶液进行氯气的尾气吸收处理9. 下列关于 的叙述中,正确的是( )A、 能与酸反应生成盐和水,所以 是碱性氧化物 B、 能与水反应,所以 可以作气体的干燥剂 C、 吸收 产生 ,因此可用作呼吸面具的供氧剂 D、 与二氧化碳反应时, 只作氧化剂10. 下列离子方程式中正确的是( )A、将稀盐酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ B、将碳酸氢钠溶液与稀硫酸合:HCO +H+=H2O+CO2↑ C、硫酸铜与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ D、将硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+NO11. 在抗击新冠病毒过程中,需要使用大量消毒剂,下列关于含氯消毒剂的说法正确的是( )A、为了使消毒效果更好,可以把漂白粉和洁厕灵(浓盐酸)一起使用 B、漂白粉的有效成分是次氯酸钙和氯化钙 C、工业上将氯气通入澄清石灰水中制取漂白粉 D、向暴露在空气中的漂白粉中滴入盐酸可能有二氧化碳气体生成12. 根据下列各反应,判断有关物质还原性由强到弱的顺序是( )
A、①② B、①③ C、②④ D、③④7. 在下列各溶液中,离子一定能大量共存的是( )A、在无色溶液中: 、 、 、 B、在含大量 的溶液中: 、 、 、 C、在强碱溶液中: 、 、 、 D、含有 的溶液中: 、 、 、8. 关于氯气的性质下列说法错误的是( )A、新制氯水的颜色是因为氯水中含有氯气分子导致 B、氢气在氯气中安静燃烧,发出黄色火焰 C、储存氯气的钢瓶,为防止腐蚀,装氯气前必须先充分干燥 D、根据氯气能与碱反应,可用氢氧化钠溶液进行氯气的尾气吸收处理9. 下列关于 的叙述中,正确的是( )A、 能与酸反应生成盐和水,所以 是碱性氧化物 B、 能与水反应,所以 可以作气体的干燥剂 C、 吸收 产生 ,因此可用作呼吸面具的供氧剂 D、 与二氧化碳反应时, 只作氧化剂10. 下列离子方程式中正确的是( )A、将稀盐酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ B、将碳酸氢钠溶液与稀硫酸合:HCO +H+=H2O+CO2↑ C、硫酸铜与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ D、将硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+NO11. 在抗击新冠病毒过程中,需要使用大量消毒剂,下列关于含氯消毒剂的说法正确的是( )A、为了使消毒效果更好,可以把漂白粉和洁厕灵(浓盐酸)一起使用 B、漂白粉的有效成分是次氯酸钙和氯化钙 C、工业上将氯气通入澄清石灰水中制取漂白粉 D、向暴露在空气中的漂白粉中滴入盐酸可能有二氧化碳气体生成12. 根据下列各反应,判断有关物质还原性由强到弱的顺序是( )①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO+2H2O+Fe(NO3)3
A、 B、 C、 D、13. 下列各组物质中,其名称、俗名、化学式及物质类别相符合的是( )选项
名称
生活中的物质
化学式
用途或性质
A
碳酸钠
小苏打
制肥皂
B
碳酸氢钠
苏打
制糕点
C
次氯酸钠
漂白液
消毒剂
D
碳酸钙
生石灰
贝壳饰品
A、A B、B C、C D、D14. 下列依据相关实验得出的结论正确的是( )A、氯化钠溶液在电流的作用下电离成钠离子和氯离子 B、向某溶液中加入过量稀盐酸,若产生能使澄清石灰水变浑浊的气体,则该溶液中的阴离子一定是 C、向某溶液中加入硝酸银溶液,若产生白色沉淀,则该溶液中的阴离子一定是 D、向某溶液中加入过量的稀盐酸,无明显现象,再加入氯化钡溶液,若产生白色沉淀,则该溶液中的阴离子一定是15. 下列说法正确的是( )A、铁在氯气中燃烧生成 B、氯元素在自然界中大量以游离态存在 C、氯气对自来水消毒时,可能产生对人体有害的有机氯化物,所以国家规定了饮用水中余氯含量的标准 D、将鲜花放入盛有氯气的集气瓶中,鲜花褪色,说明氯气具有漂白性16. 下列鉴别等浓度的碳酸钠和碳酸氢钠溶液方法正确的是( )A、分别取少量溶液于试管中,滴入几滴酚酞溶液,溶液红色深的是碳酸钠;溶液红色浅的是碳酸氢钠 B、分别取少量溶液于试管中,滴入几滴澄清石灰水,产生沉淀的是碳酸钠;不产生沉淀的是碳酸氢钠 C、分别取适量溶液于试管中,逐滴滴入适量盐酸,先产生气泡的是碳酸氢钠;后产生气泡的是碳酸钠 D、分别取少量溶液于试管中,加入适量氢氧化钠溶液,产生沉淀的是碳酸钠;不产生沉淀的是碳酸氢钠17. 某温度下,将氯气通入氢氧化钾溶液中,反应后得到氯化钾,次氯酸钾,氯酸钾的混合溶液,经测定溶液中 与 的个数之比为3∶4,则氯气与氢氧化钾反应时,被还原的氯原子与被氧化的氯原子的个数之比为( )A、7∶12 B、12∶7 C、7∶23 D、23∶7二、多选题
-
18. 下列叙述中,错误的是( )A、金刚石和石墨互为同素异形体 B、盐一定含有金属元素,酸、碱不一定含金属元素 C、酸、碱、盐可能都不含金属元素 D、不可通过化学反应,由碳酸氢钠一步转化生成氢氧化钠19. 氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价.NaH用作生氢剂时的化学反应原理为: .下列有关该反应的说法中正确的是( )A、该反应属于复分解反应 B、NaOH是氧化产物 是还原产物 C、NaH是还原剂 D、被还原氢原子与被氧化氢原子个数比为1∶120. 下列实验操作、现象、解释或结论都正确的是( )
选项
实验操作
实验现象
解释或结论
A
用铁丝蘸取某种粉末做焰色试验
火焰呈黄色
证明含有钠单质
B
将饱和氯化铁溶液滴入沸水中
产生某种红褐色液体
该红褐色液体为胶体
C
用红色激光笔照射雾
看到一条光亮的“通路”
雾能产生丁达尔效应
D
加热碳酸氢钠溶液
产生能使澄清石灰水变浑浊的气体
碳酸氢钠热稳定性较差
A、A B、B C、C D、D三、填空题
-
21. 物质可根据其组成和性质进行分类.
 (1)、如上图所示的物质分类方法名称是.(2)、人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌,帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内.当胃酸过多时就会出现“咯酸水”“烧心”“胃部隐隐作痛”等症状.目前市场上的抗酸药主要有①吸收性抗酸药,如 等;②非吸收性抗酸药,如 ,MgO等.
(1)、如上图所示的物质分类方法名称是.(2)、人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌,帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内.当胃酸过多时就会出现“咯酸水”“烧心”“胃部隐隐作痛”等症状.目前市场上的抗酸药主要有①吸收性抗酸药,如 等;②非吸收性抗酸药,如 ,MgO等.物质类别
酸
碱
盐
氧化物
氢化物
化学式
①将上述所举抗酸药填入上表对应类别.
②写出 的电离去程式.
(3)、写出制备氢氧化铁胶体的方程式 , 胶体和溶液的本质原因是.22. 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。以NaCl、 、 等为原料先制得 ,进而生产出纯碱,工业上由此方法制得的纯碱中含有少量的 杂质,某化学兴趣小组为验证 杂质的存在并测定纯碱的纯度 进行如下实验:(1)、验证 杂质的存在取少量样品置于大试管中加热如图所示:

①大试管中发生化学反应方程式为.
②证明纯碱中含有 杂质的现象为.
(2)、方案一:沉淀法取ag样品溶于水配成溶液,加入足量_______将样品充分反应,过滤、洗涤、干燥称量沉淀的质量为bg.由此计算混合物中 .
A、NaOH溶液 B、 溶液 C、 溶液(3)、方案二:量气法取ag样品溶于水配成溶液,向其中逐滴滴入盐酸,产生 的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图.

①加入盐酸 时发生的离子反应方程式为.
②ag样品中 和 的个数比为 , 然后可求出 。
23. 高铁酸钾( )是一种新型,高效,多功能绿色消毒剂.比 、 、 、 氧化性更强,无二次污染,主要用于饮用水的处理.工业上先制得高铁酸钠.然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.(1)、湿法制备高铁酸钾( )的反应体系中有六种微粒: 、 、 、 、 、 .写出湿法制备高铁酸钾的离子反应方程式并用双线桥标出电子转移的方向和数目氧化性:NaClO (填“大于”或“小于”)(2)、干法制备高铁酸钠的主要反应为: .①该反应中的氧化产物是 , 每生成1个 转移个 .
②简要说明 作为水处理剂时所起的作用:.
24. 某无色透明溶液中可能大量存在 、 、 、 中的几种,请填写下列空白:(1)、不做任何实验就可以肯定原溶液中不存在的离子是.(2)、用铂丝蘸取待测液进行焰色试验,火焰呈现黄色.证明含有.(3)、取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失.说明原溶液中肯定存在的离子是 , 有关的离子方程式为.(4)、将(3)中反应后混合物过滤,取滤液加入过量的稀氨水( ),出现白色沉淀,有关的离子方程式为.(5)、原溶液可能大量存在的阴离子是下列的________.A、 B、 C、 D、25. 某化学兴趣小组欲在实验室探究氯气氧化性并模拟工业制取漂白粉,设计如图装置.进行实验: (1)、圆底烧瓶中发生反应的离子方程式为.(2)、装置的连接顺序为.(3)、饱和NaCl溶液的作用是 , 淀粉KI溶液的现象为.(4)、与石灰乳反应制取漂白粉的化学方程式为 , 该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减小副反应发生的方法是.(5)、若用将NaOH溶液换为 溶液,发生的离子反应方程式为.(6)、用下列两种方法制取氯气:①用含氯化氢146g的浓盐酸与足量的二氧化锰反应;②用87g二氧化锰与足量的浓盐酸反应,②中可制得氯气物质的量为 , 该物质的量比①中制得氯气物质的量(填“多”“少”“一样”).
(1)、圆底烧瓶中发生反应的离子方程式为.(2)、装置的连接顺序为.(3)、饱和NaCl溶液的作用是 , 淀粉KI溶液的现象为.(4)、与石灰乳反应制取漂白粉的化学方程式为 , 该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减小副反应发生的方法是.(5)、若用将NaOH溶液换为 溶液,发生的离子反应方程式为.(6)、用下列两种方法制取氯气:①用含氯化氢146g的浓盐酸与足量的二氧化锰反应;②用87g二氧化锰与足量的浓盐酸反应,②中可制得氯气物质的量为 , 该物质的量比①中制得氯气物质的量(填“多”“少”“一样”).