辽宁省六校协作体2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2021-08-30 类型:期中考试
一、单选题
-
1. 下列属于碱,又是弱电解质的是( )A、纯碱 B、一水合氨 C、氯水 D、火碱2. 一定温度下,用水稀释 的一元弱酸 ,随着稀释的进行,下列数值一定增大的是( 表示水的离子积, 表示 的电离常数)( )A、 B、 C、 D、3. 一定温度下,在容积恒定的密闭容器中,进行可逆反应:A(s)+2B(g) C(g)+D(g),当下列物理量不再发生变化时,能说明该反应已达到平衡状态的有( )
①混合气体的密度②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度
A、1个 B、2个 C、3个 D、4个4. 下列事实:① 溶液呈酸性;
②长期施用化肥 会使土壤酸性增强,发生板结;
③配制 溶液时,用稀盐酸溶解 固体;
④ 溶液中 ;
⑤氯化铵溶液可去除金属制品表面的锈斑;
⑥蒸干 溶液,往往得不到 固体。
其中与盐类的水解有关的有( )
A、仅①②③⑤ B、仅②③④⑤⑥ C、仅①④⑤⑥ D、仅①②③④⑤5. 下列各组离子在指定条件下,一定能大量共存的是( )A、能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO 、NO B、c(H+)=1×10-1 mol·L-1的溶液中:Cu2+、Al3+、SO 、NO C、能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH 、S2-、Br- D、水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Na+、Mg2+、Cl-、SO6. 某化学反应的 , ,则此反应在下列哪种情况下可自发进行( )A、在任何温度下都能自发进行 B、在任何温度下都不能自发进行 C、仅在高温下自发进行 D、仅在低温下自发进行7. 下列反应不属于水解反应或水解方程式错误的是( )①
②
③
④碳酸氢钠溶液:
⑤ 溶于 中:
A、①②③④ B、①②③ C、②③⑤ D、全部8. 25℃时,在等体积的① 的 溶液、② 的 溶液、③ 的 溶液、④ 的 溶液中,由水电离出的 之比是( )A、 B、 C、 D、9. 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度
随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是( )
A、2.5μmol·L-1·min-1和2.0 μmol·L-1 B、2.5μmol·L-1·min-1和2.5 μmol·L-1 C、3.0μmol·L-1·min-1和3.0 μmol·L-1 D、5.0μmol·L-1·min-1和3.0 μmol·L-110. 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g) cC(g)+dD(g) ΔH<0。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( ) A、达到化学平衡时A的消耗速率与C的消耗速率相等 B、保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 C、保持温度不变,再向容器中充入n mol A 和n mol B,A,B的转化率均不变 D、图像中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度11. 常温下,用 溶液分别滴定20 mL 的 溶液和HCN溶液,所得滴定曲线如图所示。下列说法正确的是( )
A、达到化学平衡时A的消耗速率与C的消耗速率相等 B、保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 C、保持温度不变,再向容器中充入n mol A 和n mol B,A,B的转化率均不变 D、图像中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度11. 常温下,用 溶液分别滴定20 mL 的 溶液和HCN溶液,所得滴定曲线如图所示。下列说法正确的是( ) A、点②和点③所示溶液中均存在: B、点①和点②所示溶液中: C、点③和点④所示溶液中: D、点①和点②所示溶液中:12. 常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )A、1∶9 B、1∶4 C、1∶1 D、1∶2
A、点②和点③所示溶液中均存在: B、点①和点②所示溶液中: C、点③和点④所示溶液中: D、点①和点②所示溶液中:12. 常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )A、1∶9 B、1∶4 C、1∶1 D、1∶2二、多选题
-
13.
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:
N2(g)+3H2(g)⇌2NH3(g)△H=﹣192kJ•mol﹣1 . 向 M、N 中,都通入 xmol N2 和ymol H2的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
 A、若x:y=1;2,则平衡时,M中的转化率:N2>H2 B、若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90% C、若x=1,y=3,则达到平衡时反应物的转化率N>M D、平衡时N2气体在两容器中体积分数可能相等14. 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )A、0.1 溶液与0.1 溶液等体积混合: B、浓度均为0. 1 的小苏打溶液与烧碱溶液等体积混合: C、 相同的氨水、 溶液、 溶液中: D、常温下, 0.2 溶液与0.1 溶液等体积混合,所得 的溶液中:15. 下列实验误差分析错误的是( )A、用润湿的pH试纸测稀碱溶液的pH,测定值偏小 B、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 C、用已知浓度的酸滴定未知浓度的碱,取碱时开始平视后来俯视,测试结果偏小 D、测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中,所测温度值偏小
A、若x:y=1;2,则平衡时,M中的转化率:N2>H2 B、若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90% C、若x=1,y=3,则达到平衡时反应物的转化率N>M D、平衡时N2气体在两容器中体积分数可能相等14. 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )A、0.1 溶液与0.1 溶液等体积混合: B、浓度均为0. 1 的小苏打溶液与烧碱溶液等体积混合: C、 相同的氨水、 溶液、 溶液中: D、常温下, 0.2 溶液与0.1 溶液等体积混合,所得 的溶液中:15. 下列实验误差分析错误的是( )A、用润湿的pH试纸测稀碱溶液的pH,测定值偏小 B、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 C、用已知浓度的酸滴定未知浓度的碱,取碱时开始平视后来俯视,测试结果偏小 D、测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中,所测温度值偏小三、填空题
-
16.(1)、泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示);灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示): , 当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为:(2)、在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=。17. 电离度可表示电解质的相对强弱,电离度 (已电离的电解质/原有电解质)×100%。已知25 ℃时几种物质(微粒)的电离度(溶液浓度均为0.1 )如表所示:
编号
物质(微粒)
电离度α
A
硫酸溶液(第一步完全电离):第二步
10%
B
硫酸氢钠溶液:
29%
C
醋酸:
1.33%
D
盐酸:
100%
(1)、25℃ 时,上述几种溶液中 从大到小的顺序是(填序号)。(2)、25℃ 时,0.1 硫酸溶液中 的电离度小于相同温度下0.1 硫酸氢钠溶液中 的电离度,其原因是。(3)、醋酸的电离平衡常数 的表达式是 , 则物质的量浓度为 的醋酸的电离平衡常数 与电离度α的关系为 (用含 的代数式表示)。(4)、25℃时,纯水密度约为1g/mL。纯水的电离度约为四、综合题
-
18. 滴定实验是化学学科中重要的定量实验。请回答下列问题:(1)、酸碱中和滴定:用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是。
②上述滴定过程中操作滴定管的图示,正确的是。

③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH 溶液浓度(填“偏大”、“偏小”或“无影响”)。
(2)、氧化还原滴定:用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得识,你认为合理的是(填字母序号)。
②判断滴定终点的依据是。
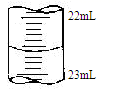
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
 (3)、沉淀滴定滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(3)、沉淀滴定滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是____(填选项字母)。
难溶物
AgCl
AgBr
AgCN
Ag2CrO4
AgSCN
颜色
白
浅黄
白
砖红
白
KSP
1.77×10-10
5.35×10-13
1.21×10-16
1.12×10-12
1.0×10-12
A、NaCl B、NaBr C、NaCN D、Na2CrO419. 二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:① CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列问题:
(1)、则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=kJ·mol-1 , 该反应的平衡常数K=(用K1、K2、K3表示)(2)、下列措施中,能提高(1)中CH3OCH3产率的有__________。A、使用过量的CO B、升高温度 C、增大压强(3)、一定温度下,0.2molCO和0.1molH2O通入2L恒容密闭容器中,发生反应③,5分钟时达到化学平衡,平衡后测得H2的体积分数为0.1。则5分钟v(H2O)= , CO的转化率α(CO)=。(4)、将合成气以 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。A、△H <0 B、P1>P2>P3 C、若在P3和316℃时,起始时 =3,则平衡时,α(CO)小于50%(5)、采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题。催化剂中 约为时最有利于二甲醚的合成。 20. 从海水中提取并制备碳酸锂,可以提高海水的综合利用价值,满足工业上对碳酸锂的需求。制备碳酸锂的一种工艺流程如下:
20. 从海水中提取并制备碳酸锂,可以提高海水的综合利用价值,满足工业上对碳酸锂的需求。制备碳酸锂的一种工艺流程如下: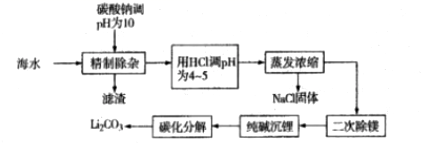
已知:①海水中某些离子浓度如下:
离子
Li+
Mg2+
Ca2+
Mn2+
Cl-
浓度(mol/L)
0.113
0.049
0.001
0.010
0.501
②碳酸锂的溶解度:
温度(℃)
0
10
30
50
70
90
溶解度(g/L)
1.54
1.43
1.25
1.08
0.91
0.83
几种难溶电解质的溶度积(25℃):
物质
Li2CO3
MgCO3
MnCO3
CaCO3
Mg(OH)2
Ksp
2.5×10-2
6.8×10-6
2.3×10-11
2.8×10-9
6×10-10
请回答下列问题:
(1)、精制除杂阶段的滤渣为MgCO3、 写化学式(2)、用HCl调pH为4~5的目的是。(3)、二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为。(4)、沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:序号
沉淀质量(g)
Li2CO3含量(%)
锂回收率(%)
0.9:2.0
10.09
92.36
77.67
1.0:2.0
10.97
90.19
82.46
1.1:2.0
11.45
89.37
85.27
1.2:2.0
12.14
84.82
85.85
综合以上信息及考虑实际生产时的原料成本,应按照 填序号 中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
(5)、沉锂温度需控制在 ,主要原因是。(6)、碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:。写出在碳化分解中可循环利用物质的电子式:。