江苏省海安市2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2021-08-30 类型:期中考试
一、单选题
-
1. 山西被称为煤海,欲提高煤的燃烧效率,下列说法正确的是( )A、将煤粉碎后燃烧 B、通入大量的空气 C、加入的煤越多越好 D、将煤和空气在密闭的空间里燃烧2. 在气体反应中,使反应物中活化分子数增多,且活化分子百分数增大的方法是( )
①增大反应物浓度②升高温度③增大压强④移去生成物⑤加入合适的催化剂
A、①③⑤ B、②⑤ C、②③⑤ D、①③④3. NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能:化学键
N N
F—F
N—F
键能/(kJ•mol-1)
941.7
154.8
283.0
下列说法中正确的是( )
A、过程N2(g)→2N(g)放出能量 B、过程N(g)+3F(g) →NF3(g)放出能量 C、反应N2(g)+3F2(g)=2NF3(g)为吸热反应 D、NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应4. 下列说法正确的是( )A、化学反应速率通常用单位时间内反应物或生成物的质量变化来表示 B、用不同物质的浓度变化表示同一时间内同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 C、化学反应速率的单位通常由时间单位和物质的量单位决定 D、在化学反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值5. 下列生产或实验事实引出的结论错误的是( )选项
事实
结论
A.
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出沉淀所需时间缩短
当其他条件不变时,升高反应温度,化学反应速率加快
B.
工业制硫酸过程中,在SO3的吸收阶段,喷洒浓硫酸吸收SO3
增大气液接触面积,使SO3的吸收速率增大
C.
在容积不变的密闭容器中发生反应: ,向其中通入氩气
反应速率减慢
D.
A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快
当其他条件不变时,催化剂可以改变化学反应速率
A、A B、B C、C D、D6. 下列事实中,不能用勒夏特列原理解释的是( )A、开启啤酒瓶后,瓶中马上泛起大量泡沫 B、由H2、I2蒸气、HI组成的平衡体系加压回颜色变深 C、实验室中常用排饱和食盐水的方法收集Cl2 D、工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率7. 对利用甲烷消除NO2污染进行研究,CH4+2NO2⇌N2+CO2+2H2O。在2 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2 , 测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( )组别
温度
时间/min(n/mol)
0
10
20
40
50
①
T1
n(CH4)
0.50
0.35
0.25
0.10
0.10
②
T2
n(CH4)
0.50
0.30
0.18
0.15
A、组别1中,0-20min内,NO2的降解速率为0.025mol·L-1·min-1 B、由实验数据可知实验控制的温度T1>T2 C、40min时,表格中T2对应反应已经达到平衡状态 D、0~10min内,CH4的降解速率①>②8. 下列溶液:①CH3COOH ②HCl ③NaOH ④CH3COONa ⑤KCl ⑥NH4Cl其物质的量浓度均为0.1mol/L,其pH由大到小排列顺序为( )A、③④⑤⑥①② B、④⑤⑥①③② C、②①⑥⑤④③ D、②③①⑥⑤④9. 已知25 ℃下,醋酸溶液中各粒子存在下述关系:K= =1.75×10-5 , 下列有关说法可能成立的是( )A、25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-5 B、25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-4 C、标准状况下,醋酸溶液中K=1.75×10-5 D、升高到一定温度,K=7.2×10-510. 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,可供选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
锥形瓶中溶液
滴定管中溶液
选用指示剂
选用滴定管
A
NaOH溶液
H2SO4溶液
石蕊
乙
B
H2SO4溶液
NaOH溶液
酚酞
甲
C
NaOH溶液
H2SO4溶液
甲基橙
乙
D
H2SO4溶液
NaOH溶液
酚酞
乙
A、A B、B C、C D、D11. 下列实验现象不能说明相应的化学反应一定是放热反应的是( )选项
A
B
C
D
反应装置
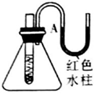
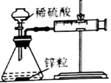
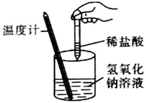
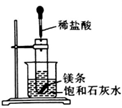
实验现象
试管中生石灰和水混合后,A处红色水柱下降
反应开始后,针筒活塞向右移动
温度计的水银柱不断上升
饱和石灰水变浑浊
A、A B、B C、C D、D12. 已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H= -24.8 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H= -47.2 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ·mol-1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为( )
A、放出218 kJ B、放出109kJ C、吸收218 kJ D、吸收109 kJ1二、多选题
-
13. 水浴加热滴有酚酞的NaHCO3溶液,颜色及pH随温度变化如下表(忽略水的挥发),下列说法正确的是( )
时间
①
②
③
④
⑤
温度/℃
20
30
40
从40℃冷却到20℃
沸水浴后冷却到20℃
颜色变化
红色略加深
红色接近①
红色比③加深较多
pH
8.31
8.29
8.26
8.31
9.20
A、NaHCO3溶液显碱性的原因: B、①→③的过程中,颜色加深的原因可能是 水解程度减小 C、①→③的过程中,pH略微下降说明升温过程中c(OH-)减小 D、⑤比①pH增大,推测是由于NaHCO3分解生成Na2CO3的缘故14. 根据下列反应原理设计的应用,正确的是( )A、 +H2O +OH- , 用热的纯碱溶液清洗油污 B、Al3++3H2O Al(OH)3(胶体)+3H+ , 明矾杀菌消毒 C、TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl,制备TiO2纳米粉 D、SnCl2+H2O Sn(OH)Cl↓+HCl,配制氯化亚锡溶液时加入氢氧化钠15. 下列叙述正确的是( )A、合成氨反应放热,采用低温可以提高氨的生成速率 B、常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低 C、反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0 D、在一容积可变的密闭容器中反应2SO2(g)+O2(g) 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动, 的值不变三、综合题
-
16. 取0.55mol·L−1的NaOH溶液50mL与0.25mol·L−1的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
 (1)、从如图实验装置可知,缺少的一种仪器名称是。(2)、若改用60mL0.25mol·L−1H2SO4和50mL0.55mol·L−1NaOH溶液进行反应,则比上述实验所放出的热量(填“多”或“少”)。(3)、写出用稀H2SO4和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol−1):。(4)、某学生实验记录数据如下:
(1)、从如图实验装置可知,缺少的一种仪器名称是。(2)、若改用60mL0.25mol·L−1H2SO4和50mL0.55mol·L−1NaOH溶液进行反应,则比上述实验所放出的热量(填“多”或“少”)。(3)、写出用稀H2SO4和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol−1):。(4)、某学生实验记录数据如下:实验
起始温度t1/℃
终止温度t2/℃
序号
硫酸
氢氧化钠溶液
混合溶液
1
20.0
20.2
23.2
2
20.2
20.4
23.4
3
20.4
20.6
23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=(结果保留一位小数)(已知稀溶液的比热容为4.18J/(g·℃),稀溶液的密度1g/cm3)。
(5)、上述实验数值结果与57.3kJ·mol−1有偏差,产生偏差的原因可能是。a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.实验装置保温、隔热效果差
17. 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。(1)、实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:实验步骤
现象
结论
①分别取等体积的2 mol·L-1的硫酸于试管中
反应速率Mg>Fe,Cu不反应
金属的性质越活泼,反应速率越快
②………….
反应物浓度越大,反应速率越快
甲同学表中实验步骤②为。
(2)、甲同学的实验目的是;要得出正确的实验结论,还需控制的实验条件是。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。 (3)、乙同学在实验中应该测定的数据是。(4)、乙同学完成该实验应选用的实验药品是 , 该实验中不选用某浓度的硫酸,理由是。(5)、实验二:已知 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(3)、乙同学在实验中应该测定的数据是。(4)、乙同学完成该实验应选用的实验药品是 , 该实验中不选用某浓度的硫酸,理由是。(5)、实验二:已知 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是的影响。(6)、若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。A、硫酸钾 B、硫酸锰 C、二氯化锰 D、水18. 某温度下,在密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。请回答下列问题: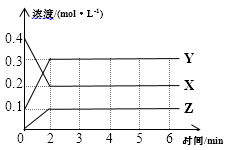 (1)、由图中数据分析:该反应的化学方程式为。(2)、反应开始至2min,X的平均反应速率为。(3)、不改变反应条件,3min至4min时Z的生成速率与5min至6min时Z的生成速率相比较,前者后者(填“大于”、“小于”或“等于”)。(4)、上述反应过程中,如果降低温度,则其反应速率(填“增大”、“减小”或“不变)。(5)、下列各项中不可以说明上述反应达到平衡的是(填字母)。
(1)、由图中数据分析:该反应的化学方程式为。(2)、反应开始至2min,X的平均反应速率为。(3)、不改变反应条件,3min至4min时Z的生成速率与5min至6min时Z的生成速率相比较,前者后者(填“大于”、“小于”或“等于”)。(4)、上述反应过程中,如果降低温度,则其反应速率(填“增大”、“减小”或“不变)。(5)、下列各项中不可以说明上述反应达到平衡的是(填字母)。a.X、Y、Z的反应速率之比为2∶2∶1
b.Y物质的物质的量保持不变
c.X的浓度保持不变
d.同一物质的正反应速率等于逆反应速率
e.消耗2mol X同时生成1mol Z
19. 在氨水中存在下列电离平衡:NH3·H2O +OH-。(1)、下列情况能引起电离平衡正向移动的有(填字母,下同)。①加NH4Cl固体 ②加NaOH溶液 ③通入HCl ④加CH3COOH溶液 ⑤加水 ⑥加压
a. ①③⑤ b. ①④⑥
c. ③④⑤ d. ①②④
(2)、在含有酚酞的0.1 mol·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色。a. 变蓝色 b. 变深
c. 变浅 d. 不变
(3)、在一定温度下,用水缓慢稀释1 mol·L-1氨水的过程中,溶液中随着水量的增加:①n(OH-) (填“增大”“减小”或“不变”,下同);
② ;
③ 。
20. 常温下,有四种溶液:①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)、溶液①的pH(填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是。(2)、溶液②呈(填“酸”“碱”或“中”)性。其原因是(用离子方程式和适当的叙述说明)。(3)、下列有关①和②两种溶液的说法正确的是(填字母)。a. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)、NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)(填“>”“<”或“=”,下同)c( ),NaHCO3溶液中c(H2CO3)c( )。