河北省邯郸市联盟校2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2021-08-30 类型:期中考试
一、单选题
-
1. 下列诗句或谚语中包含吸热反应过程的是( )A、野火烧不尽,春风吹又生 B、春蚕到死丝方尽,蜡炬成灰泪始干 C、千锤万凿出深山,烈火焚烧若等闲 D、爆竹声中一岁除,春风送暖入屠苏2. 已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )A、v(CO)=1.5mol•L-1•min-1 B、v(NO2)=0.7mol•L-1•min-1 C、v(N2)=0.4mol•L-1•min-1 D、v(CO2)=1.1mol•L-1•min-13. 已知:NO2(g)+ SO2(g) SO3(g) +NO(g)。现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )A、混合气体总物质的量保持不变 B、混合气体密度保持不变 C、NO2(g)和SO2(g)的体积比保持不变 D、每消耗1 molSO2 , 同时消耗0.5 molSO3(g)4. 下列说法或表示法正确的是( )A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 B、由C(石墨,s)=C(金刚石,s) △H=+119 kJ/mol可知,石墨比金刚石稳定 C、在稀溶液中:H+(aq) + OH-(aq)=H2O(l) △H =- 57.3 kJ/mol,.若将含0.5 mol的浓硫酸溶液与含1 molNaOH的溶液混合,放出的热量等于57.3kJ D、在101 kPa时,2 g H2完全燃烧生成液态水,放出285. 8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) △H = +285.8 kJ·mol-15. 氧化亚铜是一种重要的工业原料。已知1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量,氧化亚铜与氧气反应的能量变化如图所示。下列有关判断正确的是( )
 A、碳[C(s)]的燃烧热△H = -110.4 kJ·mol-1 B、氧化亚铜与氧气的反应为吸热反应 C、氧化亚铜与氧气反应的活化能为292 kJ·mol-1 D、C(s)+2CuO(s)=Cu2O(s)+CO(g) △H= +35.6 kJ·mol-16. 甲、乙两烧杯中溶液的体积均为20 mL,pH均为13,分别稀释至原体积的100倍后,甲、乙两烧杯中溶液pH的关系正确的是( )
A、碳[C(s)]的燃烧热△H = -110.4 kJ·mol-1 B、氧化亚铜与氧气的反应为吸热反应 C、氧化亚铜与氧气反应的活化能为292 kJ·mol-1 D、C(s)+2CuO(s)=Cu2O(s)+CO(g) △H= +35.6 kJ·mol-16. 甲、乙两烧杯中溶液的体积均为20 mL,pH均为13,分别稀释至原体积的100倍后,甲、乙两烧杯中溶液pH的关系正确的是( ) A、甲<乙 B、甲=乙 C、甲>乙 D、不能确定7. 羟胺(NH2OH)在水溶液中的电离方程式为NH2OH+ H2O=NH3OH++OH-。常温下,向该溶液中加入NaOH固体,下列说法错误的是( )A、平衡常数K减小 B、c(OH-)增大 C、平衡向左移动 D、 增大8. 对于xA(g)+yB(g) zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变成39,则下列说法正确的是( )A、x+y>z+w,正反应是放热反应 B、x+y>z+w,正反应是吸热反应 C、x+y<z+w,逆反应是放热反应 D、x+y>z+w,逆反应是吸热反应9. 在恒容密闭容器中进行反应2CO2(g) +6H2(g) C2H5OH(g)+3H2O(g) △H。 在某压强下起始时按不同氢碳比[ ]投料(如图中曲线①②③),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )
A、甲<乙 B、甲=乙 C、甲>乙 D、不能确定7. 羟胺(NH2OH)在水溶液中的电离方程式为NH2OH+ H2O=NH3OH++OH-。常温下,向该溶液中加入NaOH固体,下列说法错误的是( )A、平衡常数K减小 B、c(OH-)增大 C、平衡向左移动 D、 增大8. 对于xA(g)+yB(g) zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变成39,则下列说法正确的是( )A、x+y>z+w,正反应是放热反应 B、x+y>z+w,正反应是吸热反应 C、x+y<z+w,逆反应是放热反应 D、x+y>z+w,逆反应是吸热反应9. 在恒容密闭容器中进行反应2CO2(g) +6H2(g) C2H5OH(g)+3H2O(g) △H。 在某压强下起始时按不同氢碳比[ ]投料(如图中曲线①②③),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( ) A、该反应的△H>0 B、氢碳比:①<②<③ C、同压时,H2的体积分数:ψa<ψb D、平衡常数:Ka=Kb=Kc10. 氨硼烷( )电池可在常温下工作,装置如图所示。该电池工作时的总反应为 。下列说法正确的是( )
A、该反应的△H>0 B、氢碳比:①<②<③ C、同压时,H2的体积分数:ψa<ψb D、平衡常数:Ka=Kb=Kc10. 氨硼烷( )电池可在常温下工作,装置如图所示。该电池工作时的总反应为 。下列说法正确的是( ) A、正极附近溶液的pH减小 B、电池工作时, 通过质子交换膜向负极移动 C、消耗 氨硼烷,理论上有 电子通过内电路 D、电池负极反应式为11. 根据下列实验操作所得的现象及结论错误的是( )
A、正极附近溶液的pH减小 B、电池工作时, 通过质子交换膜向负极移动 C、消耗 氨硼烷,理论上有 电子通过内电路 D、电池负极反应式为11. 根据下列实验操作所得的现象及结论错误的是( )选项
实验操作
现象及结论
A
将AlCl3溶液加热蒸干并灼烧
得到的白色固体为氧化铝
B
向体积均为25 mL的冷水和沸水中分别滴入5滴FeCl3饱和溶液
前者为黄色,后者为红褐色,说明温度升高,Fe3+的水解程度增大
C
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再给试管加热
溶液颜色变深,说明CH3COONa溶液中存在水解平衡
D
室温下,用pH试纸分别测0.1 mol/L的Na2SO3溶液和0.1 mol/L的NaHSO3溶液的pH
前者 pH约为10,后者pH约为5,说明HSO 结合H+的能力比SO 强
A、A B、B C、C D、D12. 乙醇是重要的有机化工原料,可由乙烯水化法生产,反应的化学方程式如下: C2H4(g)+H2O(g) C2H5OH(g), 下图为乙烯的平衡转化率与温度(T)、压强(p) 的关系[ 起始n(C2H4)∶n(H2O)=1∶1]。下列有关叙述正确的是( ) A、Y 对应的乙醇的物质的量分数为 B、X、Y、Z 对应的反应速率:v(X)>v(Y)>v(Z) C、X、Y、Z 对应的平衡常数数值:KX<KY<KZ D、增大压强、升高温度均可提高乙烯的平衡转化率
A、Y 对应的乙醇的物质的量分数为 B、X、Y、Z 对应的反应速率:v(X)>v(Y)>v(Z) C、X、Y、Z 对应的平衡常数数值:KX<KY<KZ D、增大压强、升高温度均可提高乙烯的平衡转化率二、多选题
-
13. 常温下,有关下列溶液的比较中,正确的是( )
①pH=2的CH3COOH溶液 ②pH=2的 H2SO4溶液 ③pH=12 的氨水 ④pH=12的NaOH溶液
A、由水电离出的c(H+):①=②=③=④ B、将②、④溶液混合后pH=7,消耗溶液的体积:②=④ C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 D、向10 mL上述四种溶液中各加入90 mL水后,溶液的pH:③>④>①>②14. 原子钟是一种精度极高的计时装置,镍氢电池可用于原子钟的制作,某储氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池如下图所示,反应原理为LaNi5H6+6NiO(OH) LaNi5+6NiO+6H2O。 下列有关说法错误的是( ) A、充电时a电极为电池的阳极 B、放电时镍氢电池负极附近碱性增强 C、充电时每转移1mole- , 理论上b电极质量增加17 g D、放电时正极反应为6NiO(OH)+6e-=6NiO+ 6OH-15. 常温下,向25 mL0.12 mol/LAgNO3溶液中逐滴加入一定浓度的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加大氨水的体积V与溶液中lg[c(H+ )/c(OH- )]的关系如图所示。已知e点对应的溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述错误的是( )
A、充电时a电极为电池的阳极 B、放电时镍氢电池负极附近碱性增强 C、充电时每转移1mole- , 理论上b电极质量增加17 g D、放电时正极反应为6NiO(OH)+6e-=6NiO+ 6OH-15. 常温下,向25 mL0.12 mol/LAgNO3溶液中逐滴加入一定浓度的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加大氨水的体积V与溶液中lg[c(H+ )/c(OH- )]的关系如图所示。已知e点对应的溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述错误的是( )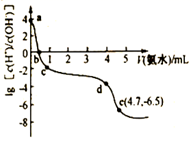 A、a点对应溶液呈酸性的原因是AgNO3水解 B、b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}> c(NO ) C、cd段加人的氨水主要用于沉淀的生成和溶解 D、由e点可知,反应Ag++2NH3 [Ag(NH3)2]+的平衡常数的数量级为105
A、a点对应溶液呈酸性的原因是AgNO3水解 B、b点对应溶液中:c(Ag+)+c{[Ag(NH3)2]+}> c(NO ) C、cd段加人的氨水主要用于沉淀的生成和溶解 D、由e点可知,反应Ag++2NH3 [Ag(NH3)2]+的平衡常数的数量级为105三、综合题
-
16. 某同学欲用物质的量浓度为0.1000mol●L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂。其操作步骤可分为以下几步:
A 移取20.00 mL待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加2~3滴酚酞溶液。
B 用标准溶液润洗滴定管2~3次。
C 把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。
D 取标准盐酸注入酸式滴定管至“0”刻度以上2~3 cm处。
E 调节液面至“0”或“0”以下刻度,记下读数。
F 把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,并记下滴定管液面的刻度。
请填写下列空白:
(1)、正确的操作步骤的顺序是(填字母)。(2)、步骤B操作的目的是 。(3)、配制标准盐酸时,需要用的仪器有(填字母)。a 容量瓶 b 托盘天平 c 量筒 d 酸式滴定管 e 烧杯 f 胶头滴管 g 玻璃棒
(4)、下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是(填字母)。a 开始实验时酸式滴定管尖嘴部分有气泡。在滴定过程中气泡消失
b 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
c 酸式滴定管在装液前未用标准盐酸润洗2~3次
d 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
e 滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(5)、若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为mL。若仰视,会使读数偏 (填“大"或“小")。 (6)、再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是mol/L。
(6)、再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是mol/L。滴定次数
待测溶液的体积/mL
标准酸体积
滴定前的刻度/mL
滴定后的刻度/mL
第一次
10.00
2.34
20. 39
第二次
10.00
3. 20
20.20
第三次
10.00
0.60
17. 80
17. 某可逆反应:2A(g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:实验
序号
时间/min
浓度/mol•L-1
温度/℃
0
10
20
30
40
50
60
1
800
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800
1.0
0.60
0.50
0.50
0.50
0.50
0.50
3
950
1.0
0.40
0.25
0.20
0.20
0.20
0.20
(1)、实验1中,在10~20 min内,以物质A表示的平均反应速率为mol·L-1·min-l , 50min时,v(正)(填“<”“>”或“=”)v(逆)。(2)、0~20 min内,实验2比实验1的反应速率(填“快”或“慢”),其原因可能是。(3)、实验3比实验1的反应速率(填“快”或“慢”),其原因是。18. 电渗析法在物质制备过程中有广泛应用。以石墨为电极,利用三室式电渗析法制备高氯酸、亚氯酸的装置如图所示。 (1)、I.利用三室式电渗析法制备高氯酸(HClO4)。M为高氯酸钠溶液。
(1)、I.利用三室式电渗析法制备高氯酸(HClO4)。M为高氯酸钠溶液。出口B处得到的产品是。
(2)、电解过程中,阳极区附近pH(填“增大”“减小”或“不变”)。(3)、若C1极收集到11.2 L(标准状况)气体,则获得高氯酸mol。(4)、II.利用三室式电渗析法制备亚氯酸(HClO2)。M为NaClO2溶液。ClO 迁移方向是。
(5)、C2极的电极反应式为。(6)、该过程制备的亚氯酸中含有少量氯酸杂质,其主要原因是(用离子方程式表示)。(提示:HClO2是弱酸,HClO3是强酸)19. 下表是几种弱酸常温下的电离平衡常数:化学式
HCOOH
HCN
H2CO3
H2S
电离平衡常数K
1.77×10-4
4. 9×10-10
K1=4.3×10-7 K2=9.1×10-11
K1=5.6×10-8 K2=1.1×10-12
(1)、HCOOH、HCN、H2CO3、H2S的酸性由强到弱的顺序为。(2)、请写出H2S的电离方程式:。(3)、下列四种离子结合H+能力最强的是(填字母)。A HS- B CO C CN- D HCOO-
(4)、相同温度下pH相同的NaCN和HCOOK的两溶液中c(NaCN)(填“>”“<”或“=”,下同)c(HCOOK),[c(Na+ )-c(CN-)][c(K+)-c(HCOO-)]。(5)、在25 mL 0.1 mol/LNaOH溶液中逐滴加入0.2 mol/LHCOOH溶液,溶液的pH变化曲线如下图所示,请回答下列问题:
①若使加入的HCOOH恰好把NaOH溶液完全中和,则加入HCOOH溶液的体积为。
②B点时溶液呈(填“酸性”“碱性”或“中性”),此时溶液中含有的溶质有。
③在C点所得的混合溶液中,c(Na+)、c(HCOO-)、c(H+)、c(OH-)由大到小的顺序是。
20.(1)、25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:热化学方程式
平衡常数
①
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) ΔH1=a kJ∙mol-1
K1
②
4NO2(g)+2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ∙mol-1
K2
③
2NO(g)+Cl2(g) 2NOCl(g) ΔH3
K3
则该温度下,ΔH3=kJ∙mol-1;K3=(用K1和K2表示)。
(2)、25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 (填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是;在5 min时,再充入0.08 mol NO和0.04 molCl2 , 则混合气体的平均相对分子质量将(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是(填“甲”或“乙”),a值为。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正v逆(填“>”“<”或“=”)
 (3)、在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)、在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。