高中化学人教版(2019)选择性必修1第四章实验活动4简单的电镀实验
试卷更新日期:2021-08-27 类型:同步测试
一、单选题
-
1. 电镀废液中 可通过下列反应转化成铬黄 : ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
A、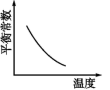 B、
B、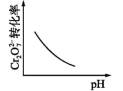 C、
C、 D、
D、 2. 利用如图所示装置模拟电解原理在工业生产中的应用,下列说法正确的是( )
2. 利用如图所示装置模拟电解原理在工业生产中的应用,下列说法正确的是( )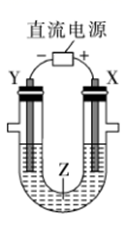 A、氯碱工业中,X电极上的反应式是4OH--4e-=2H2O+O2↑ B、电解精炼铜时,Z溶液中的Cu2+浓度不变 C、在铁片上镀铜时,每转移2mol电子,Y极增重64g D、制取金属铝时,Z是熔融的氯化铝3. 利用如图所示装置(示意图),当X、Y选用不同材料时,可将电解原理广泛用于工业生产。下列说法中错误的是( )
A、氯碱工业中,X电极上的反应式是4OH--4e-=2H2O+O2↑ B、电解精炼铜时,Z溶液中的Cu2+浓度不变 C、在铁片上镀铜时,每转移2mol电子,Y极增重64g D、制取金属铝时,Z是熔融的氯化铝3. 利用如图所示装置(示意图),当X、Y选用不同材料时,可将电解原理广泛用于工业生产。下列说法中错误的是( )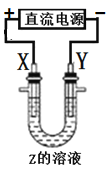 A、氯碱工业中,Y附近能得到氢氧化钠溶液 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,Y是待镀金属,X是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属4. 下列说法错误的是( )A、燃煤发电和潮汐发电均是将化学能转化为电能 B、电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法 C、铁表面镀锌时,铁作阴极 D、使用植物秸秆转化而来的乙醇为燃料,不会额外增加大气中 的含量5. 下列有关说法正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行保护 B、铜锌原电池中,盐桥中的 和 分别移向负极和正极 C、铅蓄电池放电时负极质量减轻,充电时阳极质量增加 D、在铁片上镀锌时,将铁片与电源的正极相连6. 下列描述中,不符合生产实际的是( )A、电解熔融的氧化铝制取金属铝 B、电解法精炼粗铜,用粗铜作阴极 C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D、在镀件上电镀锌,用锌作阳极7. 下列各图所示装置能达到实验目的的是( )
A、氯碱工业中,Y附近能得到氢氧化钠溶液 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,Y是待镀金属,X是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属4. 下列说法错误的是( )A、燃煤发电和潮汐发电均是将化学能转化为电能 B、电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法 C、铁表面镀锌时,铁作阴极 D、使用植物秸秆转化而来的乙醇为燃料,不会额外增加大气中 的含量5. 下列有关说法正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行保护 B、铜锌原电池中,盐桥中的 和 分别移向负极和正极 C、铅蓄电池放电时负极质量减轻,充电时阳极质量增加 D、在铁片上镀锌时,将铁片与电源的正极相连6. 下列描述中,不符合生产实际的是( )A、电解熔融的氧化铝制取金属铝 B、电解法精炼粗铜,用粗铜作阴极 C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D、在镀件上电镀锌,用锌作阳极7. 下列各图所示装置能达到实验目的的是( )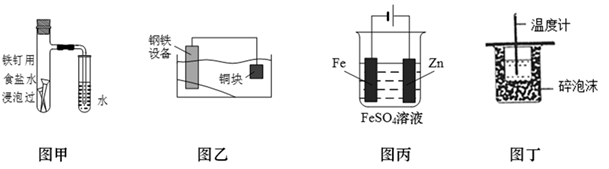 A、图甲,验证铁的吸氧腐蚀 B、图乙,保护水体中的钢铁设备 C、图丙,在铁制品表面镀锌 D、图丁,测定中和热8. 如下图所示,某同学设计了一个燃料电池并探究铜的精炼原理和电镀原理。下列说法正确的是( )
A、图甲,验证铁的吸氧腐蚀 B、图乙,保护水体中的钢铁设备 C、图丙,在铁制品表面镀锌 D、图丁,测定中和热8. 如下图所示,某同学设计了一个燃料电池并探究铜的精炼原理和电镀原理。下列说法正确的是( )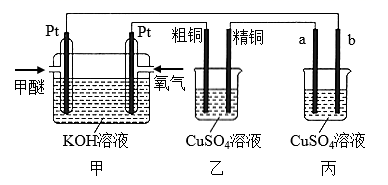 A、一段时间后,甲装置中溶液 pH升高 B、电解一段时间后,乙、丙装置中 CuSO4溶液的浓度均不变 C、通入氧气的一极为正极,发生的电极反应为 D、丙装置中实现铁片上镀铜,b 应为铁片9. 若在铜片上镀银时,下列叙述正确的是( )
A、一段时间后,甲装置中溶液 pH升高 B、电解一段时间后,乙、丙装置中 CuSO4溶液的浓度均不变 C、通入氧气的一极为正极,发生的电极反应为 D、丙装置中实现铁片上镀铜,b 应为铁片9. 若在铜片上镀银时,下列叙述正确的是( )①将铜片接在电池的正极上 ②将银片接在电源的正极上 ③需用CuSO4溶液作电解液 ④在银片上发生的反应是4OH--4e-=O2↑+2H2O ⑤需用AgNO3溶液作电解液 ⑥在铜片上发生的反应是Ag++e-=Ag
A、①③⑥ B、②⑤⑥ C、①④⑤⑥ D、②③④⑥10. 若要在铁钉上镀铜,下列设计正确的是( )选项
接电源正极
接电源负极
电解质溶液
A
Cu
Fe
CuSO4溶液
B
Cu
Fe
FeSO4溶液
C
Fe
Cu
CuSO4溶液
D
Fe
Cu
FeSO4溶液
A、A B、B C、C D、D二、综合题
-
11. 采用如图所示装置模拟工业生产。已知:钾离子交换摸只让钾离子通过分子及其它离子均不能通过。
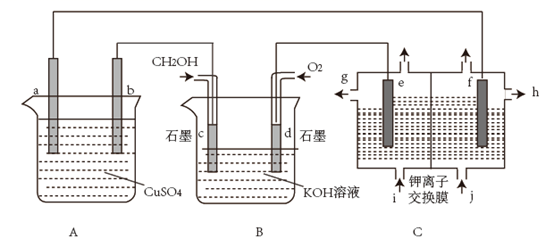
回答下列问题:
(1)、若在A池中实现铁上镀铜,b电极的电极材料为。(2)、若A池中a、b电极材料均为惰性电极,电解一段时间后,两极均有气体产生,则向溶液中加入(填化学式固体可以使溶液恢复到电解前的情况。(3)、B池中,c电极为极(填“正”或“负”),电极反应式为。(4)、若在C池中用 溶液制取 溶液和氯气,高浓度的 溶液从口出(填图中字母),当d电极消耗标准状况下 时,C池中阳极室溶液质量减少g。12. 按要求回答下列问题。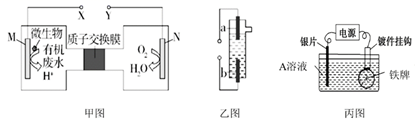 (1)、甲图是一种利用微生物将有机废水中的有机物质转化为环境友好物质的原电池装置,若有机废水中主要含有甲醛(HCHO),则装置甲中M极发生的电极反应为。当有300mg的甲醛参与反应时,通过质子交换膜的H+为mol。(2)、乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。装置乙中的b极要与装置甲的极(填“X”或“Y”)连接,该电极的电极反应式为。(3)、丙图是一种可以在铁牌表面电镀一层银的电镀装置,装置丙中的A溶液为 , 电镀一段时间后A溶液浓度(填“变大”、“变小”或“不变”)。13. 电镀行业产生的酸性含铬废水对环境有污染,其中所含的+6价铬(以Cr2O 形式存在)是主要污染物,可采用电解法将其除去。向酸性含铬废水中加入适量NaCl固体,以Fe为阴、阳电极进行电解。经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,从而使废水中铬含量低于排放标准。装置如图所示。
(1)、甲图是一种利用微生物将有机废水中的有机物质转化为环境友好物质的原电池装置,若有机废水中主要含有甲醛(HCHO),则装置甲中M极发生的电极反应为。当有300mg的甲醛参与反应时,通过质子交换膜的H+为mol。(2)、乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。装置乙中的b极要与装置甲的极(填“X”或“Y”)连接,该电极的电极反应式为。(3)、丙图是一种可以在铁牌表面电镀一层银的电镀装置,装置丙中的A溶液为 , 电镀一段时间后A溶液浓度(填“变大”、“变小”或“不变”)。13. 电镀行业产生的酸性含铬废水对环境有污染,其中所含的+6价铬(以Cr2O 形式存在)是主要污染物,可采用电解法将其除去。向酸性含铬废水中加入适量NaCl固体,以Fe为阴、阳电极进行电解。经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,从而使废水中铬含量低于排放标准。装置如图所示。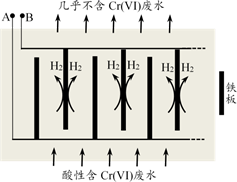
已知:pH=3.2时Fe3+完全转化为Fe(OH)3;pH=5.6时Cr3+完全转化为Cr(OH)3
(1)、向酸性含铬废水中加入适量NaCl固体的作用是。(2)、B极上有大量氢气产生,电极反应为。(3)、结合化学用语分析酸性废水中Cr2O 转化为Cr(OH)3的主要原因。14. Ni常被镀在金属制品上以保护金属不生锈。(1)、镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。①待镀零件与电源相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)Ni2++H2PO2-+→Ni ++H2PO3-+ ,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。
(2)、LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2 , 该反应的化学方程式为 , 加热温度不宜过高的原因是 , 工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是。(3)、以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Al(OH)3]=1.0×10-33 , Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii.(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?(列式计算,并使用必要的文字说明)。
15. 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的 溶液、 溶液、x溶液,a、b、c、d电极均为石墨电极,接通电源经过一段时间后,乙中c电极质量增加,据此回答问题: (1)、电源的M端为极;(填名称)(2)、电极d上发生的电极反应式为 , 乙池溶液 (填“增大”、“减小”或“不变”)(3)、甲池中的总反应式为;(4)、当电路中有 电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是;(5)、若利用丙池实现铁上镀铜,则e、f、x依次是(填化学式);若利用丙池实现电解精炼铜,则f电极材料是(填具体物质);(6)、实验测得, 甲醇 液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出 的热量,则表示甲醇燃烧热的热化学方程式为:16. 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
(1)、电源的M端为极;(填名称)(2)、电极d上发生的电极反应式为 , 乙池溶液 (填“增大”、“减小”或“不变”)(3)、甲池中的总反应式为;(4)、当电路中有 电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是;(5)、若利用丙池实现铁上镀铜,则e、f、x依次是(填化学式);若利用丙池实现电解精炼铜,则f电极材料是(填具体物质);(6)、实验测得, 甲醇 液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出 的热量,则表示甲醇燃烧热的热化学方程式为:16. 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
请按要求回答相关问题:
(1)、甲烷燃料电池负极电极反应式是:。(2)、乙中X是交换膜,工作一段时间后若要恢复成原溶液,应。(3)、欲用丙装置给铜镀银,b应是(填化学式)。(4)、若乙池中的饱和氯化钠溶液换成一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为mol。(忽略溶液体积的变化)(5)、通过膜电池可除去废水中的乙酸钠和对氯苯酚(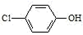 ),其原理如图所示,A极的电极反应为。
),其原理如图所示,A极的电极反应为。  (6)、化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3-的原理如图所示。
(6)、化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3-的原理如图所示。
①Ag-Pt电极上的电极反应式为。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为g。