高中化学人教版(2019)选择性必修1第四章第3节金属的腐蚀与防护
试卷更新日期:2021-08-27 类型:同步测试
一、单选题
-
1. 化学知识无处不在,下列家务劳动涉及的化学知识错误的是( )
选项
家务劳动
化学知识
A
将切过咸菜的钢制刀具洗净并擦干
减缓钢铁的电化学锈蚀
B
给花木施肥时,草木灰不与硝酸铵共施
草木灰与硝酸铵反应造成肥效降低
C
用温热的纯碱溶液清洗厨具油污
油脂在热的纯碱溶液中更易发生水解
D
用富含淀粉的谷物酿酒
淀粉水解为葡萄糖后再氧化为乙醇
A、A B、B C、C D、D2. 下列装置能达成相应实验目的的是( )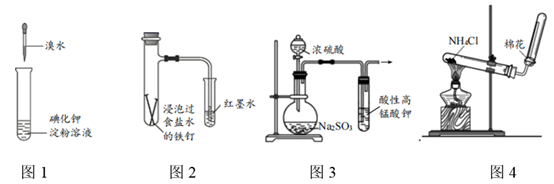 A、图1:比较溴与碘的非金属性强弱 B、图2:探究铁钉的析氢腐蚀 C、图3:验证二氧化硫的漂白性 D、图4:制备并收集氨气3. 下列说法正确的是( )A、麒麟9905G芯片己正式发布,其主要成分为SiO2 B、碳酸钠能与盐酸反应,可用于治疗胃酸过多 C、在船身上装有锌块,是利用了牺牲阳极的阴极保护法保护船体 D、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒4. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。下列说法错误的是( )
A、图1:比较溴与碘的非金属性强弱 B、图2:探究铁钉的析氢腐蚀 C、图3:验证二氧化硫的漂白性 D、图4:制备并收集氨气3. 下列说法正确的是( )A、麒麟9905G芯片己正式发布,其主要成分为SiO2 B、碳酸钠能与盐酸反应,可用于治疗胃酸过多 C、在船身上装有锌块,是利用了牺牲阳极的阴极保护法保护船体 D、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒4. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。下列说法错误的是( )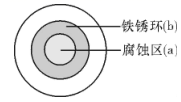 A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)35. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)35. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。①
②
③
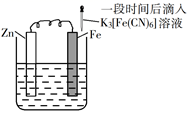
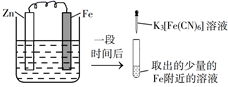
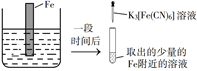
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法错误的是( )
A、对比②③,可以判定Zn保护了Fe B、对比①②,K3[Fe(CN)6]可能将Fe氧化 C、验证Zn保护Fe时不能用①的方法 D、将Zn换成Cu,用①的方法可判断Fe比Cu活泼6. 下列事实能用勒夏特列原理解释的是( )A、铜与浓硫酸反应需要加热 B、加热蒸干FeCl3溶液最终得到Fe(OH)3 C、使用催化剂提高合成氨的生产效率 D、钢管与铜管堆放一处,钢管更易腐蚀7. 化学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )A、碳酸钠可用于制作糕点的膨松剂,是因为加热能分解出二氧化碳 B、电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极的阴极保护法 C、含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O D、高纯铝被大量用于制造火箭、导弹和飞机的外壳8. 下列实验操作符合题意且能达到相应实验目的的是( )实验目的
实验操作
A
称取2.0gNaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
配制FeCl3溶液
将FeCl3固体溶解于适量蒸馏水
C
检验溶液中是否含有NH4+
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A、A B、B C、C D、D9. 对金属腐蚀及防护的表述正确的是( )A、金属腐蚀的本质:金属失电子发生还原反应 B、牺牲阳极的阴极保护法:被保护的金属应做负极 C、外加电流阴极保护法:被保护的金属应与电源正极相连 D、钢铁表面烤蓝生成一层致密的 ,能起到防腐蚀作用10. 锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法错误的是( )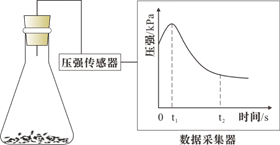 A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性11. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( )
A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性11. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( ) A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大12. 港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是( )A、越靠近海底的钢构件,腐蚀越严重 B、钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C、钢构件若腐蚀,正极反应式为:Fe-2e-=Fe2+ D、钢构件表面喷涂环氧树脂涂层,防止形成电解池13. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )
A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大12. 港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是( )A、越靠近海底的钢构件,腐蚀越严重 B、钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C、钢构件若腐蚀,正极反应式为:Fe-2e-=Fe2+ D、钢构件表面喷涂环氧树脂涂层,防止形成电解池13. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )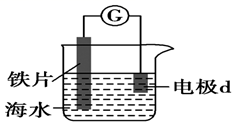 A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑14. 下列有关物质在生活中应用的说法正确的是( )A、暖宝宝中的铁粉、活性炭、水等物质与空气接触会发生电化学反应 B、含维生素C的食物宜在空气中长时间加热后食用 C、酒精的浓度越高,消毒杀菌效果越好 D、将废旧电池埋入土里,可防止重金属对环境造成污染15. 在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,厌氧细菌可促使土壤中的 与H2反应生成S2- , 加速钢管的腐蚀,其反应原理如下图所示。
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑14. 下列有关物质在生活中应用的说法正确的是( )A、暖宝宝中的铁粉、活性炭、水等物质与空气接触会发生电化学反应 B、含维生素C的食物宜在空气中长时间加热后食用 C、酒精的浓度越高,消毒杀菌效果越好 D、将废旧电池埋入土里,可防止重金属对环境造成污染15. 在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,厌氧细菌可促使土壤中的 与H2反应生成S2- , 加速钢管的腐蚀,其反应原理如下图所示。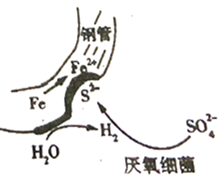
下列说法正确的是( )
A、正极的电极反应式为:2H2O+O2+4e-=4OH- B、钢管腐蚀的直接产物中含有FeS、Fe(OH)2 C、在钢管表面镀锌或镀铜均可减缓钢管的腐蚀 D、 与H2的反应可表示为:4H2+ -8e- S2-+4H2O二、多选题
-
16. 在缺乏氧气的深层潮湿土壤中存在的硫酸盐还原菌,会附着在钢管表面促进钢铁的腐蚀,这个过程被称为厌氧腐蚀,其反应原理如图所示,下列说法正确的是( )
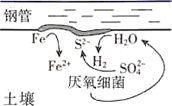 A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀17. 下列有关说法正确的是( )A、一定条件下反应2SO2+O2 2SO3达到平衡时,v(O2)正=2v(SO3)逆 B、用右图所示方法可保护钢闸门不被腐蚀
A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀17. 下列有关说法正确的是( )A、一定条件下反应2SO2+O2 2SO3达到平衡时,v(O2)正=2v(SO3)逆 B、用右图所示方法可保护钢闸门不被腐蚀 C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大
D、常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
18. 下列说法正确的是( )A、船舶防腐时,船体上加装的阳极锌需定期更换 B、合成氨反应中使用高效催化剂可提高原料转化率 C、将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深
C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大
D、常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
18. 下列说法正确的是( )A、船舶防腐时,船体上加装的阳极锌需定期更换 B、合成氨反应中使用高效催化剂可提高原料转化率 C、将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深 D、等体积、等浓度NaOH溶液和CH3COOH溶液混合后溶液pH=7
D、等体积、等浓度NaOH溶液和CH3COOH溶液混合后溶液pH=7
三、填空题
-
19. 我国材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出了杰出贡献,荣获2010年度国家最高科学技术奖.
①合金是生活中常见的材料.某合金具有密度小、强度高的优良性能,常用于制造门窗框架.该合金中含量最高的金属元素的原子结构示意图为 .
②铁锈的主要成分是(填化学式),它是钢铁在潮湿的空气中发生腐蚀的结果.
③玻璃是一种常用的硅酸盐材料.制备普通玻璃的原料有Na2CO3、和(填化学式).
20. 利用如图装置,可以模拟铁的电化学防护.若X为铜,为减缓铁的腐蚀,开关K应置于 处.铁棒上发生的电极反应为 , 该种防护方法称为若X为锌棒,开关K置于处,铁棒上的电极反应为该电化学防护法称为 .

四、实验探究题
-
21. 某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。(1)、同学们利用下表中装置进行实验并记录。
装置
编号
电极A
溶液B
操作及现象
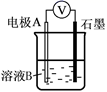
Ⅰ
Fe
pH=2的H2SO4
连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ
Cu
pH=2的H2SO4
连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
(2)、同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。编号
溶液B
操作及现象
Ⅲ
经煮沸的pH=2的 H2SO4
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ
pH=2的H2SO4
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ
pH=12的NaOH
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。
22. 某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:实验①:取A样品,加过量稀硝酸完全溶解后,再加入 溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
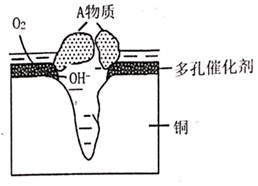 (1)、该粉状锈中除了铜元素外还含有(写元素符号)元素,该铜制品发生电化学腐蚀生成粉状锈时其正极电极反应式为。(2)、写出该粉状锈溶于稀硫酸反应的离子方程式。(3)、加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为。
(1)、该粉状锈中除了铜元素外还含有(写元素符号)元素,该铜制品发生电化学腐蚀生成粉状锈时其正极电极反应式为。(2)、写出该粉状锈溶于稀硫酸反应的离子方程式。(3)、加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为。五、综合题
-
23. 按要求回答问题:(1)、以 和 为电极,稀 为电解质溶液形成的原电池中:
① 向极移动(填“正”或“负”)。
②若有 流过导线,则理论上负极质量减少g。
③若将稀硫酸换成浓硝酸,其负极的电极方程式为:。
(2)、氢气是未来最理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水时,实现了从太阳能转变为化学能。生成的氢气用于燃料电池时,实现化学能转变为电能。分解海水的反应属于(填“放热”或“吸热”)反应。(3)、有人以化学反应: 为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的 进行工作。则原电池的负极材料是锌,发生的电极反应为。(4)、常温下,暴露在空气中的生铁容易发生吸氧腐蚀,请写出正极的电极反应式。24. 金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题: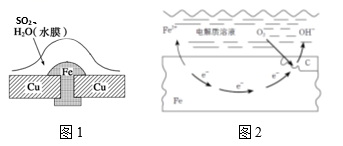 (1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。
(1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)、图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理。(3)、图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 , 负极反应为 , 总反应为。(4)、下列防止铁制品生锈的措施合理的是__________。A、在铁闸门表面涂油漆 B、在地下铁管道上安装若干镁合金 C、将铁罐与浓硫酸等强氧化剂接触,使之发生钝化25. 炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:(1)、铁锅的锈蚀应属于腐蚀。(2)、铁锅锈蚀的电极反应式为:负极:;正极:。正负极反应产物会继续发生反应,反应的离子方程式 , 化学方程式为。26. 电化学原理被广泛地应用于生产、生活的许多方面。(1)、I.制备氯气工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

此过程中能量转化形式为转化为(填“化学能”或“电能”)
(2)、电极乙为(填“阴极”或“阳极”),A 口生成的气体是(3)、电解饱和食盐水的离子方程式是(4)、下列有关氯气的说法中正确的是a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
(5)、II.金属防护某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

被腐蚀的是包裹的铁钉(填“锌片”或“铜片”)
(6)、结合电极反应式解释 i 中现象产生的原因(7)、结合以上实验,请对铁制零件的使用提出建议