高中化学人教版(2019)选择性必修1第三章实验活动3盐类水解的应用
试卷更新日期:2021-08-27 类型:同步测试
一、单选题
-
1. 下列说法不正确的是( )A、Ksp只与难溶电解质的性质和温度有关 B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 C、其他条件不变,离子浓度改变时,Ksp不变 D、两种难溶电解质作比较时,Ksp小的,溶解度一定小2. 某硫酸盐在水中的沉淀溶解平衡曲线如下(M2+代表+2价金属离子)。下列说法正确的是( )
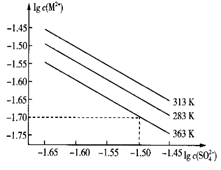 A、363 K时,该硫酸盐的溶度积Ksp的数量级为10-3 B、温度一定时溶度积Ksp随c( )的增大而减小 C、313 K下的该盐饱和溶液升温到363 K时有固体析出 D、283 K下的该盐饱和溶液升温到313 K时有固体析出3. 下列有关沉淀溶解平衡的说法正确的是( )A、某离子被沉淀完全是指该离子在溶液中的浓度为0 B、在Agl的沉淀溶解平衡体系中,加入K2S固体,Agl沉淀可转化为Ag2S沉淀 C、在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的KaP增大 D、在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动4. t℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知: , , 。
A、363 K时,该硫酸盐的溶度积Ksp的数量级为10-3 B、温度一定时溶度积Ksp随c( )的增大而减小 C、313 K下的该盐饱和溶液升温到363 K时有固体析出 D、283 K下的该盐饱和溶液升温到313 K时有固体析出3. 下列有关沉淀溶解平衡的说法正确的是( )A、某离子被沉淀完全是指该离子在溶液中的浓度为0 B、在Agl的沉淀溶解平衡体系中,加入K2S固体,Agl沉淀可转化为Ag2S沉淀 C、在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的KaP增大 D、在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动4. t℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知: , , 。
下列说法正确的是( )
A、线a表示YCO3的溶解平衡曲线 B、 C、t℃时,向XCO3悬浊液中加入饱和 溶液,可能有YCO3生成 D、t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀5. 一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp = cm(An+)·cn(Bm−),称为难溶电解质的溶度积。已知下表数据:物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25℃)
8.0×10−16
2.2×10−20
4.0×10−38
完全沉淀时的pH范围
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A、向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 B、该溶液中c(SO42−)∶[c(Cu2+)+c(Fe2+)+ c(Fe3+)]>5∶4 C、向该溶液中加入适量氯水,并调节pH到3〜4后过滤,可获得纯净的CuSO4溶液 D、在pH=5的溶液中Fe3+不能大量存在6. 已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12 , Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mol·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是() A、原AgNO3溶液的物质的量浓度为0.1mol·L-1 B、图中x点表示溶液中Ag+恰好完全沉淀 C、图中x点的坐标为(10,6) D、若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分7. 在含有浓度均为0.01mol•L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是( )A、AgCl、AgBr、AgI B、AgI、AgBr、AgCl C、AgBr、AgCl、AgI D、三种沉淀同时析出
A、原AgNO3溶液的物质的量浓度为0.1mol·L-1 B、图中x点表示溶液中Ag+恰好完全沉淀 C、图中x点的坐标为(10,6) D、若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分7. 在含有浓度均为0.01mol•L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是( )A、AgCl、AgBr、AgI B、AgI、AgBr、AgCl C、AgBr、AgCl、AgI D、三种沉淀同时析出二、实验探究题
-
8. 三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3 , 实验装置设计如下:
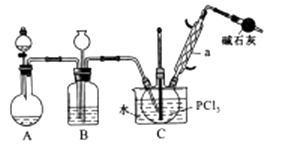
有关物质的部分性质如下表:
熔点/℃
沸点/℃
其他
PCl3
-112
75.5
遇水生成H3PO3和HCl,遇O2生成POCl3
POCl3
2
105.3
遇水生成H3PO4和HCl,能溶于PCl3
回答下列问题:
(1)、仪器a的名称是 , 装置A中发生反应的化学方程式为。(2)、B装置的作用除观察O2的流速之外。还有。(3)、C装置控制反应在60℃~65℃进行,其主要目的是。(4)、通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填标号),滴定终点的现象为。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式)。
③步骤III加入硝基苯的目的是 , 如无此操作,所测Cl元素含量将会(填“偏大”“偏小”或“不变”)。
9. 氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。 (1)、过程i中H2S发生了 (选填“氧化”或“还原”)反应。(2)、过程ⅱ的离子方程式是。(3)、已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
(1)、过程i中H2S发生了 (选填“氧化”或“还原”)反应。(2)、过程ⅱ的离子方程式是。(3)、已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。

请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:。
(4)、Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
①该过程的热化学方程式是。
②比较压强p1和p2的大小关系:p1 p2(选填“>”“<”或“=”)。
(5)、Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。Ⅳ.H2提纯:将CO2和H2分离得到H2的过程示意图如下。

①吸收池中发生反应的离子方程式是 。
②结合电极反应式,简述K2CO3溶液的再生原理:。
三、综合题
-
10. 用软锰矿(主要成分为MnO2 , 所含杂质为质量分数约8%Fe3O4和约5%Al2O3)和BaS制备高纯MnCO3 , 同时制得Ba(OH)2 , 工艺流程如下:
 已知:25℃时相关物质的Ksp见下表
已知:25℃时相关物质的Ksp见下表物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
回答下列问题:
(1)、MnO2与BaS溶液反应转化为MnO的化学方程式为 , 能否通过加热的方式加快该反应的速率,(填“能”或“否”)(2)、保持BaS投料量不变,随软锰矿粉与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是。(3)、在实验室进行过滤操作时,除了使用铁架台和烧杯以外,还需要的玻璃仪器为。(4)、净化时需先加入的试剂X为(填化学式) 。再使用氨水调溶液的pH,则pH的理论最小值为(当溶液中某离子浓度小于1.0×10-5mol•L-1时,可认为该离子沉淀完全)。(5)、碳化过程中发生反应的离子方程式为。11. 下表是25℃时三种弱酸的电离平衡常数化学式
HA(A代表某种酸根)
HNO2
H2CO3
Ka
Ka=4.9´10-10
Ka=4.6´10-4
Ka1=4.1´10-7
Ka2=5.6´10-11
(1)、用离子方程式表示NaNO2溶液呈碱性的原因。(2)、NaHCO3的电离方程式是。(3)、A-、CO 、HCO 在水中结合H+的能力由大到小的顺序为。(4)、写出NaA溶液中通少量CO2的离子方程式。(5)、某同学用Na2CO3和NaHCO3溶液进行如下图所示实验。
①充分反应后a试管中大量存在的离子是。
②用离子方程式表示b试管中发生的反应。