高中化学人教版(2019)选择性必修1第三章第三节盐类的水解
试卷更新日期:2021-08-27 类型:同步测试
一、单选题
-
1. 下列物质的水溶液因水解而呈碱性的是( )A、Na2CO3 B、AlCl3 C、Ca(OH)2 D、NaNO32. 常温下,将 溶液滴入 溶液的过程中,溶液中由水电离出的 与加入NaOH溶液体积的关系如图所示。下列说法正确的是( )
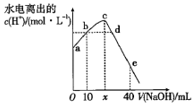 A、 ,a点的纵坐标为 B、b点和d点所示溶液的pH相等 C、滴定过程中, 的比值逐渐增大 D、e点所示溶液中,3. 下列方程式不正确的是( )A、乙烯与溴水化学方程式: B、乙醇在铜催化下氧化: C、氯化铵水解的离子方程式: D、碳酸氢钠在水中的电离方程式:4. 下列说法正确的是( )A、常温下某醋酸溶液的 ,将溶液稀释到原体积的 倍,则溶液的 B、某强碱弱酸盐NaA溶液,随温度升高,pH一定变小 C、 的盐酸和 的醋酸以体积比1∶10混合后,溶液pH仍为2 D、等浓度等体积的 和NaClO溶液中离子总数,前者小于后者5. 下列实验操作、现象及结论都正确的是( )
A、 ,a点的纵坐标为 B、b点和d点所示溶液的pH相等 C、滴定过程中, 的比值逐渐增大 D、e点所示溶液中,3. 下列方程式不正确的是( )A、乙烯与溴水化学方程式: B、乙醇在铜催化下氧化: C、氯化铵水解的离子方程式: D、碳酸氢钠在水中的电离方程式:4. 下列说法正确的是( )A、常温下某醋酸溶液的 ,将溶液稀释到原体积的 倍,则溶液的 B、某强碱弱酸盐NaA溶液,随温度升高,pH一定变小 C、 的盐酸和 的醋酸以体积比1∶10混合后,溶液pH仍为2 D、等浓度等体积的 和NaClO溶液中离子总数,前者小于后者5. 下列实验操作、现象及结论都正确的是( )选项
实验操作
现象
结论
A
将Fe(NO3)2样品溶于足量的H2SO4溶液中,再滴加少量的KSCN溶液
溶液不变红
溶液中一定没有Fe3+
B
向滴加酚酞的氨水中加蒸馏水稀释
溶液红色变浅
溶液中所有离子浓度均减小
C
向Na2CO3稀溶液中逐滴滴入同浓度、同体积的水杨酸(
 )溶液,边滴加边振荡
)溶液,边滴加边振荡无气体产生
电离常数:K1(碳酸)>K2(水杨酸)
D
取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液
无淡黄色沉淀
CH3CH2Br没有水解
A、A B、B C、C D、D6. 下列实验操作、现象及得出的结论均正确的是( )选项
实验操作
实验现象
实验结论
A
向Na2S溶液中滴加盐酸
产生臭鸡蛋气味气体
非金属性:Cl>S
B
将相同大小的金属钠分别投入乙醇和水中
乙醇与钠反应缓慢,水与钠反应剧烈
乙醇羟基中的氢原子不如水分子中的氢原子活泼
C
白铁皮镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液
无明显现象
该过程未发生氧化还原反应
D
室温下,用pH试纸分别测定浓度均为0.1mol/L的Na2CO3和NaHSO3两种溶液的pH
pH:Na2SO3>NaHSO3
HSO 结合H+能力比SO 的强
A、A B、B C、C D、D7. 25℃时,下列说法正确的是( )A、NaHA溶液呈酸性,可以推测H2A为强酸 B、可溶性正盐BA溶液呈中性,可以推测BA为强酸强碱盐 C、0.010 mol·L-1、0.10mol·L-1的醋酸溶液的电离度分别为α1、α2 , 则α1<α2 D、100 mL pH=10.00的Na2CO3溶液中水电离出H+的物质的量为1.0×10-5mol8. 实验测得 10 mL 0. 50 mol•L -1NH4Cl溶液、10 mL 0. 50 mol•L -1CH3COONa溶液的pH分别随温度与稀释加水量的变化如图所示。已知25℃时CH3COOH和NH3•H2O的电离常数均为1. 8×10-5.下列说法错误的是( )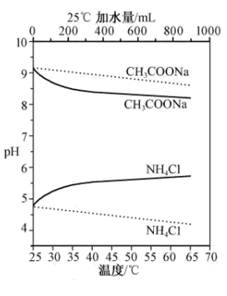 A、加水稀释初期两种盐的水解率变化程度比稀释后期大 B、图中虚线表示pH随加水量的变化,实线表示pH随温度的变化 C、将NH4Cl溶液加水稀释至浓度 mol・L-1溶液pH变化值小于lgx D、将稀释相同倍数的NH4Cl与CH3COONa溶液混合,混合液中 c(CH3COO-)= c(NH )9. 常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
A、加水稀释初期两种盐的水解率变化程度比稀释后期大 B、图中虚线表示pH随加水量的变化,实线表示pH随温度的变化 C、将NH4Cl溶液加水稀释至浓度 mol・L-1溶液pH变化值小于lgx D、将稀释相同倍数的NH4Cl与CH3COONa溶液混合,混合液中 c(CH3COO-)= c(NH )9. 常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( ) A、曲线①代表φ(NH ),曲线②代表φ(NH3·H2O) B、a点溶液中存在c(Cl-)>c(NH )=c(NH3·H2O) C、NH3·H2O的电离常数的数量级为10-4 D、应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色10. 下列实验设计及其对应的离子方程式均正确的是( )A、过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O C、用惰性电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- D、室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+11. 25℃时,下列说法正确的是( )A、向Na2C2O4溶液中加水,溶液中所有离子浓度都减小 B、pH=3的醋酸溶液和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍 C、浓度均为 的三种溶液:NaClO、 、 pH依次增大 D、pH=2的HA溶液和 的MOH溶液等体积混合后,恰好完全反应,则HA为强酸12. 将体积为 的某一元强酸溶液与体积为 的某一元碱溶液混合,恰好完全反应。则以上两溶液中一定相等的是( )A、溶质物质的量 B、溶液质量 C、 和 的物质的量 D、物质的量浓度13. 土壤中游离 越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用( )A、硫酸亚铁 B、硝酸钾 C、碳酸钾 D、氯化铵14. 下列溶液敞口放置后,pH一定能增大的是( )A、浓醋酸 B、酸雨样品 C、漂粉精溶液 D、石灰水15. 下列物质的水溶液因水解而呈碱性的是( )A、NH3 B、Na2S C、KOH D、NH4Cl16. 下列应用与盐类水解无关的是( )A、泡沫灭火器 B、漂粉精消毒杀菌 C、纯碱去油污 D、草木灰不宜与铵态氮肥混合使用17. 对室温下 的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A、曲线①代表φ(NH ),曲线②代表φ(NH3·H2O) B、a点溶液中存在c(Cl-)>c(NH )=c(NH3·H2O) C、NH3·H2O的电离常数的数量级为10-4 D、应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色10. 下列实验设计及其对应的离子方程式均正确的是( )A、过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O C、用惰性电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- D、室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+11. 25℃时,下列说法正确的是( )A、向Na2C2O4溶液中加水,溶液中所有离子浓度都减小 B、pH=3的醋酸溶液和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍 C、浓度均为 的三种溶液:NaClO、 、 pH依次增大 D、pH=2的HA溶液和 的MOH溶液等体积混合后,恰好完全反应,则HA为强酸12. 将体积为 的某一元强酸溶液与体积为 的某一元碱溶液混合,恰好完全反应。则以上两溶液中一定相等的是( )A、溶质物质的量 B、溶液质量 C、 和 的物质的量 D、物质的量浓度13. 土壤中游离 越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用( )A、硫酸亚铁 B、硝酸钾 C、碳酸钾 D、氯化铵14. 下列溶液敞口放置后,pH一定能增大的是( )A、浓醋酸 B、酸雨样品 C、漂粉精溶液 D、石灰水15. 下列物质的水溶液因水解而呈碱性的是( )A、NH3 B、Na2S C、KOH D、NH4Cl16. 下列应用与盐类水解无关的是( )A、泡沫灭火器 B、漂粉精消毒杀菌 C、纯碱去油污 D、草木灰不宜与铵态氮肥混合使用17. 对室温下 的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )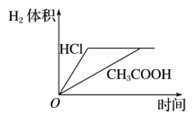 A、加水稀释至溶液体积为 ,醋酸溶液的 变为4 B、温度都升高 后,两溶液的 不再相等 C、加水稀释至溶液体积为 后,两种溶液中 都减小 D、加足量的锌充分反应后,两溶液中产生的氢气体积可用如图表示18. 下列事实能用同一原理解释的是( )A、向NaHCO3溶液中加入AlCl3溶液或NaAlO2溶液,均生成白色沉淀 B、向BaCl2溶液中通入SO2 , 再加入氯水或氨水,均产生白色沉淀 C、向蛋白质溶液中加入饱和NaCl或BaCl2溶液,均产生白色沉淀 D、用洁净铂丝分别蘸取烧碱或纯碱在外焰上灼烧,火焰均呈黄色
A、加水稀释至溶液体积为 ,醋酸溶液的 变为4 B、温度都升高 后,两溶液的 不再相等 C、加水稀释至溶液体积为 后,两种溶液中 都减小 D、加足量的锌充分反应后,两溶液中产生的氢气体积可用如图表示18. 下列事实能用同一原理解释的是( )A、向NaHCO3溶液中加入AlCl3溶液或NaAlO2溶液,均生成白色沉淀 B、向BaCl2溶液中通入SO2 , 再加入氯水或氨水,均产生白色沉淀 C、向蛋白质溶液中加入饱和NaCl或BaCl2溶液,均产生白色沉淀 D、用洁净铂丝分别蘸取烧碱或纯碱在外焰上灼烧,火焰均呈黄色二、多选题
-
19. 常温下,用pH=13的NaOH溶液滴定20mL0.1mol•L-1H3PO4溶液,曲线如图所示,下列说法中错误的是( )
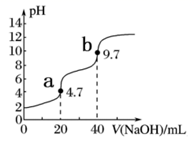 A、溶液中,H2PO 电离程度大于水解程度 B、a点磷酸的电离常数大于b点 C、磷酸的Ka1约为1.1×10-3 D、a点溶液中有:c(Na+)=c(H2PO )+c(HPO )+c(PO )20. 常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )A、b不可能显碱性 B、a可能显酸性或碱性 C、a不可能显酸性 D、b可能显碱性或酸性21. 酸和碱的稀溶液发生反应的变化曲线如图所示,下列说法正确的是( )
A、溶液中,H2PO 电离程度大于水解程度 B、a点磷酸的电离常数大于b点 C、磷酸的Ka1约为1.1×10-3 D、a点溶液中有:c(Na+)=c(H2PO )+c(HPO )+c(PO )20. 常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )A、b不可能显碱性 B、a可能显酸性或碱性 C、a不可能显酸性 D、b可能显碱性或酸性21. 酸和碱的稀溶液发生反应的变化曲线如图所示,下列说法正确的是( )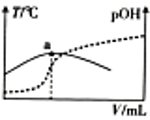 A、该反应是放热反应 B、a点可表示等物质的量的一元酸与一元碱完全反应 C、从反应开始到a点溶液导电能力一直增强 D、反应结束后,可利用 来计算反应热22. 常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( )
A、该反应是放热反应 B、a点可表示等物质的量的一元酸与一元碱完全反应 C、从反应开始到a点溶液导电能力一直增强 D、反应结束后,可利用 来计算反应热22. 常温下,已知Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述正确的是( ) A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-
A、H2R的二级电离常数Ka2的数量级为10-5 B、在pH=4的溶液中:3c(R2-)<c(Na+)+c(H+)-c(OH-) C、等体积、等浓度的NaOH浴液与H2R溶液混合后,溶液中:(R2-)<c(H2R) D、向Na2CO3溶液中加入过量H2R溶液,发生的反应是: CO3- +H2R=CO2↑+H2O+R2-三、填空题
-
23. 在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中c(NH4*)=c(Cl-),则溶液显性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb =24. 泡沫灭火器反应原理(硫酸铝溶液和碳酸氢钠溶液)请用离子方程式表示 。25. 今有①CH3COOH ②HCl ③H2SO4三种溶液,用序号回答问题:(1)、当它们pH相同时,其物质的量浓度由大到小排列的是(2)、当它们的物质的量浓度相同时,其pH由大到小排列的是(3)、中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为
四、实验探究题
-
26. 某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
装置
编号
试剂X
实验现象
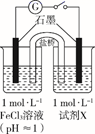
I
Na2SO3溶液(pH≈9)
闭合开关后灵敏电流计指针发生偏转
II
NaHSO3溶液(pH≈5)
闭合开关后灵敏电流计指针未发生偏转
(1)、配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。(2)、甲同学探究实验I的电极产物。①取少量Na2SO3溶液电极附近的混合液,加入 , 产生白色沉淀,证明产生了 。
②该同学又设计实验探究另一电极的产物,其实验方案为。
(3)、实验I中负极的电极反应式为。(4)、(乙同学的实验)乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
装置
编号
反应时间
实验现象
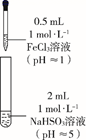
III
0~1 min
产生红色沉淀,有刺激性气味气体逸出
1~30 min
沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色
30 min后
与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色
乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3 Fe(OH)3 +3SO2;②。
(5)、查阅资料:溶液中Fe3+、 、OH-三种微粒会形成红色配合物并存在如下转化: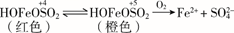
从反应速率和化学平衡两个角度解释1~30 min的实验现象:。
(6)、解释30 min后上层溶液又变为浅红色的可能原因:。(7)、(实验反思)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)。
27. 硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠工艺如下(部分条件和产物省略):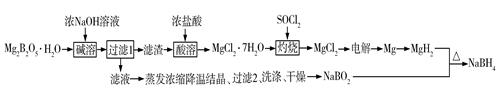
已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
(1)、Mg2B2O5•H2O中B的化合价为。MgH2和NaBO2必须在干燥条件下合成硼氢化钠,其原因是。(2)、难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为。(3)、SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是。(4)、已知镁—H2O2酸性燃料电池反应为Mg+H2O2+H2SO4=MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L-1硫酸溶液。①写出正极的电极反应式:。
②若电路中有0.038 mol转移电子时,则溶液pH约为(忽略体积变化,不考虑H2O2电离)。
(5)、“有效氢”是衡量含氢还原剂的还原能力指标,定义为1 g含氢还原剂的还原能力与多少克H2相当。NaBH4的“有效氢”等于(结果保留2位小数)。(6)、工业上,可以利用NaBO2、HCHO和生石灰在加热下生成NaBH4和难溶的盐,写出化学方程式。五、综合题
-
28.(1)、已知反应2H2(g)+S2(g)
 2H2S(g) 能自发进行,则原因是 (2)、常温下,醋酸钠溶液的pH碳酸氢钠溶液的pH 。(填“>”、“<”或“=”)(3)、明矾能作净水剂,用离子反应方程式表示其原因:29. 常温下,如果取0.1 mol/LHA溶液与0.1 mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:(1)、混合溶液pH=8的原因是(用离子方程式表示)。(2)、混合溶液中由水电离出的c(OH-)(填“大于”、“等于”或“小于”)0.1 mol/L NaOH溶液中由水电离出的c(OH-)。(3)、求出混合溶液中下列算式的精确计算结果(填具体数字): c(Na+)-c(A-)=mol/L。(4)、常温下,将pH=2的酸HA溶液与pH=12的NaOH溶液等体积混合后,所得溶pH7 (填“大于”、“等于”或“小于”)(5)、已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填“大于”、“等于”或“小于”)。30. 利用 可消除CO污染或定量测定CO,反应为:
2H2S(g) 能自发进行,则原因是 (2)、常温下,醋酸钠溶液的pH碳酸氢钠溶液的pH 。(填“>”、“<”或“=”)(3)、明矾能作净水剂,用离子反应方程式表示其原因:29. 常温下,如果取0.1 mol/LHA溶液与0.1 mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:(1)、混合溶液pH=8的原因是(用离子方程式表示)。(2)、混合溶液中由水电离出的c(OH-)(填“大于”、“等于”或“小于”)0.1 mol/L NaOH溶液中由水电离出的c(OH-)。(3)、求出混合溶液中下列算式的精确计算结果(填具体数字): c(Na+)-c(A-)=mol/L。(4)、常温下,将pH=2的酸HA溶液与pH=12的NaOH溶液等体积混合后,所得溶pH7 (填“大于”、“等于”或“小于”)(5)、已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填“大于”、“等于”或“小于”)。30. 利用 可消除CO污染或定量测定CO,反应为:完成下列填空:
(1)、该反应的平衡常数表达式 。在2L恒容密闭容器中反应25min后,固体质量减少了6.4g,则0~25min 的平均反应速率为。(2)、取一定量的 和CO于某密闭容器中,分别在80 和100 下进行实验,测得 如下:时间/min
温度
0
10
20
30
40
50
80
0.50
0.37
0.26
0.18
0.12
0.12
100
0.50
0.35
0.24
0.17
x
0.15
上表中 , 理由是。根据上表数据可以得出的结论是。
(3)、如图所示,300 时 的百分含量随着压强的增大而减小,请解释其原因。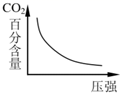 (4)、 可用高浓度NaOH溶液吸收。
(4)、 可用高浓度NaOH溶液吸收。①若4.48L (标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为。
②继续通入二氧化碳至溶液中碳酸钠和碳酸氢钠(碳酸氢钠溶液呈碱性)的物质的量之比1∶1,则溶液中各离子浓度大小顺序为。
③若使碳酸氢钠溶液中 的比值变小,可加入的物质是。
a.通入HCl b.NaOH固体 c.通入 d. 固体