吉林省长春市农安县2020-2021学年高二上学期化学期中考试试卷
试卷更新日期:2021-08-24 类型:期中考试
一、单选题
-
1. 下列说法正确的是( )A、化学键的断裂与形成与反应放热和吸热无关 B、放热反应的发生无需任何条件 C、所有化学变化一定遵循质量守恒和能量守恒 D、化学变化一定有化学键的断裂和生成,有化学键断裂或生成一定发生了化学变化2. 在 2A(g)+B(g) ⇌ 3C(g)+4D(g)反应中,下面表示的反应速率最快的是( )A、v(A)=0.5 mol/(L•s) B、v(B)=0.005 mol/(L•s) C、v(C)=0.8 mol/(L•min) D、v(D)=1.0 mol/(L•min)3. 2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,这个热化学方程式表示( )A、2g碳燃烧生成一氧化碳时放出221.0kJ的热量 B、2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量 C、2mol固体碳在氧气中燃烧生成2mol一氧化碳气体时放出221.0kJ的热量 D、12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量4. 在密闭容器中进行可逆反应,A跟B反应生成C,反应速率v(A)、v (B)、v (C)之间存在以下关系:v (B)=3 v (A),v (C)=2 v (A),3 v (C)=2 v (B),则该反应可以表示为( )A、A+3B 2C B、2A+2B 3C C、A+B C D、3A+B 2C5. 属于电解质,且溶于水时会影响水的电离平衡的是( )A、氯气 B、二氧化碳 C、碘化钾 D、醋酸钠6. 25 ℃时,水的电离达到平衡:H2O H++OH- , 下列叙述正确的是( )A、向水中加入NaHSO4固体,平衡逆向移动,c(H+)降低 B、将水加热,Kw增大,pH不变 C、向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低 D、向水中加入固体氢氧化钠,平衡逆向移动,c(OH-)增大7. 下列推论正确的是( )A、S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2=SO2(g) ΔH2 , 则ΔH1>ΔH2 B、C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1 , 则金刚石比石墨稳定 C、OH-(aq)+H+(aq)= H2O(l) ΔH=-57.4kJ·mol-1 , 则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ D、2C(s)+O2(g)= 2CO(g) ΔH=-221kJ·mol-1 , 则碳的燃烧热大于110.5kJ·mol-18. 反应C(s)+H2O(g) CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是( )A、v(CO)=v(H2O)时,反应达到平衡状态 B、保持体积不变,充入少量He气体使体系压强增大,反应速率一定增大 C、其他条件不变,仅将容器的体积缩小一半,反应速率加快 D、其他条件不变,适当增加C(s)的质量会使反应速率增大9. 下列关于盐溶液呈酸碱性的说法错误的是( )A、盐溶液呈酸碱性的原因是破坏了水的电离平衡 B、NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-) C、在CH3COONa溶液中,由水电离的c(OH-)≠c(H+) D、水电离出的H+和OH-与盐中弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性10. 下列说法中正确的是( )A、使用正催化剂,能增大活化分子百分数,所以反应速率增大 B、增大反应物浓度,能增大活化分子百分数,所以反应速率增大 C、对于任何反应,增大压强都可加快反应速率 D、升高温度,只能增大吸热反应的反应速率11. 在H2S的饱和溶液中存在下列平衡:①H2S H++HS- , ②HS- H++S2-。下列措施中既可增大c(S2-)又能提高pH,还能使电离平衡逆向移动的是( )A、加NaOH B、通入H2S气体 C、降温 D、加入Na2S晶体12. 下列叙述正确的是( )A、100 ℃纯水的pH=6,所以水在100 ℃时呈酸性 B、pH=3的盐酸溶液,稀释至10倍后pH>4 C、0.2 mol·L-1的醋酸,与等体积水混合后pH=1 D、常温时,pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=713. 恒温条件下,可逆反应:2NO(g)+O2(g)⇌2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A、①④⑥⑦ B、②③⑤⑦ C、①③④⑤ D、全部14. 一定温度下,把 2.5molA 和 2.5molB 混合盛入容积为 2L 的密闭容器里,发生如下反应:3A(g)+B(s)⇌xC(g)+2D(g),经 5s 反应达平衡,在此 5s 内 C 的平均反应速率为 0.2mol·L-1·s-1 , 同时生成 1molD,下列叙述中错误的是( )A、反应达到平衡状态时A的转化率为 60% B、x=3 C、若混合气体的密度不再变化,则该可逆反应达到化学平衡状态 D、反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为8∶515. 在20mL0.1mol·L-HCl溶液中加入同体积、同物质的量浓度的NH3·H2O溶液,反应后溶液中各粒子浓度的关系错误的是( )A、C(H+)+C(NH4+)=C(OH-)+C(Cl-) B、C(H+)= C(OH-)+ C(NH 3·H2O) C、C(Cl-)>C(NH4+)>C(OH-)>C(H+) D、C(Cl-)=C(NH4+)+ C(NH 3·H2O)16. 25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法错误的是( )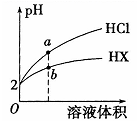 A、a、b两点: c(X-) < c(Cl-) B、溶液的导电性: a < b C、稀释前,c(HX) > 0.01mol/L D、溶液体积稀释到10倍,HX 溶液的pH < 317. 下列事实中,不能用勒夏特列原理解释的是( )A、打开汽水瓶.有气泡从溶液中冒出 B、H2、I2、HI混合气体加压后颜色变深 C、实验室中常用排饱和食盐水的方法收集氯气 D、合成氨工业采用高压条件18. 现有下列四个图象:
A、a、b两点: c(X-) < c(Cl-) B、溶液的导电性: a < b C、稀释前,c(HX) > 0.01mol/L D、溶液体积稀释到10倍,HX 溶液的pH < 317. 下列事实中,不能用勒夏特列原理解释的是( )A、打开汽水瓶.有气泡从溶液中冒出 B、H2、I2、HI混合气体加压后颜色变深 C、实验室中常用排饱和食盐水的方法收集氯气 D、合成氨工业采用高压条件18. 现有下列四个图象: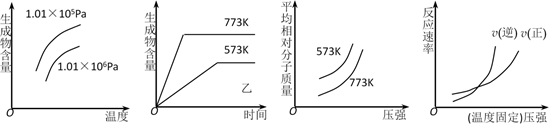 下列反应中符合上述全部图象的是( )A、N2(g)+3H2(g)⇌2NH3(g) ΔH<0 B、2SO3(g)⇌2SO2(g)+O2(g) ΔH>0 C、4NO(g)+6H2O(g)⇌4NH3(g)+5O2(g) ΔH>0 D、H2(g)+CO(g)⇌C(s)+H2O(g) ΔH<0
下列反应中符合上述全部图象的是( )A、N2(g)+3H2(g)⇌2NH3(g) ΔH<0 B、2SO3(g)⇌2SO2(g)+O2(g) ΔH>0 C、4NO(g)+6H2O(g)⇌4NH3(g)+5O2(g) ΔH>0 D、H2(g)+CO(g)⇌C(s)+H2O(g) ΔH<0二、填空题
-
19. 已知下列热化学方程式:
①H2(g)+ O2(g)═H2O(l) △H=﹣285.8kJ•mol﹣1
②H2(g)+ O2(g)═H2O(g) △H=﹣241.8kJ•mol﹣1
③C(s)+ O2(g)═CO(g) △H=﹣110.5kJ•mol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJ•mol﹣1
回答下列各问题:
(1)、上述反应中属于放热反应的是。(2)、H2的燃烧热为;C的燃烧热为。(3)、燃烧10gH2生成液态水,放出的热量为。(4)、CO燃烧热的热化学方程式为。20.(1)、如图表示在密闭容器中反应:2SO2+O2⇌2SO3 ∆H=-Q kJ/mol。到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b 过程中改变的条件可能是;b→c过程中改变的条件可能是;若增大压强时,将反应速度变化情况画在c~d处。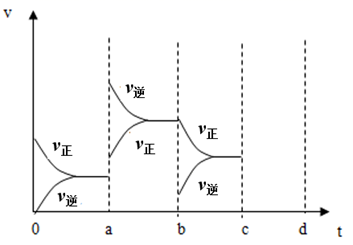 (2)、可逆反应 mA(g)+nB(g)⇌pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。
(2)、可逆反应 mA(g)+nB(g)⇌pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。①用“>”、“=”或“<”填空:该反应的 Δ H0,m+np。
②用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入 B,则 A 的转化率;升高温度,则平衡时 B、C 的浓度之比 c(B)/c(C)将;加入催化剂,平衡时气体混合物的总物质的量。
21. 水溶液存在离子平衡,回答下列问题:(1)、AlCl3 水溶液呈(填“酸”、“中”、“碱”)性 ,原因是(用离子方程式):;把 AlCl3 溶液加热蒸干,灼烧,最后得到的主要固体产物是。(2)、为防止FeSO4 溶液变质,在保存时需加入的试剂为(填试剂名称)(3)、已知 25 ℃时,纯水中 c(OH-)为 10-7mol·L-1 , 则:①该温度时水的离子积常数 Kw=。
②该温度下,将 pH=3 的 H2SO4 溶液与 pH=11 的 NaOH 溶液按等体积混合,所得混合溶液的 pH 为。
(4)、常温下,在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol·L-1 醋酸溶液,滴定曲线如图所示。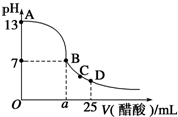
①该氢氧化钠溶液浓度为。
②在 B 点,溶液中离子浓度大小关系为。
③在 D 点,c(CH3COO-) c(Na+) (填“<”“>”或“=”)。
三、综合题
-
22. 某学生用 0.1500mol/LNaOH 溶液测定某未知浓度的盐酸,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸 25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作 2-3 次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准 NaOH 溶液润洗后,将标准液注入碱式滴定管“0”刻度以上 2-3cm 处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)、滴定时正确操作的顺序是(用序号字母填写):→→F→→→→D;(2)、操作 F 中应该选择图中滴定管(填标号)。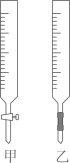 (3)、滴定终点的现象是。(4)、滴定结果如表所示:
(3)、滴定终点的现象是。(4)、滴定结果如表所示:滴定次数
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
25.00
1.02
21.03
2
25.00
0.60
20.60
3
25.00
0.20
20.19
计算该盐酸的物质的量浓度为(保留 4 位有效数字)。
(5)、下列操作会导致测定结果偏高的是___。A、酸式滴定管没有润洗直接装待测液 B、锥形瓶用盐酸润洗 C、碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 D、达到滴定终点时,仰视读数