广西岑溪市2020-2021学年高二上学期化学期中考试试卷(理)
试卷更新日期:2021-08-24 类型:期中考试
一、单选题
-
1. 化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )A、NH3常用作制冷剂 B、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入硅胶 C、小苏打用制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 D、二氧化硅常用于制造光导纤维2. 下列各组中,每种电解质溶液电解时(惰性电极)只生成氢气和氧气的是( )A、HCl、CuCl2、Ba(OH)2 B、NaOH、CuSO4、H2SO4 C、NaOH、H2SO4、Ba(OH)2 D、NaBr、H2SO4、Ba(OH)23. 据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系( )A、乳浊液 B、溶液 C、胶体 D、悬浊液4. 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
 A、石墨是阴极 B、两个铜片上都发生氧化反应 C、锌片是负极 D、两个番茄都形成原电池5. 已知气体A和气体B反应生成液态C为放热反应,则下列热化学方程式书写正确的是(a>0)( )A、A(g)+2B(g)=C(l) ΔH=+a kJ/mol B、A+2B=C ΔH=-a kJ/mol C、A(g)+2B(g)=C(l) ΔH=-a kJ D、A(g)+2B(g)=C(l) ΔH=-a kJ/mol6. 下列变化不能通过一步化学反应实现的是( )A、BaCl2→BaSO4 B、CuO→Cu(OH)2 C、NaOH→Na2SO3 D、MgSO4→Mg(OH)27. 在一定条件下,RO 与R-可发生反应:RO +5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )A、元素R位于周期表中第ⅤA族 B、R只能被还原 C、R2在常温常压下一定是气体 D、若1mol RO 参与该反应,则转移的电子的物质的量为5 mol8. 下列离子方程式正确的是( )A、向NaHCO3溶液中加入NaOH溶液:HCO +OH-=CO +H2O B、澄清石灰水中加盐酸:2H++Ca(OH)2=Ca2++2H2O C、氯气溶于水:Cl2+H2O 2H++ClO-+Cl- D、向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO =BaSO4↓+H2O9. 断开1 mol AB(g)分子中的化学键,使其分解生成气态A原子和气态B原子时所吸收的能量称为A—B键的键能。已在H—H键的键能为436 kJ·mol-1 , H—N键的键能为391 kJ·mol-1 , 根据热化学方程式N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1 , 推求N≡N键的键能是( )A、431 kJ·mol-1 B、946 kJ·mol-1 C、649 kJ·mol-1 D、1130 kJ·mol-110. 3He在月球上储量丰富,3He主要来源于宇宙射线的初级粒子,下列关于3He和4He的叙述正确的是( )A、两者互为同位素 B、两者互为同素异形体 C、两者为同一种核素 D、两者具有相同的中子数11. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )
A、石墨是阴极 B、两个铜片上都发生氧化反应 C、锌片是负极 D、两个番茄都形成原电池5. 已知气体A和气体B反应生成液态C为放热反应,则下列热化学方程式书写正确的是(a>0)( )A、A(g)+2B(g)=C(l) ΔH=+a kJ/mol B、A+2B=C ΔH=-a kJ/mol C、A(g)+2B(g)=C(l) ΔH=-a kJ D、A(g)+2B(g)=C(l) ΔH=-a kJ/mol6. 下列变化不能通过一步化学反应实现的是( )A、BaCl2→BaSO4 B、CuO→Cu(OH)2 C、NaOH→Na2SO3 D、MgSO4→Mg(OH)27. 在一定条件下,RO 与R-可发生反应:RO +5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )A、元素R位于周期表中第ⅤA族 B、R只能被还原 C、R2在常温常压下一定是气体 D、若1mol RO 参与该反应,则转移的电子的物质的量为5 mol8. 下列离子方程式正确的是( )A、向NaHCO3溶液中加入NaOH溶液:HCO +OH-=CO +H2O B、澄清石灰水中加盐酸:2H++Ca(OH)2=Ca2++2H2O C、氯气溶于水:Cl2+H2O 2H++ClO-+Cl- D、向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO =BaSO4↓+H2O9. 断开1 mol AB(g)分子中的化学键,使其分解生成气态A原子和气态B原子时所吸收的能量称为A—B键的键能。已在H—H键的键能为436 kJ·mol-1 , H—N键的键能为391 kJ·mol-1 , 根据热化学方程式N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1 , 推求N≡N键的键能是( )A、431 kJ·mol-1 B、946 kJ·mol-1 C、649 kJ·mol-1 D、1130 kJ·mol-110. 3He在月球上储量丰富,3He主要来源于宇宙射线的初级粒子,下列关于3He和4He的叙述正确的是( )A、两者互为同位素 B、两者互为同素异形体 C、两者为同一种核素 D、两者具有相同的中子数11. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )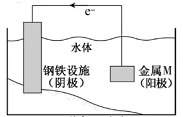 A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快12. 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置,观察到电流计G的指针均有偏转,则其可能的组合共有( )
A、阴极的电极反应式为 B、金属M的活动性比Fe的活动性弱 C、钢铁设施表面因积累大量电子而被保护 D、钢铁设施在河水中的腐蚀速率比在海水中的快12. 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置,观察到电流计G的指针均有偏转,则其可能的组合共有( ) A、6种 B、5种 C、4种 D、3种13. 在2A+B=3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol·L-1·s-1 B、v(B)=0.3 mol·L-1·s-1 C、v(C)=0.8 mol·L-1·s-1 D、v(D)=1 mol·L-1·s-114. 在一密闭容器,aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )A、物质B的质量分数增加了 B、物质A的转化率减少了 C、平衡向逆反应方向移动了 D、a>b15. N2 (g)与H2 (g)在铁催化剂表面经历如下过程生成NH3(g): 下列说法正确的是( )
A、6种 B、5种 C、4种 D、3种13. 在2A+B=3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5 mol·L-1·s-1 B、v(B)=0.3 mol·L-1·s-1 C、v(C)=0.8 mol·L-1·s-1 D、v(D)=1 mol·L-1·s-114. 在一密闭容器,aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )A、物质B的质量分数增加了 B、物质A的转化率减少了 C、平衡向逆反应方向移动了 D、a>b15. N2 (g)与H2 (g)在铁催化剂表面经历如下过程生成NH3(g): 下列说法正确的是( ) A、I中破坏的均为极性键 B、IV中NH2与H的总键能大于NH3中总键能 C、II、III、IV均为放热过程 D、N2 (g)+3H2 (g) NH3 (g) △H>016. 碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
A、I中破坏的均为极性键 B、IV中NH2与H的总键能大于NH3中总键能 C、II、III、IV均为放热过程 D、N2 (g)+3H2 (g) NH3 (g) △H>016. 碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:①H2(g) + I2(?) 2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
下列判断正确的是( )
A、①中的I2为固态,②中的I2为气态 B、②的反应物总能量比①的反应物总能量低 C、①的产物比反应②的产物热稳定性更好 D、1mol 固态碘升华时将吸热17kJ二、填空题
-
17.(1)、现有反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如图所示,回答下列问题:

①写出该反应的热化学方程式;
②图中数字“419”表示的是;
③图中曲线II表示(填反应条件)的能量变化。
(2)、已知:C(s)+O2(g)=CO2(g) △H1=-437.3kJ·mol-12CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
则2C(s)+O2(g)=2CO(g) △H3=。
(3)、下列反应中,属于放热反应的是(填编号,下同),属于吸热反应的是。①物质燃烧②酸碱中和反应③CaCO3受热分解④Ba(OH)2·8H2O与NH4Cl反应
18. 如图两个实验装置是实现化学能和电能相互转化的装置。 (1)、电极②、④的名称分别是、。(2)、把电能转化为化学能的装置是 (填“甲”或“乙”)(3)、铁电极腐蚀更严重的装置是 (填“甲”或“乙”)(4)、甲、乙两装置电极附近的溶液首先变红的电极是___。A、①② B、②③ C、③④ D、①④19. 电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2 , 如图为制备装置示意图。
(1)、电极②、④的名称分别是、。(2)、把电能转化为化学能的装置是 (填“甲”或“乙”)(3)、铁电极腐蚀更严重的装置是 (填“甲”或“乙”)(4)、甲、乙两装置电极附近的溶液首先变红的电极是___。A、①② B、②③ C、③④ D、①④19. 电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2 , 如图为制备装置示意图。
①a极的电极反应式是。
②下列说法正确的是。
A.该装置可以实现电能转化为化学能
B.电极b连接电源负极
C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点
20.(1)、某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化关系曲线如图所示。
①反应至2min时Y与Z的物质的量之比为。
②由图中的数据分析,该反应的化学方程式为。
③反应开始至5min时Z的平均反应速率为。
④5min后Z的生成速率其消耗速率 (填“大于”、“小于”或“等于”)。
(2)、某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。实验
混合溶液
A
B
C
D
E
F
4mol•L-1H2SO4mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
9
0
请完成此实验设计,其中:V1= , V6=。
21. 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。 (1)、仪器a的名称是;实验前,第一步操作是。(2)、在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是。(3)、如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是。
(1)、仪器a的名称是;实验前,第一步操作是。(2)、在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是。(3)、如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是。方案
反应物
甲
Cu、浓HNO3
乙
Cu、稀HNO3
丙
Cu、O2、稀HNO3
(4)、该装置也可用来证明酸性强弱:如H2CO3>H2SiO3。方法如下:在a中加入稀硫酸,c中加入的试剂是 (填编号,下同),d中加入的试剂是;如果在d中看到 , 即可证明酸性:H2CO3>H2SiO3。
供选择的试剂:
A.Na2SiO3溶液 B.稀硫酸 C.NaCl溶液 D.Na2CO3溶液 E.碳酸钙