安徽省马鞍山市和县2020-2021学年高一上学期化学期中考试试卷
试卷更新日期:2021-08-24 类型:期中考试
一、单选题
-
1. 下列说法正确的是 ( )A、硅材料广泛应用于光纤通讯 B、工艺师利用盐酸刻蚀石英制作艺术品 C、水晶项链和餐桌上的瓷盘都是硅酸盐制品 D、粗硅制备单晶硅不涉及氧化还原反应2. 下列各组中属于同位素关系的是( )A、H2与D2 B、 与 C、T2O与H2O D、O2与O33. 在NO2被水吸收的反应中,发生还原反应和发生氧化反应物质质量比为( )A、3∶1 B、1∶3 C、1∶2 D、2∶14. 下列对于某些离子的检验及结论正确的是( )A、加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- B、加入稀盐酸无明显现象,再加氯化钡溶液,有白色沉淀产生,一定有SO42- C、加硝酸银溶液产生白色沆淀,一定有Cl- D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+5. 已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )A、a=b+m+n B、a=b-m+n C、a=b+m-n D、a=b-m-n6. 向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )A、NaCl Na2SO4 B、NaCl NaBr Na2SO4 C、NaCl Na2SO4 I2 D、NaCl NaI Na2SO47. 短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法错误的是( )
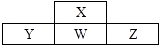 A、最简单的氢化物的沸点:X>W B、元素的非金属性:Z>W>Y C、简单离子的半径大小:Y>W>Z D、氧化物对应水化物的酸性:Y<W<Z8. 下列物质能使品红溶液褪色的是( )
A、最简单的氢化物的沸点:X>W B、元素的非金属性:Z>W>Y C、简单离子的半径大小:Y>W>Z D、氧化物对应水化物的酸性:Y<W<Z8. 下列物质能使品红溶液褪色的是( )①干燥的Cl2 ②Na2O2 ③NaClO ④活性炭 ⑤SO2
A、除①外其它都可以 B、只有②③⑤ C、只有①④⑤ D、全部9. 在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol·L-1和0.1mol·L-1。向该混合液中加入1.92g铜粉,加热,待充分反应后,设溶液的体积仍为100mL,则所得溶液中的Cu2+的物质的量浓度是( )A、0.15mol·L-1 B、0.225mol·L-1 C、0.35mol·L-1 D、0.45mol·L-110. 某元素的一种同位素原子 ,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是( )A、 (A-Z+2m)mol B、 (A+2m)mol C、 (A-Z+3m)mol D、11. 同温、同压下,在3支体积相同的试管中分别充有体积比为1:1的两种气体组成的混合气体,它们是:①NO、NO2;②NO2、O2;③NH3、N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积大小关系正确的是( )A、①>②>③ B、①>③>② C、②>③>① D、③=①>②12. 甲、乙、丙、丁四种物质之间的转化关系如图所示,则下列说法错误的是( )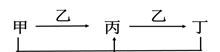 A、若甲是C,则乙可能是O2 B、若甲是Fe,则乙可能是Cl2 C、若甲是NaOH溶液,则乙可能是SO2 D、若甲是H2S,则乙可能是O213. 某溶液中可能含有Na+、 、Fe2+、K+、I-、 、 ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )A、肯定不含I- B、肯定含有 、I- C、肯定不含 D、肯定含有14. 有两种短周期元素M和N,可组成化合物MN3 , 当N的原子序数为Z时,M的原子序数为 ① Z-4 ② Z+4 ③ Z+6 ④ Z+18。其中正确的组合是( )A、只有① B、只有①② C、只有①②③ D、①②③④15. 铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )A、9.02 g B、8.51 g C、8.26 g D、7.04 g16. 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化曲线如图所示,有关说法错误的是( )
A、若甲是C,则乙可能是O2 B、若甲是Fe,则乙可能是Cl2 C、若甲是NaOH溶液,则乙可能是SO2 D、若甲是H2S,则乙可能是O213. 某溶液中可能含有Na+、 、Fe2+、K+、I-、 、 ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )A、肯定不含I- B、肯定含有 、I- C、肯定不含 D、肯定含有14. 有两种短周期元素M和N,可组成化合物MN3 , 当N的原子序数为Z时,M的原子序数为 ① Z-4 ② Z+4 ③ Z+6 ④ Z+18。其中正确的组合是( )A、只有① B、只有①② C、只有①②③ D、①②③④15. 铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )A、9.02 g B、8.51 g C、8.26 g D、7.04 g16. 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化曲线如图所示,有关说法错误的是( ) A、线段BC代表Fe3+的物质的量的变化情况 B、原混合溶液中c(FeBr2)=6 mol/L C、当通入 2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- D、原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3
A、线段BC代表Fe3+的物质的量的变化情况 B、原混合溶液中c(FeBr2)=6 mol/L C、当通入 2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- D、原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3二、填空题
-
17.(1)、将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。则原混合气体中NO2和O2体积比可能是或。(2)、工业制硫酸的过程中,SO2被氧气氧化的化学方程式为。(3)、工业制漂白粉的化学方程式。
三、综合题
-
18. A、B、C、D、E、F为六种短周期主族元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的0.75倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:(1)、写出F元素原子结构示意图 , 元素B在周期表中的位置。(2)、判断C、D、E原子半径的大小顺序(填写元素符号,下同),比较B和E的气态氢化物的稳定性大小。(3)、写出单质D与C的最高价氧化物的水化物反应的离子方程式。(4)、由A、B、C、E四种元素共同构成的两种化合物在溶液中相互间可发生化学反应,试写出该反应的离子方程式。19. A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、B形成的化合物 的水溶液反应生成A单质,C原子与B原子的电子层数相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。(1)、四种元素符号为:A , B , C , D;(2)、离子的电子层结构相同的两种元素是与 , 离子的结构示意图分别为 、;(3)、A、B、C、D原子形成的最高价氧化物的化学式分别为、、、。20. 某化学兴趣小组为检验木炭和浓硫酸反应生成的产物,设计如图装置(已知SO2能使溴水褪色),请回答:
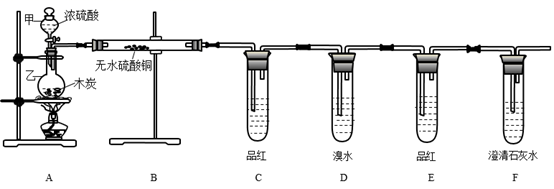 (1)、写出A中木炭和浓硫酸发生反应的化学方程式;(2)、试管B中现象是;(3)、F试管中澄清石灰水的作用是;同时该小组设计如图所示的实验装置(固定装置略),进行SO2性质的研究:
(1)、写出A中木炭和浓硫酸发生反应的化学方程式;(2)、试管B中现象是;(3)、F试管中澄清石灰水的作用是;同时该小组设计如图所示的实验装置(固定装置略),进行SO2性质的研究: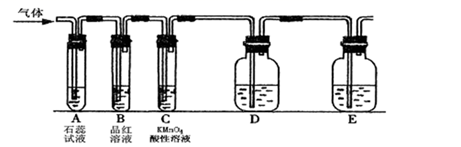 (4)、当通入SO2时,A中紫色石蕊溶液变红,用化学方程式解释其原因是。(5)、可用来验证SO2具有漂白性的现象是:。(6)、从元素化合价的角度分析,SO2的性质:
(4)、当通入SO2时,A中紫色石蕊溶液变红,用化学方程式解释其原因是。(5)、可用来验证SO2具有漂白性的现象是:。(6)、从元素化合价的角度分析,SO2的性质:①当通入SO2一段时间后,可观察C中溶液褪色,说明SO2具有性。
②如要验证SO2还具有另一方面的性质,D装置中的药品应为。
A.FeCl3溶液B.氯水C.氢硫酸D.浓硝酸
21. 燃煤烟气中含有二氧化硫等大气污染物,大气污染物的研究治理对改善环境具有重要意义。(1)、I.为测定某工厂烟道气中SO2的含量,某兴趣小组同学做了如下实验: 取标准状况下的烟气1.000L (内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。写出氯水与二氧化硫反应的离子方程式。
(2)、加入过量的BaCl2溶液的目的是: , 写出相关反应的离子方程式:。(3)、洗涤沉淀的方法是。(4)、计算该烟气样品中二氧化硫的体积分数。(5)、II.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。在工业上采用氨法烟气脱硫技术,其做法是用雾化的氨水与烟气中的SO2直接接触吸收SO2 , 请写出氨水吸收SO2 生成亚硫酸铵的化学方程式。
(6)、该兴趣小组同学采用NaClO2溶液脱除SO2①NaClO2 中氯元素的化合价为。
②用1L0.1mol/L 的NaClO2溶液最多可以吸收标准状况下的SO2L。
-