浙教版科学九年级期初考试复习——八下第二章综合练习
试卷更新日期:2021-08-22 类型:开学考试
一、单选题
-
1. X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则W克XY2中含有Y的原子数是( )A、 B、 C、 D、2. 由Na2SO4和CaSO4组成的混合物中,测知氧元素的质量分数为46%.若再计算混合物中的下列各项:①硫元素的质量分数 ②钠元素的质量分数 ③CaSO4的质量分数 ④Na2SO4和CaSO4的质量比 ⑤CaSO4的质量,以下判断正确的是( )A、都能确定 B、都不能确定 C、只有①能确定 D、只有⑤不能确定3. 目前农村正在推广“测土配方施肥”技术,农技员对某土地检测后给出了施肥配方,该土壤施加NH4NO3 , K2CO3;若测定该混合化肥中氮元素的质量分数为28%,则固体混合物中K2CO3的质量分数为( )A、85% B、20% C、25% D、80%4. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算5. 某物质可能含有铁的氧化物中的一种或两种,实验测得其中铁元素的质量分数为75%,则该物质可能为( )A、FeO B、Fe3O4和Fe2O3的混合物 C、Fe2O3 D、FeO和Fe2O3的混合物6. 在O2和CO2的混合气体中,碳元素的质量分数是24%,则O2和CO2的质量比是( )A、2∶5 B、3∶1 C、3∶22 D、8∶117. 作为相对原子质量标准的碳—12 可以写成 12C。1 个 12C 的原子的质量为 akg,1 个 12CO2 分子的质量为 bkg,若以 12CO2 分子中的 1 个氧原子质量的 1/16 作为相对原子质量的标准,则 12CO2 的相对分子质量是( )A、 B、 C、 D、8. 室温下某气体可能是由SO2、CO、N2中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的( )
①SO2 ②SO2、N2 ③CO、N2 ④SO2、CO ⑤SO2、CO、N2
A、①②③ B、②③⑤ C、①③⑤ D、①③④9. 某硝酸铵(NH4NO3)样品中(杂质不含氮)氮元素的质量分数为28%,则其中硝酸铵的质量分数为( )A、20% B、70% C、80% D、无法计算10. 有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%。已知A的化学式为XY4 , 则B的化学式为( )A、XY2 B、XY3 C、X2Y3 D、X3Y211. 已知一个SO2分子的质量为n千克,一个SO3分子的质量为m千克(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的 作为相对原子质量的标准,则SO2的相对分子质量为( )A、 B、
B、 C、
C、 D、
D、 12. 明矾石广泛用于造纸、制革、化工等工业,其化学式为:KAl3(SO4)2(OH)x。式中x的值是( )A、5 B、6 C、7 D、813.
12. 明矾石广泛用于造纸、制革、化工等工业,其化学式为:KAl3(SO4)2(OH)x。式中x的值是( )A、5 B、6 C、7 D、813.饮用含甲醇的酒,可造成失明,甚至中毒死亡.如图是甲醇燃烧的微观示意图(未配平),下列有关说法或化学方程式错误的是( )
 A、工业酒精中往往含有甲醇,禁止用工业酒精配制饮料酒 B、CH3OH+3O2
A、工业酒精中往往含有甲醇,禁止用工业酒精配制饮料酒 B、CH3OH+3O2 CO2+4H2O
C、每个甲醇分子比每个乙醇分子少一个原子团“CH2”
D、等质量的甲醇与甲烷分别在足量氧气中完全燃烧,甲醇消耗的氧气比甲烷少
14.
CO2+4H2O
C、每个甲醇分子比每个乙醇分子少一个原子团“CH2”
D、等质量的甲醇与甲烷分别在足量氧气中完全燃烧,甲醇消耗的氧气比甲烷少
14.工业上可利用黄铁矿(主要成分是Fe2S)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
①4FeS2+11O2
 2Fe2O3+8SO2②Fe2O3+3CO
2Fe2O3+8SO2②Fe2O3+3CO 2Fe+3CO2③2SO2+O2
2Fe+3CO2③2SO2+O2 2SO3④SO3+H2O═H2SO4
2SO3④SO3+H2O═H2SO4下列说法不正确的是( )
A、反应①②③均有元素化合价发生变化 B、反应①②不属于四种基本反应类型中的任何一种,反应③④属于化合反应 C、将5g SO2溶于95g水形成溶液,其溶液的质量分数大于5% D、将100g蒸馏水加入100g98%的浓硫酸中,可配制200g质量分数为49%的稀硫酸15. 青蒿素(C15H22O5)是一种治疗疟疾的特效药.下列关于青蒿素的说法不正确的是()A、属于有机物 B、相对分子质量282 C、一个分子含有44个原子 D、由三种元素组成16. Fe2O3+3CO高温3CO2+2Fe中,反应前后化合价发生变化的元素()A、只有Fe B、只有Fe和C C、只有C和O D、Fe、C和O17. 元素R在化合物中只有一种化合价,下列化学式有一个是错误的,它是()A、R(OH)2 B、RCl3 C、R2(SO4)3 D、R2O318. 有三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子总数之和为14,而质子数之和为28,则三种元素有可能是( )A、C、N、P B、N、O、S C、N、P、F D、Na、O、S19. 在19世纪,化学家对氧化锆的化学式有争议。经测定,锆(Zr)的相对原子质量为91,其氯化物的相对分子质量是233。若氧化锆中锆的化合价与氯化物中的相同,则氧化锆的化学式为( )A、ZrO2 B、Zr2O C、Zr2O3 D、ZrO20. 与铵根离子(NH )具有相同的质子数和电子数的微粒是( )
A、Na+ B、OH- C、H2O D、LiF二、填空题
-
21. 回答下列问题。(1)、下表是元素周期表的一部分,请回答有关问题:
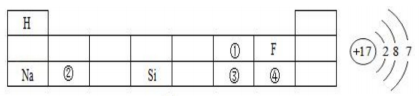
右图表示左表中(填表中序号)的原子结构示意图;得电子后形成的离子符号为;①处元素和②处元素形成常见化合物的化学式为;
(2)、X、Y两种元素的相对原子质量之比为7∶2,X与Y形成的化合物中,X、Y两种元素的质量之比为21∶8,则该化合物的化学式可表示为。若X、Y两种元素的相对原子质量之比为2∶1,由这两种元素形成的化合物中,X、Y的质量之比为2∶3,其中X的化合价为+a。则在该化合物中Y的化合价为。22.(1)、X、Y两种元素组成的化合物甲和乙,甲的化学式为X2Y3 , 其中Y元素的质量分数为50%,乙中X元素的质量分数为60%,则乙的化学式为;(2)、元素X的原子失去1个电子,元素Y的原子得到2个电子后,所形成的离子所带电子数均与氖原子相同,由X、Y两元素的离子形成的化合物的相对分子质量为;(3)、相同质量的H2O2和D2O(D即2H)中氢元素的质量比为。(4)、某样品可能由铁、氧化亚铁、氧化铁和四氧化三铁中的一种或几种组成,现测得该样品中铁元素与氧元素的质量比是21:8;若该样品由两种物质混合而成,则一定不含;若该样品由三种物质混合而成,则一定含有。23.(1)、某三价金属与氧元素形成的化合物中氧元素质量分数为30%,则该金属的相对原子质量为。(2)、A、B两元素相对原子质量之比为2∶1,仅由这两种元素组成的化合物里,A、B两元素质量比为2∶3,若其中B为-n价,则此化合物中A元素的化合价为。(3)、元素R可与氧形成多种化合物,其中RO中含氧53.33%,那么相对分子质量为76,含氧量为63.16%的R与氧元素形成的化合物的化学式是。(4)、要使CO2和CO中含有相同质量的氧元素,则CO2和CO的质量比是。24. 经测定,甲醛(CH2O):.醋酸(C2H4O2)、丙酮(C3H6O)三种物质的混合物中含氢元素8g,则该混合物完全燃烧后产生二氧化碳气体的质量是 , 地震过后,防疫部门常用到一种高效安全灭菌消毒剂,该消毒剂可表示为RO2 , 主要用于饮用水消毒.实验测得该氧化物中R与O的质量比为71:64,则RO2的化学式为。
25.请回答下列问题
(1)如图为某化学反应的微观示意图,图中“●”表示氧原子,“○”表示氢原子.

①该反应的基本反应类型为 .
②结合图示分析,该反应前后发生改变的粒子是 .
(2)地球上的总水储量虽然很大,但淡水很少,大部分是含盐很高的海水.而海水淡化的成本很高,目前尚不能推广,从成分的角度考虑,你理解的“海水淡化”是指;实验室有一杯海水,要将其变为纯净的水,你认为最可行的方法是 .
26.用化学符号填空:2个氮原子;n个钠离子; 3个硫酸根离子;地壳中含量最多的金属元素与最多的非金属元素组成化合物的化学式;(“●”表示氢原子,“O”表示氧原子)
 表示;氧化亚铁中铁元素的化合价为+2 .
表示;氧化亚铁中铁元素的化合价为+2 .三、实验探究题
-
27. 只含铜和氧两种元素的固体样品18g,测得铜元素的质量为16g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:(1)、该样品的组成情况有。(写出所有可能的组成);(2)、若固体样品由两种物质组成,则质量偏少的那种物质在样品中的质量分数为。(用分数表示)28. 俗话说“骨头的精髓在汤里”。有人认为骨头中钙、磷含量雄厚,骨头汤必然钙含量很高,是补钙的好材料。为了验证骨头汤能否有效补钙,某科研小组将猪排骨 500g、蒸馏水 1500mL、食用醋 70mL,加热煮沸后维持 70 分钟,得到骨头汤 1243mL,用仪器检测结果:每 100mL 骨头汤含有 2mg 钙(而每 100mL 牛奶约含有 105mg 钙)。
查阅资料:人体骨骼中的钙存在形式是羟基磷酸钙[Ca10(PO4)6(OH)2],该物质难溶于水。人体平均每天需要补钙 800mg。
(1)、“骨头汤能补钙”中的钙是指 (填字母编号);A、钙离子 B、单质钙 C、钙元素 D、羟基磷酸钙(2)、羟基磷酸钙中磷元素的化合价是价 ;(3)、假设某人只能从骨头汤中获取钙,则此人每天需要喝L 骨 头 汤 ;(4)、某品牌钙片每片的规格是:维生素 D3100IU(相当于 2.5 微克),碳酸钙 1000mg,若某人只从钙片中获取钙,则每天需要服用此品牌钙片片。29. 科学理论的建立要有一个又一个的证据。在研究原子结构的历史进程中,卢瑟福揭开了原子世界一个又一个的奥秘。请回答:(1)、1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氦原子核)散射实验,用一些高速运动的α粒子轰击金箔,发现多数α粒子穿过金箔后仍保持原来的运动方向,但有少数α粒子发生了较大角度的偏转,而极少数α粒子发生反弹。下列说法正确的有 。A、多数α粒子保持原来的运动方向,说明原子核的体积很小 B、少数α粒子发生较大角度偏转,说明原子核带负电 C、极少数α粒子发生反弹,说明原子核的质量很大(2)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是。30. 为破解原子结构的奥秘,一代又一代科学家进行了不懈探索。1897年,汤姆生提出了一个原子模型:原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干那样镶嵌在其中。
1911年,英国科学家卢瑟福为探索原子的内部结构,用带正电的α粒子轰击金属箔,发现有如下现象:①大多数α粒子能穿透金属箔而不改变原来的运动方向;②有小部分α粒子改变了原来的运动方向;③有极少部分α粒子被弹了回来。
1913年,丹麦科学家波尔改进了卢瑟福的原子核式结构模型,认为电子只能在原子内的一些特定的稳定轨道上运动。
(1)、卢瑟福的α粒子轰击金属箔实验现象中,能证明原子核带正电的现象是(填序号);(2)、反映卢瑟福α粒子轰击金箔实验结果的示意图最合理的是 (填字母);A、 B、
B、 C、
C、 (3)、上述原子结构模型的建立过程,对你有哪些启示?(写出一点即可)。31. 如图是水分子分解的示意图,其中“
(3)、上述原子结构模型的建立过程,对你有哪些启示?(写出一点即可)。31. 如图是水分子分解的示意图,其中“ ”表示氧原子,“●”表示氢原子。
”表示氧原子,“●”表示氢原子。 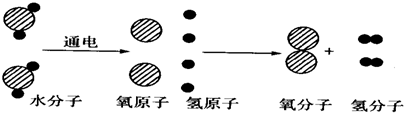
根据图可以获得的化学信息有:
(1)、在水电解的过程中,发生改变的微粒是 , 不变的微粒是 , 生成新物质的微粒是;(请说出具体分子、原子的名称)(2)、分子和原子的本质区别是;32. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。(1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。把一束高速运动的α 粒子(带2个单位正电荷),射向一片极薄的金箔。他惊奇的发现,过去一直认为原 子是“实心球”,而由这种“实心球”紧密排列成的金箔,竟为大多数α粒子畅通无 阻得通过,就像金箔不在那儿似的,但也有极少数的α粒子发生偏转,或笔直的弹回。
根据上述实验现象能得出关于金箔中金原子结构的一些结论,试写出其中的三点:
A. ;
B.;
C.。
(2)、从原子结构模型建立的过程中,我们发现(填序号)。A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
四、解答题
-
33. 某同学发现他家菜园中的蔬菜生长迟缓,准备到市场上购买氮肥,硝酸铵和尿素是两种常见的氮肥,每千克售价如下:
氮肥
化学式
每千克的售价
硝酸铵
NH4NO3
10元
尿素
CO(NH2)2
16元
根据表格回答计算分析问题(写出计算过程,保留2个有效数字):
(1)、尿素中氮元素的质量分数是多少?(2)、一千克尿素的含氮质量与多少千克硝酸铵的含氮量相等?(3)、根据尿素和硝酸铵含氮的比例分析,计算说明哪种化肥更经济。34. 人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在,其相对分子质量为1004。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品.下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题: (1)、包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g。那么一盒牛奶含钙至少g(保留到0.01g)。(2)、求羟基磷酸钙中钙元素的质量分数(保留为0.1%)。(3)、若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝多少盒牛奶?35. 红美人,为橘橙类杂交品种,被称为柑橘界中的“贵族”。其皮薄易剥,果肉无渣,内含丰富的维生素C (化学式为C6H8O6)。请完成下列问题:(1)、维生素C属于(选填“单质”或“化合物”)。(2)、维生素C中碳元素和氢元素的质量比为 。(3)、请通过计算,求出17.6克维生素C中含有多少克氧元素?
(1)、包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g。那么一盒牛奶含钙至少g(保留到0.01g)。(2)、求羟基磷酸钙中钙元素的质量分数(保留为0.1%)。(3)、若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝多少盒牛奶?35. 红美人,为橘橙类杂交品种,被称为柑橘界中的“贵族”。其皮薄易剥,果肉无渣,内含丰富的维生素C (化学式为C6H8O6)。请完成下列问题:(1)、维生素C属于(选填“单质”或“化合物”)。(2)、维生素C中碳元素和氢元素的质量比为 。(3)、请通过计算,求出17.6克维生素C中含有多少克氧元素?
