高中化学鲁科版(2019)选择性必修1 第1章第4节 金属的腐蚀与防护
试卷更新日期:2021-08-21 类型:同步测试
一、单选题
-
1. 以下现象与电化学腐蚀无关的是( )A、生铁比纯铁容易生锈 B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 C、铁质器件附有铜质配件,在接触处易生铁锈 D、银质物品久置表面变暗2. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。下列说法错误的是( )
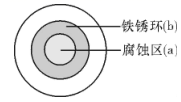 A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)33. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A、铁片腐蚀最严重区域不是生锈最多的区域 B、液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- C、液滴下氧气含量少,铁片作负极,发生的还原反应为Fe-2e-=Fe2+ D、铁片腐蚀过程发生的总化学方程式为4Fe+6H2O+3O2=4Fe(OH)33. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。①
②
③
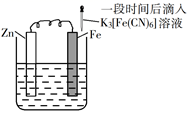
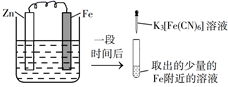
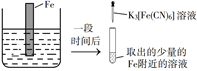
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法错误的是( )
A、对比②③,可以判定Zn保护了Fe B、对比①②,K3[Fe(CN)6]可能将Fe氧化 C、验证Zn保护Fe时不能用①的方法 D、将Zn换成Cu,用①的方法可判断Fe比Cu活泼4. 对金属腐蚀及防护的表述正确的是( )A、金属腐蚀的本质:金属失电子发生还原反应 B、牺牲阳极的阴极保护法:被保护的金属应做负极 C、外加电流阴极保护法:被保护的金属应与电源正极相连 D、钢铁表面烤蓝生成一层致密的 ,能起到防腐蚀作用5. 锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法错误的是( )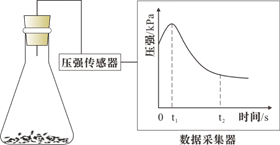 A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性6. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( )
A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性6. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( ) A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大7. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )
A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大7. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )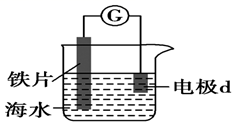 A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑8. 炒过菜的铁锅未及时洗净(残液中含 ),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑8. 炒过菜的铁锅未及时洗净(残液中含 ),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )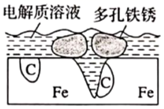 A、腐蚀过程中,负极是 ,发生电极反应: B、 失去电子经电解质溶液转移给C C、正极的电极反应式为 D、C是正极, 在C表面上发生还原反应9. 如图所示装置中都盛有0.1mol·L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是( )
A、腐蚀过程中,负极是 ,发生电极反应: B、 失去电子经电解质溶液转移给C C、正极的电极反应式为 D、C是正极, 在C表面上发生还原反应9. 如图所示装置中都盛有0.1mol·L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是( ) A、③①④② B、①②④③ C、②③④① D、②①④③10. 生活和生产中人们采用多种方法防止金属腐蚀,其中保护轮船外壳的常用方法是( )A、涂保护层 B、改变金属结构 C、牺牲阳极的阴极保护法 D、外加电流的阴极保护法11. 某实验小组利用下列装置探究电解质溶液的浓度对金属腐蚀的影响:
A、③①④② B、①②④③ C、②③④① D、②①④③10. 生活和生产中人们采用多种方法防止金属腐蚀,其中保护轮船外壳的常用方法是( )A、涂保护层 B、改变金属结构 C、牺牲阳极的阴极保护法 D、外加电流的阴极保护法11. 某实验小组利用下列装置探究电解质溶液的浓度对金属腐蚀的影响:装置


现象
电流计指针不发生偏转
电流计指针发生偏转
下列有关说法正确的是( )
A、装置Ⅰ中的铁片均不会发生任何腐蚀 B、铁片d上可能发生的电极反应为:Fe-3e-=Fe3+ C、利用K3[Fe(CN)6]溶液可确定装置Ⅱ中的正、负极 D、铁片a、c所处的NaCl溶液的浓度相等,二者腐蚀速率相等12. 铁锅用水清洗放置后出现红褐色锈斑,在此变化过程中不发生的反应是( )A、Fe-3e-+3OH-=3Fe(OH)3 B、O2+2H2O+4e-=4OH- C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 D、2Fe+O2+2H2O=2Fe(OH)213. 下列情形中,相同材质的铁最不易被腐蚀的是( )A、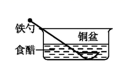 B、
B、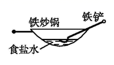 C、
C、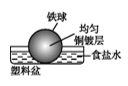 D、
D、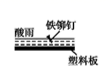 14. 下列有关说法正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行保护 B、铜锌原电池中,盐桥中的 和 分别移向负极和正极 C、铅蓄电池放电时负极质量减轻,充电时阳极质量增加 D、在铁片上镀锌时,将铁片与电源的正极相连
14. 下列有关说法正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行保护 B、铜锌原电池中,盐桥中的 和 分别移向负极和正极 C、铅蓄电池放电时负极质量减轻,充电时阳极质量增加 D、在铁片上镀锌时,将铁片与电源的正极相连二、综合题
-
15. 炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:(1)、铁锅的锈蚀应属于腐蚀。(2)、铁锅锈蚀的电极反应式为:负极:;正极:。正负极反应产物会继续发生反应,反应的离子方程式 , 化学方程式为。16. 按要求回答问题:(1)、以 和 为电极,稀 为电解质溶液形成的原电池中:
① 向极移动(填“正”或“负”)。
②若有 流过导线,则理论上负极质量减少g。
③若将稀硫酸换成浓硝酸,其负极的电极方程式为:。
(2)、氢气是未来最理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水时,实现了从太阳能转变为化学能。生成的氢气用于燃料电池时,实现化学能转变为电能。分解海水的反应属于(填“放热”或“吸热”)反应。(3)、有人以化学反应: 为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的 进行工作。则原电池的负极材料是锌,发生的电极反应为。(4)、常温下,暴露在空气中的生铁容易发生吸氧腐蚀,请写出正极的电极反应式。17. 金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题: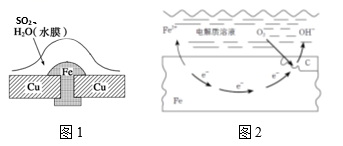 (1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。
(1)、图1,被腐蚀的金属为 , 其腐蚀类型属于(填字母)。图2,金属腐蚀类型属于(填字母)。A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)、图1中Cu的作用是 , 结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理。(3)、图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 , 负极反应为 , 总反应为。(4)、下列防止铁制品生锈的措施合理的是__________。A、在铁闸门表面涂油漆 B、在地下铁管道上安装若干镁合金 C、将铁罐与浓硫酸等强氧化剂接触,使之发生钝化