高中化学鲁科版(2019)选择性必修1 第1章第1节 化学反应的热效应
试卷更新日期:2021-08-21 类型:同步测试
一、单选题
-
1. 工业合成三氧化硫的反应为2SO2(g)+O2(g)
 2SO3(g) ∆H=-198kJ/mol,反应过程可用如图模拟(
2SO3(g) ∆H=-198kJ/mol,反应过程可用如图模拟( 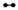 表示O2 ,
表示O2 ,  表示SO2 ,
表示SO2 ,  表示催化剂)。下列说法正确的是( )
表示催化剂)。下列说法正确的是( ) 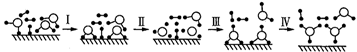 A、过程Ⅰ和过程Ⅳ决定了全部反应进行的程度 B、过程Ⅱ为放热过程,过程Ⅲ为吸热过程 C、催化剂可降低反应的活化能,从而使∆H减小 D、1mol SO2和1mol O2反应,放出的热量小于99kJ2. 某反应由两步反应A→B→C构成,它的反应能量曲线如图所示,下列叙述正确的是( )
A、过程Ⅰ和过程Ⅳ决定了全部反应进行的程度 B、过程Ⅱ为放热过程,过程Ⅲ为吸热过程 C、催化剂可降低反应的活化能,从而使∆H减小 D、1mol SO2和1mol O2反应,放出的热量小于99kJ2. 某反应由两步反应A→B→C构成,它的反应能量曲线如图所示,下列叙述正确的是( ) A、两步反应均为吸热反应 B、三种化合物中C最稳定 C、第二步反应决定了总反应的速率 D、升高温度,活化能 、 均减小,反应速率加快3. 根据下列信息判断氢气燃烧生成水时的热量变化,其中不正确的是( )
A、两步反应均为吸热反应 B、三种化合物中C最稳定 C、第二步反应决定了总反应的速率 D、升高温度,活化能 、 均减小,反应速率加快3. 根据下列信息判断氢气燃烧生成水时的热量变化,其中不正确的是( )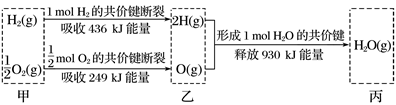 A、H2O(g)分解为H2(g)与O2(g)时吸收热量 B、甲、乙、丙中物质所具有的总能量乙最高 C、1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O(l)释放能量为245 kJ D、2 mol H2O(g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低4. 相同温度和压强下,关于反应的 ,下列判断正确的是( )
A、H2O(g)分解为H2(g)与O2(g)时吸收热量 B、甲、乙、丙中物质所具有的总能量乙最高 C、1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O(l)释放能量为245 kJ D、2 mol H2O(g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低4. 相同温度和压强下,关于反应的 ,下列判断正确的是( ) A、 B、 C、 D、5. 据文献报道,金红石 表面催化氮气固定机理如图所示,下列叙述错误的是( )
A、 B、 C、 D、5. 据文献报道,金红石 表面催化氮气固定机理如图所示,下列叙述错误的是( ) A、
A、 是反应中间体
B、该催化固氮总反应为
C、整个催化过程中存在 键的断裂和生成
D、催化剂可以提高固氮速率的原因是改变该反应的△H
6. CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
是反应中间体
B、该催化固氮总反应为
C、整个催化过程中存在 键的断裂和生成
D、催化剂可以提高固氮速率的原因是改变该反应的△H
6. CH4与CO2重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:反应①:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)ΔH1=+247.4kJ·mol-1
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
反应③:CH4(g)+ O2(g)⇌CO(g)+2H2(g)ΔH3=-35.6kJ·mol-1
一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2 , 测得不同温度下反应平衡时各产物产量如图所示,下列说法正确的是( )
 A、2CO(g)+O2(g)=2CO2(g) ΔH=-283kJ·mol-1 B、图中曲线a和b分别代表产物CO和H2 C、温度高于900K时,H2O的含量下降的原因之一是反应③向逆向进行 D、升高温度和增加压强均能使CO的产量增加7. 已知2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 , 则下列关于方程式2H2O(l)=2H2(g)+O2(g)的说法中正确的是( )A、方程式中的化学计量数表示分子数 B、该反应ΔH大于零 C、该反应ΔH=-571.6 kJ·mol-1 D、该反应可表示36 g水分解时的热效应8. 氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。已知部分化学键的键能和化学反应的能量变化如表和图所示。下列说法中正确的是( )
A、2CO(g)+O2(g)=2CO2(g) ΔH=-283kJ·mol-1 B、图中曲线a和b分别代表产物CO和H2 C、温度高于900K时,H2O的含量下降的原因之一是反应③向逆向进行 D、升高温度和增加压强均能使CO的产量增加7. 已知2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 , 则下列关于方程式2H2O(l)=2H2(g)+O2(g)的说法中正确的是( )A、方程式中的化学计量数表示分子数 B、该反应ΔH大于零 C、该反应ΔH=-571.6 kJ·mol-1 D、该反应可表示36 g水分解时的热效应8. 氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。已知部分化学键的键能和化学反应的能量变化如表和图所示。下列说法中正确的是( )化学键
N—H
N—Cl
H—Cl
键能(kJ/mol)
391.3
x
431.8
 A、表中的x=191.2 B、反应过程中的△H2=1405.6kJ·mol-1 C、选用合适的催化剂,可降低反应过程中的H值 D、NH3(g)+2Cl2(g)=NHCl2(g)+2HCl(g)△H= -22.6kJ·mol-19. NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是( )
A、表中的x=191.2 B、反应过程中的△H2=1405.6kJ·mol-1 C、选用合适的催化剂,可降低反应过程中的H值 D、NH3(g)+2Cl2(g)=NHCl2(g)+2HCl(g)△H= -22.6kJ·mol-19. NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是( )
 A、NH3催化还原NO为吸热反应 B、过程Ⅰ中NH3断裂非极性键 C、过程Ⅱ中NO为氧化剂,Fe2+为还原剂 D、脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) 4N2(g)+6H2O(g)10. 依据图示关系,下列说法错误的是( )
A、NH3催化还原NO为吸热反应 B、过程Ⅰ中NH3断裂非极性键 C、过程Ⅱ中NO为氧化剂,Fe2+为还原剂 D、脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) 4N2(g)+6H2O(g)10. 依据图示关系,下列说法错误的是( ) A、 B、石墨的稳定性比金刚石高 C、C(石墨,s) D、1mol石墨或1molCO分别完全燃烧,石墨放出热量多11. 已知共价键的键能与热化学方程式信息如下表:
A、 B、石墨的稳定性比金刚石高 C、C(石墨,s) D、1mol石墨或1molCO分别完全燃烧,石墨放出热量多11. 已知共价键的键能与热化学方程式信息如下表:共价键
键能/( )
436
463
热化学方程式
则 的Q为( )
A、428 B、-428 C、498 D、-49812. 已知反应A+B=C+D的能量变化如图所示,能量下列说法正确的是( )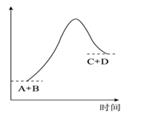 A、该反应为吸热反应 B、该反应只有在加热条件下才能进行 C、反应物的总能量高于产物的总能量 D、形成产物C和D的化学键所放出的总能量高于断开反应物A和B的化学键所吸收的总能量
A、该反应为吸热反应 B、该反应只有在加热条件下才能进行 C、反应物的总能量高于产物的总能量 D、形成产物C和D的化学键所放出的总能量高于断开反应物A和B的化学键所吸收的总能量二、填空题
-
13. 从能量的角度看,断开化学键要能量,形成化学键要能量。若某反应的反应物总能量大于生成物的总能量,那么,该反应是一个(填“放热”或“吸热”)反应。14. 碳的化合物在生产、生活中有着重要的作用。
已知:2CO(g)+O2(g) = 2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) = H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) = CH3OH(g) △H3=-107kJ.molˉ1
则CH3OH(g)+O2(g) = CO2(g)+2H2O(g) △H=kJ·molˉ1
15. 已知某反应A(g)+B(g)⇌C(g)+D(g),反应过程中的能量变化如图所示,则该反应是反应(填“吸热”或“放热”),该反应的ΔH=kJ·mol-1(用含E1、E2的代数式表示) 16.(1)、已知断裂 共价键所需要吸收的能量分别为 ,对于化学反应 ,该反应的热化学方程式可表示为:。(2)、高炉炼铁的原料中,石灰石的作用是。
16.(1)、已知断裂 共价键所需要吸收的能量分别为 ,对于化学反应 ,该反应的热化学方程式可表示为:。(2)、高炉炼铁的原料中,石灰石的作用是。三、综合题
-
17.(1)、Ⅰ.如图是化学反应中物质变化和能量变化的示意图。
在锌与稀盐酸的反应中, (填“>”或“<”或“=”)
(2)、工业上利用 和 比在催化剂作用下合成甲醇: ,已知反应中有关物质的化学键键能数据如下表所示:化学键
436
343
1076
465
413
则 生成 放出 热量。
(3)、化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取 盐酸倒入如图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取 溶液,并用另一温度计测出其温度。
c.将 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
①实验中,倒入 溶液的正确操作是。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含 溶质的 稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为 、 、 ,则 、 、 的关系为。
(4)、Ⅱ.甲烷燃料电池。已知电池的总反应为 ,①负极的电极反应式为。
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为 。
18. 已知下列热化学方程式:①H2(g)+ O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
③CO(g)=C(s)+ O2(g) ΔH=+110.5kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
回答下列问题:
(1)、上述反应中属于放热反应的是(填序号)。(2)、H2的燃烧热ΔH=。(3)、燃烧10gH2生成液态水,放出的热量为。(4)、表示CO燃烧热的热化学方程式为。(5)、已知:P4(s,白磷)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1P(s,红磷)+ O2(g)= P4O10(s) ΔH=-738.5kJ·mol-1
写出白磷转化为红磷的热化学方程式:。
19. 19世纪初,法国科学家杜龙和珀蒂测定比热时发现:金属的比热( )与其相对原子质量的乘积近似为常数25.08 。将40.0g惰性金属M加热到100℃,投入20.0g温度为36.7℃的水中,最终体系的温度为46.7℃。推算该金属的近似摩尔质量(水的比热为4.18 ,请写出计算过程,结果保留整数)。