高中化学鲁科版(2019)必修第一册 第1章 单元测试
试卷更新日期:2021-08-21 类型:单元试卷
一、单选题
-
1. 下列科研成果不是由我国发明或创造的是( )A、人工合成结晶牛胰岛素 B、门捷列夫发现元素周期律 C、侯德榜首创候氏联合制碱法 D、人工合成酵母丙氨酸转移核糖核酸2. 随着科学的发展,学科间的交叉和综合越来越多,学科之间的界限越来越不明显,“边缘科学”即代表了一个新名词,说明了学科间的相互联系。但目前的科学研究,学科间的分工依然存在,各自的研究领域仍有所不同。下列变化不属于化学研究范畴的是( )A、COVID-19(新冠肺炎)病毒疫苗的研制 B、近期出现雾霾的原因探究 C、朝鲜的原子弹爆炸实验 D、湖南华菱钢铁集团冶炼特种钢3. 化学与生产、生活密切相关,下列物质用途错误的是( )A、次氯酸钠:漂白剂 B、碳酸氢钠:侯氏制碱法的初始原料 C、硅酸钠:木材防火剂 D、过氧化钠:呼吸面具的供氧剂4. 下列说法正确的是( )A、氯气溶于水后得到的溶液叫做氯水或液氯 B、HClO不稳定,见光易分解出氯气 C、 和 都是由氯元素组成的 D、漂白粉是纯净物5. 某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是( )
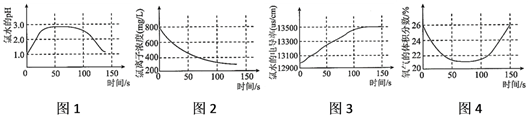 A、图1表示氯水pH随时间的变化 B、图2表示溶液中氯离子浓度随时间的变化 C、图3表示氯水的电导率随时间的变化 D、图4表示液面上方氧气体积分数随时间的变化6. 下列变化过程中不能直接实现的是( )
A、图1表示氯水pH随时间的变化 B、图2表示溶液中氯离子浓度随时间的变化 C、图3表示氯水的电导率随时间的变化 D、图4表示液面上方氧气体积分数随时间的变化6. 下列变化过程中不能直接实现的是( )①HCl ②Cl2 ③Ca(ClO)2 ④HClO ⑤CO2
A、④→⑤ B、①→② C、③→④ D、②→③7. 如图所示,在A处通入未经干燥的氯气,当关闭B阀时,C处的红布条看不到明显现象:当打开B阀后,C处的红布条逐渐褪色:则D瓶中盛放的溶液可能是( )①饱和NaCl溶液
②NaOH溶液
③H2O
④浓硫酸
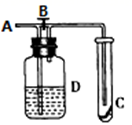 A、①② B、①③ C、②④ D、③④8. 下列实验过程中没有气体产生的是( )A、
A、①② B、①③ C、②④ D、③④8. 下列实验过程中没有气体产生的是( )A、 B、
B、 C、
C、 D、
D、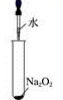 9. 下列关于钠及其化合物的叙述中,错误的是( )A、钠元素在自然界以化合态存在 B、少量的钠可以保存在煤油中 C、钠在空气中燃烧生成氧化钠 D、碳酸钠既是钠盐又是碳酸盐10. 将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有沉淀产生的是( )
9. 下列关于钠及其化合物的叙述中,错误的是( )A、钠元素在自然界以化合态存在 B、少量的钠可以保存在煤油中 C、钠在空气中燃烧生成氧化钠 D、碳酸钠既是钠盐又是碳酸盐10. 将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有沉淀产生的是( )①MgSO4溶液②NaCl溶液③Na2SO4溶液④饱和澄清石灰水⑤Ca(HCO3)2溶液
A、① B、①④ C、①④⑤ D、①②④⑤11. NA是阿伏加德罗常数的值,下列说法错误的是( )A、22.4L(标准状况)氟气所含的质子数为18NA B、1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NA C、电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NA D、1L1mol•L-1溴化铵水溶液中NH 与H+离子数之和大于NA12. 实验室用NaClO固体配制 溶液,下列说法正确的是( )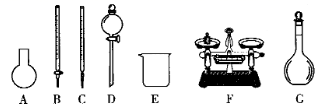 A、如图所示的仪器中,有4种是不需要的,还需1种玻璃仪器即可 B、容量瓶用蒸馏水洗净后,应烘干后才能用于配制溶液 C、用放置时间较长的NaClO来配制溶液,可能导致所配溶液浓度偏低 D、定容时,俯视容量瓶刻度线,会导致所配溶液浓度偏低13. NA代表阿伏加德罗常数的值,下列说法正确的是( )A、在标准状况下,22.4 LH2O的质量约为18 g B、136 g KHSO4固体中含有H+的数目为NA C、含0.4 mol HCl的浓盐酸与足量MnO2反应,转移电子数目为0.2NA D、1 mol Na2O2固体中含离子总数为3NA14. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、62g Na2O溶于水后所得溶液中含有O2-离子数为NA B、7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA C、标准状况下,22.4 LSO3中含有3NA个氧原子 D、合成氨反应中1mol氮气与3mol氢气反应,转移电子数为6NA15. 现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.0mol/L,要使Mg2+转化为Mg(OH)2 , 并使Mg2+与Al3+分离开,至少需要3mol/L的NaOH溶液的体积为( )A、40mL B、120mL C、100mL D、160mL16. 下列叙述正确的是( )A、1 mol·L-1的硫酸钠溶液中含有钠离子个数为NA B、标准状况下,22.4 L SO3中含有的原子数目为3NA C、40 g NaOH溶解于1 L水中,形成溶液中溶质的物质的量浓度是1 mol·L-1 D、32g氧气的物质的量为1mol17. 已知标准状况下5.6L的X气体分子的质量为8g,则X气体的摩尔质量是( )A、16g B、32g C、64g/mol D、32g/mol18. 有关 和 的性质,以下叙述错误的是( )A、等质量的 和 与足量盐酸反应,在相同条件下 产生的 体积大 B、同物质的量浓度的两种溶液, 溶液的 大于 溶液 C、将石灰水加入 溶液中不产生沉淀,加入 溶液中产生白色沉淀 D、等物质的量的两种盐与同浓度盐酸完全反应,所耗盐酸的体积 是 的两倍
A、如图所示的仪器中,有4种是不需要的,还需1种玻璃仪器即可 B、容量瓶用蒸馏水洗净后,应烘干后才能用于配制溶液 C、用放置时间较长的NaClO来配制溶液,可能导致所配溶液浓度偏低 D、定容时,俯视容量瓶刻度线,会导致所配溶液浓度偏低13. NA代表阿伏加德罗常数的值,下列说法正确的是( )A、在标准状况下,22.4 LH2O的质量约为18 g B、136 g KHSO4固体中含有H+的数目为NA C、含0.4 mol HCl的浓盐酸与足量MnO2反应,转移电子数目为0.2NA D、1 mol Na2O2固体中含离子总数为3NA14. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、62g Na2O溶于水后所得溶液中含有O2-离子数为NA B、7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA C、标准状况下,22.4 LSO3中含有3NA个氧原子 D、合成氨反应中1mol氮气与3mol氢气反应,转移电子数为6NA15. 现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.0mol/L,要使Mg2+转化为Mg(OH)2 , 并使Mg2+与Al3+分离开,至少需要3mol/L的NaOH溶液的体积为( )A、40mL B、120mL C、100mL D、160mL16. 下列叙述正确的是( )A、1 mol·L-1的硫酸钠溶液中含有钠离子个数为NA B、标准状况下,22.4 L SO3中含有的原子数目为3NA C、40 g NaOH溶解于1 L水中,形成溶液中溶质的物质的量浓度是1 mol·L-1 D、32g氧气的物质的量为1mol17. 已知标准状况下5.6L的X气体分子的质量为8g,则X气体的摩尔质量是( )A、16g B、32g C、64g/mol D、32g/mol18. 有关 和 的性质,以下叙述错误的是( )A、等质量的 和 与足量盐酸反应,在相同条件下 产生的 体积大 B、同物质的量浓度的两种溶液, 溶液的 大于 溶液 C、将石灰水加入 溶液中不产生沉淀,加入 溶液中产生白色沉淀 D、等物质的量的两种盐与同浓度盐酸完全反应,所耗盐酸的体积 是 的两倍二、实验探究题
-
19. 氯气广泛应用于杀菌、消毒及化工领域,某化学小组设计如图装置制备少量干燥纯净的氯气,试回答下列问题:
 (1)、盛有浓盐酸仪器名称 , 装置的正确连接顺序为;(2)、气体发生装置中发生反应的化学方程式为;(3)、题给装置中饱和食盐水的作用是 , 检验氯气是否收集满的方法是 ;(4)、写出尾气吸收装置中反应的离子方程式 ;(5)、工业上常用氯气制备“84消毒液”,它能有效杀灭新冠病毒,某品牌84消毒液:含25%NaClO、1000 mL、密度1.192 g·cm -3。该品牌消毒液需要稀释后才能使用,某化学实验小组用该品牌消毒液配制1000mL0.2mol·L-1的稀溶液。
(1)、盛有浓盐酸仪器名称 , 装置的正确连接顺序为;(2)、气体发生装置中发生反应的化学方程式为;(3)、题给装置中饱和食盐水的作用是 , 检验氯气是否收集满的方法是 ;(4)、写出尾气吸收装置中反应的离子方程式 ;(5)、工业上常用氯气制备“84消毒液”,它能有效杀灭新冠病毒,某品牌84消毒液:含25%NaClO、1000 mL、密度1.192 g·cm -3。该品牌消毒液需要稀释后才能使用,某化学实验小组用该品牌消毒液配制1000mL0.2mol·L-1的稀溶液。①量取84消毒液 mL;
②定容时仰视刻度线,所配溶液浓度会 (填“偏高”、“偏低”或“无影响”),此时应采取的处理方法。
20. 某化学实验小组需要 的 溶液 ,现用 固体来配制,请回答下列问题:(1)、需称取 g。(2)、配制过程中,不需要的仪器(填序号)。A.药匙 B.酒精灯 C.托盘天平 D.烧杯 E.玻璃棒 F.洗瓶 G.蒸发皿
完成实验还缺少的两种仪器是。
(3)、在配制过程中,下列操作能引起所配溶液浓度偏低的有(填序号)。①称量 固体时,砝码与 固体位置放反( 以下用游码)。
②所称取的 固体含有其他杂质
③转移前,容量瓶中含有少量蒸馏水
④定容时,俯视刻度线
⑤转移时有少量液体溅出
三、综合题
-
21. 大苏打 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)、工业上,将 和 以 的物质的量之比配成溶液。再通入 可制取 ,同时放出 ,写出该反应的化学方程。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为。(2)、 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因。(3)、下列关于苏打和小苏打的说法正确的是___________(选填字母序号)。A、纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 B、苏打和小苏打的相互转化属于可逆反应 C、苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确 D、牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢(4)、向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
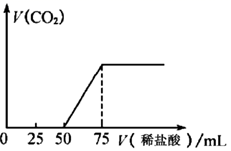
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是(填写化学式)
②滴入 稀盐酸过程中,溶液导电性(填“增强”或“减弱”),试解释其原因。
③原 氢氧化钠溶液的浓度为。