高中化学人教版(2019)选择性必修1第三章第四节沉淀溶解平衡
试卷更新日期:2021-08-11 类型:同步测试
一、单选题
-
1. 化学反应原理是研究化学的重要工具,下列相关说法正确的是( )A、CH4(g)+Cl2(g) CH3Cl(g)+HCl(g)能自发进行,则该反应 H>0 B、向碳酸钠溶液中通入少量的氯气:Na2CO3+H2O+2Cl2=2HClO+2NaCl+CO2 C、室温下,稀释0.1 mol/L的HClO溶液,溶液中c(ClO-)减小 D、向硫酸钡悬浊液中加入足量饱和碳酸钠溶液,振荡过滤洗涤,向沉淀中加入盐酸溶液有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)2. 某温度下,向体积均为20.00 mL、浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液中分别滴加0.1 mol·L-1的AgNO3溶液,滴定过程中的pX(pX=-lgX,X=Cl-、CrO )与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )
 A、a=1 B、曲线I表示NaCl溶液 C、Ksp(Ag2CrO4)=1.0×10-2b D、M约为2c-1.473. 下列说法错误的是( )A、升高HCl稀溶液温度,溶液中c(H+)不变 B、常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-) C、向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变 D、25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.04. 室温下进行下列实验,根据实验操作、现象和所得到的实验结论均正确的是( )
A、a=1 B、曲线I表示NaCl溶液 C、Ksp(Ag2CrO4)=1.0×10-2b D、M约为2c-1.473. 下列说法错误的是( )A、升高HCl稀溶液温度,溶液中c(H+)不变 B、常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-) C、向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变 D、25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.04. 室温下进行下列实验,根据实验操作、现象和所得到的实验结论均正确的是( )选项
实验操作和现象
实验结论
A
常温下,用pH计测定等物质的量浓度的NaHCO3、NaClO4两种盐溶液的pH,测得NaHCO3的pH大于NaClO4
非金属性:Cl>C
B
向含有Na+、K+、NO 、SO 的溶液中逐滴滴加盐酸,立即产生气泡
SO 和H+反应产生SO2气体
C
向某溶液中滴加氯水后在滴加KSCN溶液,溶液呈红色
溶液中一定含有Fe3+
D
向2mL 0.1mol/L Na2S溶液中滴入2mL0.1mol/LZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液。开始有沉淀产生,后有黑色沉淀生成
Ksp(CuS)>Ksp(ZnS)
A、A B、B C、C D、D5. 天然水体中的H2CO3与空气中的CO2保持平衡。已知Ksp(CaCO3)=2.8×10-9 , 某溶洞水体中lgc(X) (X为H2CO3、 、 或Ca2+)与pH的关系如图所示。下列说法正确的是( ) A、曲线①代表 B、H2CO3的一级电离常数为10-8.3 C、c(Ca2+)随 pH升高而增大 D、pH=10.3 时,c(Ca2+)=2.8×10-7.9 mol·L-16. 某温度下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的KCl溶液和K2CrO4溶液中滴加0.1 mol·L-1的AgNO3溶液,滴加过程中pCl和pCrO4随加入AgNO3溶液的体积(V)的变化关系如图所示。已知:pCl=-lgc(Cl-),pCrO4=-lgc( )。下列说法错误的是( )
A、曲线①代表 B、H2CO3的一级电离常数为10-8.3 C、c(Ca2+)随 pH升高而增大 D、pH=10.3 时,c(Ca2+)=2.8×10-7.9 mol·L-16. 某温度下,分别向体积均为10 mL、浓度均为0.1 mol·L-1的KCl溶液和K2CrO4溶液中滴加0.1 mol·L-1的AgNO3溶液,滴加过程中pCl和pCrO4随加入AgNO3溶液的体积(V)的变化关系如图所示。已知:pCl=-lgc(Cl-),pCrO4=-lgc( )。下列说法错误的是( ) A、曲线I表示pCl与V(AgNO3溶液)的变化关系 B、若仅增大KCl的浓度,平衡点由R点沿虚线移向S点 C、M点溶液中:c( )>c(Ag+)>c(H+)>c(OH-) D、该温度下,Ksp(Ag2CrO4)=4.0×10-127. 下列实验操作、实验现象和实验结论均正确的是( )
A、曲线I表示pCl与V(AgNO3溶液)的变化关系 B、若仅增大KCl的浓度,平衡点由R点沿虚线移向S点 C、M点溶液中:c( )>c(Ag+)>c(H+)>c(OH-) D、该温度下,Ksp(Ag2CrO4)=4.0×10-127. 下列实验操作、实验现象和实验结论均正确的是( )选项
实验操作
实验现象
实验结论
A
将少量浓硝酸分多次加入Cu和稀硫酸的混合物中
产生红棕色气体
硝酸的还原产物为NO2
B
将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液
溶液变成血红色
Fe(NO3)2试样无法确定是否变质
C
2滴0.1mol·L−1 MgCl2溶液中滴加2mL 1mol·L−1 NaOH溶液,再滴加2滴0.1 mol·L−1 FeCl3溶液
先生成白色沉淀,后生成红褐色沉淀
Ksp[Mg(OH)2]>
Ksp[Fe(OH)3]
D
将溴乙烷和NaOH乙醇溶液混合加热,产生的气体通入酸性KMnO4溶液
酸性KMnO4溶液褪色
产生了乙烯
A、A B、B C、C D、D8. 下列实验操作、现象及结论均正确的是( )选项
实验操作
实验现象
实验结论
A
将乙醇与浓硫酸的混合溶液加热,产生的气体直接通入酸性 溶液中
溶液紫色褪去
产生的气体一定是乙烯
B
向 溶液中滴加过量氨水
得到澄清溶液
与 能大量共存
C
常温下,向含等浓度 和 的溶液中逐滴加入NaOH溶液
先生成蓝色沉淀
常温下,
D
将用稀硫酸酸化后的 溶液滴入 溶液中
溶液变黄
氧化性:
A、A B、B C、C D、D9. 难溶金属氢氧化物 开始沉淀的 (简记pH始)与沉淀完全的 (简记pH终),理论上具有定量关系,假定开始沉淀时 ,设 时沉淀完全,则当 时,pH终-pH始始的值为( )A、1 B、2 C、3 D、410. 下列有关实验操作和现象及所得出的结论错误的是( )选项
实验操作
现象
结论
A
向淀粉溶液中加入少量 的硫酸溶液,加热,冷却,在水解液中加入碘水
溶液未变蓝。
淀粉完全水解
B
向 溶液中滴入1~2滴 溶液,再加入2滴 溶液
先产生白色沉
淀,后产生红
褐色沉淀
无法判断
C
向滴加酚酞的氨水中加蒸馏水
溶液红色变浅
溶液中 、 深度均减小
D
取 溶液,加入 溶液,萃取分液后,向水层中滴入 溶液
溶液变红色
和 所发生的反应为可逆反应
A、A B、B C、C D、D11. 根据下列图示所得出的结论错误的是( )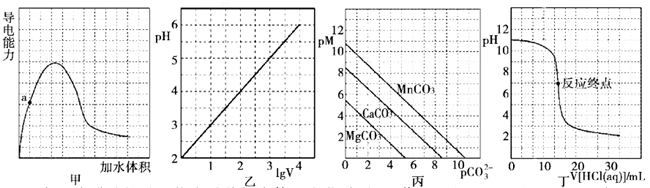 A、图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的 试纸测量a点的 ,则测量结果可能偏小 B、图乙表示 的盐酸溶液加水稀释至 随 的变化关系图 C、图丙表示一定温度下三种碳酸盐 的沉淀溶解平衡曲线图 ,则有 、 、 的 依次减小 D、图丁表示 盐酸滴定 溶液的滴定曲线12. 下列实验操作、现象与结论均正确的是( )
A、图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的 试纸测量a点的 ,则测量结果可能偏小 B、图乙表示 的盐酸溶液加水稀释至 随 的变化关系图 C、图丙表示一定温度下三种碳酸盐 的沉淀溶解平衡曲线图 ,则有 、 、 的 依次减小 D、图丁表示 盐酸滴定 溶液的滴定曲线12. 下列实验操作、现象与结论均正确的是( )选项
操作
现象
结论
A
向FeCl3和KSCN混合溶液中,加入少量KCl的固体
溶液颜色变浅
FeCl3+3KSCN ⇌Fe(SCN)3+3KCl平衡向逆反应方向移动
B
浓度均为0.10mol/L的Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液
产生黑色沉淀
Ksp(Ag2S)>Ksp(Ag2CO3)
C
向两支盛有 溶液的试管中分别加入 和 溶液
前者比后者褪色快
其他条件不变,反应物浓度增加,反应速率增大
D
常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞
都变红,但前者红色更深
结合质子的能力:CO >HCO
A、A B、B C、C D、D13. 化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。一定温度下,下列有关该反应的推理正确的是( )A、该反应达到平衡时:c(Cu2+)=c(Mn2+) B、平衡体系中加入少量CuS(s)后,c(Mn2+)变小 C、平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS)14. 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是( )①20mL 0.01mol·L-1 KCl溶液 ②30mL 0.02mol·L-1 CaCl2溶液③40mL 0.03mol·L-1 HCl溶液
A、①>③>② B、①>②>③ C、②>①>③ D、③>②>①15. 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下PbCO3和PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc( )或-lgc(I-)的关系如图所示。下列说法正确的是( ) A、Ksp(PbCO3)的数量级为10-14 B、p点对应的是PbCO3不饱和溶液 C、L2对应的是-lgc(Pb2+)与-lgc(I-)的关系变化 D、向浓度相同的Na2CO3、Nal混合溶液中滴入Pb(NO3)2溶液先产生黄色沉淀16. 已知相同温度下, 。某温度下,饱和溶液中 、 、与 的关系如图所示。
A、Ksp(PbCO3)的数量级为10-14 B、p点对应的是PbCO3不饱和溶液 C、L2对应的是-lgc(Pb2+)与-lgc(I-)的关系变化 D、向浓度相同的Na2CO3、Nal混合溶液中滴入Pb(NO3)2溶液先产生黄色沉淀16. 已知相同温度下, 。某温度下,饱和溶液中 、 、与 的关系如图所示。
下列说法正确的是( )
A、曲线①代表 的沉淀溶解曲线 B、该温度下 的 值为 C、加适量 固体可使溶液由a点变到b点 D、 时两溶液中17. 室温下,分别向体积均为20mL、浓度均为0.1mol·L-1的HX、HY溶液中,滴加相同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。随着Ba(OH)2溶液的加入,由水电离产生的c(H+)的变化趋势如图所示。下列说法错误的是( ) A、相同条件下,Ka(HX)>Ka(HY) B、M点溶液显中性,溶液中c(Y-)<c(Ba2+) C、N点对应Ba(OH)2溶液的体积为10mL D、T点溶液中阴离子浓度之和大于M点
A、相同条件下,Ka(HX)>Ka(HY) B、M点溶液显中性,溶液中c(Y-)<c(Ba2+) C、N点对应Ba(OH)2溶液的体积为10mL D、T点溶液中阴离子浓度之和大于M点二、多选题
-
18. 下列实验对应的现象及结论均正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
向FeCl3溶液中通入足量的H2S
生成两种沉淀
Fe3+的氧化性强于S
B
向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液
先出现浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
C
向FeCl3溶液中滴入几滴30%的H2O2溶液
有气体产生,一段时间后,FeCl3溶液颜色加深
Fe3+能催化H2O2 分解,且该分解反应为放热反应
D
铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体
加热时无明显现象,加入硝酸钾后溶液变蓝
硝酸钾起催化作用
A、A B、B C、C D、D19. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
取5mL0.1 mol·L-1KI溶液,加入1mL0.1 mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变血红色
Fe3+与Iˉ反应具有可逆性
B
向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)>Ksp(AgCl)
C
等体积pH=3的HA和HB两种酸分别与足量的锌反应,收集气体,HA放出的氢气多且反应速率快
HA酸性比HB弱
D
室温下,用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8
HNO2电离H+的能力比CH3COOH的强
A、A B、B C、C D、D20. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
实验结论
A
向0.1 mol/LFeCl2溶液中加入几滴氯水,溶液颜色变成棕黄色
氯水中含有HClO
B
用pH试纸测得浓度均为0.1 mol/L的CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8
CH3COOH电离出H+的能力比HNO2的强
C
向3 mol KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
向浓度均为0.05 mol/L的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgCl)>Ksp(AgI)
A、A B、B C、C D、D21. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
实验结论
A
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去,2 min后,试管里出现凝胶
酸性:盐酸>硅酸
B
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
C
向5 mL 0.1 mol·L-1KI溶液中加入0.1 mol·L-1的FeCl3溶液1 mL,振荡,用苯萃取2~3次后取下层溶液滴加5滴KSCN溶液,出现血红色
反应2Fe3++2I-=2Fe2++I2是有一定限度的
D
在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D三、填空题
-
22. 25℃ 时,硫氢化钾溶液里存在下列平衡:a. HS-+H2O OH-+H2S b.HS- H++S2-(1)、平衡a 是平衡;平衡b是平衡 (填“电 离”或“水 解”);(2)、向KHS溶液中加入氢氧化钠固体时,c(S2-)将(填“增 大”“ 减小”或“不 变”, 下同);向KHS溶被中通入HCl时,c(HS-)将;(3)、向KHS溶液中加入硫酸铜溶被时,有黑色沉淀(CuS)产生,则平衡a(填“正向” “逆向”或“不”,下 同 )移动, 平 衡b移 动。23. 常温下,向 溶液中加入 溶液,可观察到的现象是 , 发生反应的离子方程式为 , Fe(OH)3的溶度积表达式 , 产生Fe(OH)3沉淀的条件是QCKSP(大于、等于或小于)。
四、实验探究题
-
24. 某实验小组探究盐溶液对弱电解质的电离及难溶电解质的溶解的影响。
文献指出:向弱电解质或难溶电解质中加入具有不同离子的可溶性强电解质溶液,会使弱电解质的电离程度或难溶电解质的溶解度增大,这种现象可称为“盐效应”。
(1)、对弱电解质Fe(SCN)3的电离的影响。
资料:i.等浓度的MgSO4与FeSO4的盐效应相当。
ii.Fe2++2SCN-⇌Fe(SCN)2(无色);Mg2+与SCN-不反应。
①加入0.5mLH2O的目的是。
②对比a、b中的现象,得出的结论是。
③结合化学平衡移动原理解释c中红色比b浅的原因:。
(2)、对难溶电解质FeCO3的溶解性的影响。ⅰ

ⅱ

资料:等浓度的KCl与KSCN的盐效应相当。
对比实验ⅰ、ⅱ,对于ⅱ中溶液为红色,提出假设:
A.……
B.溶液中的SCN-与Fe2+结合,促进FeCO3的溶解。
设计对比实验ⅲ,证实假设B是主要原因。
①假设A是。
②对比实验ⅲ的步骤和现象:(按实验ⅱ的图示方式呈现)。
(3)、通过以上实验,说明该实验条件下盐溶液通过、可促进弱电解质的电离及难溶电解质的溶解。25.(1)、(一)某小组同学用下列试剂研究将AgCl转化为AgI。(已知:Ksp(AgCl)=1.8×10-10 , Ksp(AgI)=8.5×10-17)实验操作(试剂:0.1 mol/L NaCl溶液,0.1 mol/L AgNO3溶液,0.1 mol/L KI溶液):向盛有2 mL 0.1 mol/L NaCl溶液的试管中(将操作补充完整)。
(2)、实验现象:(3)、实验分析及讨论:①该沉淀转化反应的离子方程式是。
②由上述沉淀转化反应的化学平衡常数表达式可推导:K (列式即可,不必计算结果)。
(4)、(二)某同学设计如下实验装置实现AgNO3溶液和KI溶液间的反应(a、b均为石墨)。
当K闭合后,发现电流计指针偏转,b极附近溶液变蓝。
①b极发生的是(填“氧化”或“还原”)反应。
②a极上的电极反应式是。
(5)、事实证明:AgNO3溶液与KI的溶液混合只能得到AgI沉淀,对比(4)中反应,从反应原理的角度解释产生该事实的可能原因:。五、综合题
-
26. 铬铁矿主要成分为铬尖晶石(FeCr2O4),以铬铁矿为原料可制备Cr2(SO4)3溶液。铬铁矿的尖晶石结构在通常条件下难以被破坏,其中的二价铁被氧化后,会促进尖晶石结构分解,有利于其参与化学反应。(1)、铬铁矿中的基态二价铁被氧化过程中,失去的电子所处的能级为。(2)、120℃时,向铬铁矿矿粉中加入50%的H2SO4 , 不断搅拌,铬铁矿溶解速率很慢。向溶液中加入一定量的CrO3 , 矿粉溶解速率明显加快,得到含较多Cr3+和Fe3+的溶液。写出加入CrO3后促进尖晶石溶解的离子方程式:。(3)、其它条件不变,测得不同温度下Cr3+的浸出率随酸浸时间的变化如图1所示。实际酸浸过程中选择120℃的原因是。
 (4)、已知:室温下Ksp[Cr(OH)3]=8×10-31 , Ksp[Fe(OH)3]=3×10-39 , 可通过调节溶液的pH,除去酸浸后混合液中的Fe3+。实验测得除铁率和铬损失率随混合液pH的变化如图2所示。pH=3时铬损失率高达38%的原因是。
(4)、已知:室温下Ksp[Cr(OH)3]=8×10-31 , Ksp[Fe(OH)3]=3×10-39 , 可通过调节溶液的pH,除去酸浸后混合液中的Fe3+。实验测得除铁率和铬损失率随混合液pH的变化如图2所示。pH=3时铬损失率高达38%的原因是。 (5)、在酸浸后的混合液中加入有机萃取剂,萃取后,Fe2(SO4)3进入有机层,Cr2(SO4)3进入水层。取10.00mL水层溶液于锥形瓶中,先加入氢氧化钠调节溶液至碱性,再加入足量过氧化氢溶液。充分反应后,加热煮沸除去过量过氧化氢。待溶液冷却至室温,加入硫酸和磷酸的混合酸酸化,此时溶液中Cr全部为+6价。在酸化后的溶液中加入足量KI溶液,以淀粉溶液作指示剂,用0.3000mol·L-1Na2S2O3溶液滴定,发生反应:I2+2S2O =S4O +2I- , 滴定至终点时消耗Na2S2O3溶液19.80mL,计算萃取所得水层溶液中Cr3+的物质的量浓度。(写出计算过程)27. 水体富营养化是由于水体中N、P等营养盐含量过多而引起的水质污染现象。去除水体中N、P的方法很多。(1)、化学沉淀法去除水体中的PO43- , 常用的化合物有AlCl3、Ca(OH)2 等。
(5)、在酸浸后的混合液中加入有机萃取剂,萃取后,Fe2(SO4)3进入有机层,Cr2(SO4)3进入水层。取10.00mL水层溶液于锥形瓶中,先加入氢氧化钠调节溶液至碱性,再加入足量过氧化氢溶液。充分反应后,加热煮沸除去过量过氧化氢。待溶液冷却至室温,加入硫酸和磷酸的混合酸酸化,此时溶液中Cr全部为+6价。在酸化后的溶液中加入足量KI溶液,以淀粉溶液作指示剂,用0.3000mol·L-1Na2S2O3溶液滴定,发生反应:I2+2S2O =S4O +2I- , 滴定至终点时消耗Na2S2O3溶液19.80mL,计算萃取所得水层溶液中Cr3+的物质的量浓度。(写出计算过程)27. 水体富营养化是由于水体中N、P等营养盐含量过多而引起的水质污染现象。去除水体中N、P的方法很多。(1)、化学沉淀法去除水体中的PO43- , 常用的化合物有AlCl3、Ca(OH)2 等。①AlCl3溶液中Al3+水解的离子方程式为。
②Ca5(PO4)3OH的Ksp为6.8X10-37 , 其溶度积常数表达式为Ksp[Ca5(PO4)3OH]=。
(2)、为探究将废水中氨态氮(NH3-N) 和PO43-同时去除,按n(NH4Cl):nNa2HPO4):n(MgCl2)=1:1:1加入水中,实验测得不同pH下,氨态氮和PO43-的去除率如图(a)所示:
已知: (I) 去除的主要反应为: Mg2++NH4++HPO42-+6H2O MgNH4PO4 6H2O↓+H+ ,
(II)室温时,Ksp(MgNH4PO4 6H2O)=2.5X10-13 , Ksp[Mg(OH)2]= 1.8x10-11 , Ksp[Mg3(PO4)2]=6.3X10-31。
①pH在8.5~10.5时,氨态氮和PO43-去除率随pH增大而增大,其原因是(从平衡移动角度说明)。
②当pH> 10.5时,氨态氮和PO43-去除率随pH增大而减小,其原因是(从平衡移动角度说明)。
 (3)、-种浸没式SMDDC电池可用于去除地下水中硝态氮,其装置如图(b)所示:
(3)、-种浸没式SMDDC电池可用于去除地下水中硝态氮,其装置如图(b)所示:①装置工作时,H+向极(填“X”或“Y")室迁移。
②X极上(CH2O)n→CO2 的电极反应式为;
Y极上NO3-→>N2的电极反应式为
28. 碱式氧化镍(NiOOH)可作镍电池的正极材料,现用某废镍原料(主要含Ni、Al、SiO2 , 少量Cr、FeS等)来制备,其工艺流程如下: 回答下列问题:(1)、“碱浸”时,发生反应的离子反应方程式① , ②。(2)、已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
回答下列问题:(1)、“碱浸”时,发生反应的离子反应方程式① , ②。(2)、已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:开始沉淀的pH
完全沉淀的pH
Ni2+
6.2
8.6
Fe2+
7.6
9.1
Fe3+
2.3
3.3
Cr3+
4.5
5.6
“调pH 1”时,主要除去的离子是 , 溶液pH范围。
(3)、在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式。(4)、在酸性溶液中CrO 可以转化成Cr2O ,用离子方程式表示该转化反应 , 已知BaCrO4的Ksp=1.2×10-10 , 要使溶液中CrO 沉淀完全(c(CrO )≤1×10-5mol·L-1),溶液中钡离子浓度至少为mol·L-1。29. 某油脂厂废弃的油脂加氢所用催化剂主要含金属Ni、Al、Fe及他们的氧化物,还有少量其他不溶性杂质。采用如图工艺流程回收其中的镍来制备硫酸镍晶体(NiSO4•7H2O): 溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:
溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时的pH(c=1.0mol•L-1)
6.2
3.7
2.2
7.5
沉淀完全时的pH(c=1.0×10-5mol•L-1)
8.7
4.7
3.2
9.0
(1)、废镍催化剂上的油脂在过程中被处理,滤液①中含有的无机阴离子有OH-、。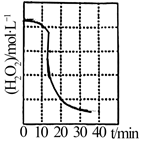 (2)、“转化”过程中反应的化学方程式为 , c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因是。(3)、利用表格数据,计算Ni(OH)2的Ksp= , “转化”后的溶液中Ni2+的浓度为1.0mol•L-1 , “调pH”应控制的pH范围是。(4)、进行操作I前通常要在滤液③中加入少量稀硫酸,作用为。(5)、硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH,反应的离子方程式为。30. (铬是造成水体重度污染的元素之一,水体除铬主要有还原沉淀法、离子交换法、光催化还原法等。
(2)、“转化”过程中反应的化学方程式为 , c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因是。(3)、利用表格数据,计算Ni(OH)2的Ksp= , “转化”后的溶液中Ni2+的浓度为1.0mol•L-1 , “调pH”应控制的pH范围是。(4)、进行操作I前通常要在滤液③中加入少量稀硫酸,作用为。(5)、硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH,反应的离子方程式为。30. (铬是造成水体重度污染的元素之一,水体除铬主要有还原沉淀法、离子交换法、光催化还原法等。 (1)、还原沉淀法:向水体中加入FeSO4、CaSO3等将高毒性Cr(Ⅵ)还原为低毒性Cr(Ⅲ)再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
(1)、还原沉淀法:向水体中加入FeSO4、CaSO3等将高毒性Cr(Ⅵ)还原为低毒性Cr(Ⅲ)再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。①Cr(Ⅵ)在水溶液中的存在形态分布如图1所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4 , 发生的主要反应的离子方程式为。
②Cr(Ⅲ)在水溶液中的存在形态分布如图2所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为。
(2)、离子交换法:用强碱性离子交换树脂(ROH)与含铬离子(CrO 、HCrO 等)发生离子交换。如与CrO 的交换可表示为2ROH(s)+CrO (aq) R2CrO4(s)+2OH-(aq)。Cr(Ⅵ)去除率与pH关系如图3所示,当pH>4时,Cr(Ⅵ)去除率下降的原因是。 (3)、光催化还原法:可能的反应机理如图4所示,ZrO2纳米管为催化剂,在紫外光照射下,VB端光生空穴(h+)被牺牲剂甲醇(CH3OH)消耗。在紫外光照射下,甲醇还原Cr(Ⅵ)的过程可描述为。
(3)、光催化还原法:可能的反应机理如图4所示,ZrO2纳米管为催化剂,在紫外光照射下,VB端光生空穴(h+)被牺牲剂甲醇(CH3OH)消耗。在紫外光照射下,甲醇还原Cr(Ⅵ)的过程可描述为。