高中化学人教版(2019)选择性必修1第三章第二节水的电离和溶液pH
试卷更新日期:2021-08-11 类型:同步测试
一、单选题
-
1. 某同学拟用 计测定溶液 以探究某酸HR是否为弱电解质。下列说法正确的是( )A、25℃时,若测得 溶液 ,则HR是弱酸 B、25℃时,若测得 溶液 且 ,则HR是弱酸 C、25℃时,若测得HR溶液 ,取该溶液 ,加蒸馏水稀释至 ,测得 ,则HR是弱酸 D、25℃时,若测得NaR溶液 ,取该溶液 ,升温至50℃,测得 , ,则HR是弱酸2. 下列说法不正确的是( )A、测定0.1mol/L醋酸溶液的pH可证明醋酸是弱电解质 B、相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等 C、常温下,将1 L0.1 mol/L的Ba(OH)2溶液稀释为2 L,pH=13 D、相同温度下,中和相同pH、相同体积的盐酸和醋酸溶液,消耗NaOH物质的量不同3. 四种短周期主族元素X、Y、Z、W的原子序数依次增大,Y、W原子序数之和为Z原子序数的2倍,W的最外层电子数是内层电子数的3倍,这四种元素可组成一种化合物M的结构如图所示。下列说法错误的是( )
 A、Y、Z、W分别与X形成的二元化合物均不止一种 B、X、Y、W形成的一种酸具有还原性 C、化合物M溶于水能促进水的电离 D、最高价氧化物对应水化物的酸性:Y>Z4. 测定浓硫酸试剂中 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取 待测液,用 的 溶液滴定。上述操作中,不需要用到的仪器为( )A、
A、Y、Z、W分别与X形成的二元化合物均不止一种 B、X、Y、W形成的一种酸具有还原性 C、化合物M溶于水能促进水的电离 D、最高价氧化物对应水化物的酸性:Y>Z4. 测定浓硫酸试剂中 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取 待测液,用 的 溶液滴定。上述操作中,不需要用到的仪器为( )A、 B、
B、 C、
C、 D、
D、
5. 下列实验设计不能达到实验目的的是( )实验目的
实验设计
A
检验溶液中 是否被氧化
取少量待测液,滴加 溶液,观察溶液颜色变化
B
净化实验室制备的
气体依次通过盛有饱和 溶液、浓 的洗气瓶
C
测定 溶液的pH
将待测液滴在湿润的pH试纸上,与标准比色卡对照
D
工业酒精制备无水乙醇
工业酒精中加生石灰,蒸馏
A、A B、B C、C D、D6. 下列实验操作或装置能达到实验目的的是( ) A、用甲装置测定0.1mol·L-1KClO溶液的pH B、用乙装置制备纯净干燥的Cl2 C、用丙装置验证蔗糖与浓硫酸反应产生SO2 D、用丁装置可检验FeSO4溶液中的Fe2+是否被氧化7. 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是( )
A、用甲装置测定0.1mol·L-1KClO溶液的pH B、用乙装置制备纯净干燥的Cl2 C、用丙装置验证蔗糖与浓硫酸反应产生SO2 D、用丁装置可检验FeSO4溶液中的Fe2+是否被氧化7. 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是( ) A、原子半径和离子半径均满足:Y<Z B、最高价氧化物对应水化物的酸性:T<R C、氢化物的沸点不一定是:Y>R D、由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性8. 常温下用0.2mol·L-1NaOH溶液分别滴定0.2mol·L-1一元酸HA和HB,混合溶液的pH与离子浓度变化的关系如图所示。下列有关叙述错误的是( )
A、原子半径和离子半径均满足:Y<Z B、最高价氧化物对应水化物的酸性:T<R C、氢化物的沸点不一定是:Y>R D、由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性8. 常温下用0.2mol·L-1NaOH溶液分别滴定0.2mol·L-1一元酸HA和HB,混合溶液的pH与离子浓度变化的关系如图所示。下列有关叙述错误的是( )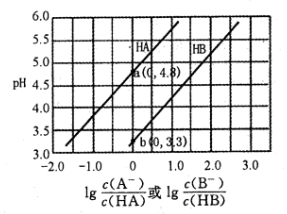 A、Ka(HA)的数量级为10-5 B、酸碱恰好反应时,HB溶液中的pH为9.15 C、反应HA+B-=HB+A-的平衡常数为10-1.5 D、相同条件下对水的电离影响程度:NaA>NaB9. 用0.1000 mol·L-1 NaOH溶液分别滴定20 mL 0.1000 mol·L-1 HCl和HAc(醋酸)的滴定曲线如图。下列说法正确的是( )
A、Ka(HA)的数量级为10-5 B、酸碱恰好反应时,HB溶液中的pH为9.15 C、反应HA+B-=HB+A-的平衡常数为10-1.5 D、相同条件下对水的电离影响程度:NaA>NaB9. 用0.1000 mol·L-1 NaOH溶液分别滴定20 mL 0.1000 mol·L-1 HCl和HAc(醋酸)的滴定曲线如图。下列说法正确的是( )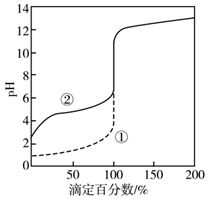 A、0.1000 mol·L-1 HAc的电离百分数约为10% B、两个滴定过程均可用甲基橙做指示剂 C、滴定百分数为50%时,曲线②溶液中c(Ac-)>c(Na+) D、图像的变化证实了Ac-的碱性很强10. 下列有关电解质溶液的叙述错误的是( )A、25℃时,将0.1mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=l×10-10mol·L-1 B、25℃时,将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 C、25℃时,pH=11的氨水和pH=11的Na2CO3溶液中,由水电离产生的c(OH-)均为1×10-11mol·L-1 D、温度一定时,CH3COOH和CH3COONa的混合溶液中, =11. 某温度下,将0.1mol·L-1一元弱碱(BOH)溶液滴入10mL0.1 mol·L-1一元酸(HA)溶液中,混合溶液 pH 和温度随加入碱溶液体积变化曲线如图所示。下列有关说法错误的是( )
A、0.1000 mol·L-1 HAc的电离百分数约为10% B、两个滴定过程均可用甲基橙做指示剂 C、滴定百分数为50%时,曲线②溶液中c(Ac-)>c(Na+) D、图像的变化证实了Ac-的碱性很强10. 下列有关电解质溶液的叙述错误的是( )A、25℃时,将0.1mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=l×10-10mol·L-1 B、25℃时,将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 C、25℃时,pH=11的氨水和pH=11的Na2CO3溶液中,由水电离产生的c(OH-)均为1×10-11mol·L-1 D、温度一定时,CH3COOH和CH3COONa的混合溶液中, =11. 某温度下,将0.1mol·L-1一元弱碱(BOH)溶液滴入10mL0.1 mol·L-1一元酸(HA)溶液中,混合溶液 pH 和温度随加入碱溶液体积变化曲线如图所示。下列有关说法错误的是( ) A、曲线M是温度变化曲线,曲线N是PH变化曲线 B、水的电离程度:b>c>a>d C、c 点存在守恒关系:c(B+)=c(A-) D、b点:c(A-)>c(B+)>c(H+)>c(OH-)12. 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元元素组成的一种分子簇的球棍模型如图所示。W与X不在同周期,X原子的最外层电子数与核外电子总数之比为3:4,Z的周期数等于族序数。下列说法错误的是( )
A、曲线M是温度变化曲线,曲线N是PH变化曲线 B、水的电离程度:b>c>a>d C、c 点存在守恒关系:c(B+)=c(A-) D、b点:c(A-)>c(B+)>c(H+)>c(OH-)12. 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元元素组成的一种分子簇的球棍模型如图所示。W与X不在同周期,X原子的最外层电子数与核外电子总数之比为3:4,Z的周期数等于族序数。下列说法错误的是( ) A、该分子簇的化学式为Y2Z2X6W2 B、工业上常用电解熔融YX制备Y单质 C、简单离子的半径:X>Y>Z D、Y、Z的简单离子均可促进水的电离13. 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。常温下,调节其水溶液pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知 ]。
A、该分子簇的化学式为Y2Z2X6W2 B、工业上常用电解熔融YX制备Y单质 C、简单离子的半径:X>Y>Z D、Y、Z的简单离子均可促进水的电离13. 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。常温下,调节其水溶液pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知 ]。下列说法正确的是( )
 A、25℃,B点水的电离出的c(H+)=1×10−4 B、NaHFeO4溶液显碱性 C、常温下,H2FeO4(aq)+H+(aq) H3FeO (aq)的平衡常数K<100 D、K2FeO4起杀菌消毒作用是因为其遇水生成了Fe(OH)3胶体14. 水的电离平衡曲线如图所示,下列说法错误的是( )
A、25℃,B点水的电离出的c(H+)=1×10−4 B、NaHFeO4溶液显碱性 C、常温下,H2FeO4(aq)+H+(aq) H3FeO (aq)的平衡常数K<100 D、K2FeO4起杀菌消毒作用是因为其遇水生成了Fe(OH)3胶体14. 水的电离平衡曲线如图所示,下列说法错误的是( )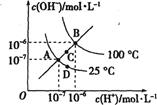 A、图中四点Kw间的关系:A=D<C<B B、若从A点到D点,可采用:温度不变在水中加入少量酸 C、若从A点到C点,可采用:温度不变在水中加入少量NH4Cl固体 D、若从A点到D点,可采用:温度不变在水中加入少量NH4Cl固体15. 是制备电池的重要原料。室温下, 溶液的pH随 的变化如图甲所示, 溶液中 的分布分数 随pH的变化如图乙所示 。
A、图中四点Kw间的关系:A=D<C<B B、若从A点到D点,可采用:温度不变在水中加入少量酸 C、若从A点到C点,可采用:温度不变在水中加入少量NH4Cl固体 D、若从A点到D点,可采用:温度不变在水中加入少量NH4Cl固体15. 是制备电池的重要原料。室温下, 溶液的pH随 的变化如图甲所示, 溶液中 的分布分数 随pH的变化如图乙所示 。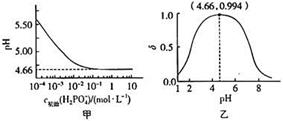
下列有关 溶液的叙述正确的是
A、溶液中存在3个平衡 B、含P元素的粒子有 、 和 C、随 增大,溶液的pH明显变小 D、用浓度大于 的 溶液溶解 ,当pH达到 时, 几乎全部转化为16. 常温下,用0.1mol·L-1NaOH溶液滴定0.10 mol·L-1HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列陈述错误的是( ) A、Ka(HA)的数量级为10-5 B、N点,c(Na+)-c(A-)= C、P到Q过程中,水的电离程度逐渐增大 D、当滴定至溶液呈中性时,c(A-)>c(HA)
A、Ka(HA)的数量级为10-5 B、N点,c(Na+)-c(A-)= C、P到Q过程中,水的电离程度逐渐增大 D、当滴定至溶液呈中性时,c(A-)>c(HA)二、多选题
-
17. 用一定浓度NaOH溶液滴定某一元酸HA溶液。滴定终点附近溶液pH和导电能力的变化分别如图所示。下列说法正确的是( )
 A、HA为一元弱酸 B、b点对应的溶液中:c(A-)>c(Na+) C、根据溶液pH和导电能力的变化可判断V2<V3 D、a、b、c三点对应的溶液中水的电离程度依次减小18. 一定温度下,水存在如下电离:H2O
A、HA为一元弱酸 B、b点对应的溶液中:c(A-)>c(Na+) C、根据溶液pH和导电能力的变化可判断V2<V3 D、a、b、c三点对应的溶液中水的电离程度依次减小18. 一定温度下,水存在如下电离:H2O H++OH- ∆H>0,下列叙述正确的是 A、向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 B、将水加热,Kw增大,pH减小 C、向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 D、向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变19. 已知某温度时CH3COOH 的电离平衡常数为K , 该温度下向 20mL 0.1mol·L-1 CH3COOH 溶液中逐滴加入0.1mol·L-1NaOH 溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
H++OH- ∆H>0,下列叙述正确的是 A、向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 B、将水加热,Kw增大,pH减小 C、向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 D、向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变19. 已知某温度时CH3COOH 的电离平衡常数为K , 该温度下向 20mL 0.1mol·L-1 CH3COOH 溶液中逐滴加入0.1mol·L-1NaOH 溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( ) A、a 点表示溶液中c(CH3COO-)=10-3 mol·L-1 B、b 点表示的溶液中c(CH3COO-)>c(Na+) C、c点表示CH3COOH和NaOH恰好反应完全 D、b、d 点表示的溶液中 均等于K
A、a 点表示溶液中c(CH3COO-)=10-3 mol·L-1 B、b 点表示的溶液中c(CH3COO-)>c(Na+) C、c点表示CH3COOH和NaOH恰好反应完全 D、b、d 点表示的溶液中 均等于K三、填空题
-
20. 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时0.001 mol/L的NaOH溶液中,由水电离出的c(H+)=mol·L-1 , Kw(25℃)Kw(100℃)(填“>”、“<”或“=”)。25℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”)。
 21. 18℃时,H2A(酸):K1=4.3×10-7 , K2=2.1×10-12;H2B(酸):K1=1.0×10-7 , K2=6.3×10-13;在浓度相同的两种溶液中,用“>”、“<”或“=”填空。(1)、H+的浓度:H2AH2B;(2)、酸根离子的浓度:c(A2-)c(B2-);(3)、酸分子的浓度:c(H2A)c(H2B);(4)、溶液的导电能力:H2AH2B。22. 现有下列物质:①100 ℃纯水;②25 ℃ 0.1 mol·L-1HCl溶液;③25 ℃ 0.1 mol·L-1KOH溶液;④25 ℃ 0.1 mol·L-1Ba(OH)2溶液。(1)、这些物质与25 ℃纯水相比,能促进水的电离的是(填序号,下同),能抑制水的电离的是 , 水电离的c(OH-)等于溶液中c(OH-)的是 , 水电离的c(H+)等于溶液中c(H+)的是。(2)、从②和③溶液中水的电离程度相等,进而可推出的结论是:同一温度下,时,水的电离度相等。
21. 18℃时,H2A(酸):K1=4.3×10-7 , K2=2.1×10-12;H2B(酸):K1=1.0×10-7 , K2=6.3×10-13;在浓度相同的两种溶液中,用“>”、“<”或“=”填空。(1)、H+的浓度:H2AH2B;(2)、酸根离子的浓度:c(A2-)c(B2-);(3)、酸分子的浓度:c(H2A)c(H2B);(4)、溶液的导电能力:H2AH2B。22. 现有下列物质:①100 ℃纯水;②25 ℃ 0.1 mol·L-1HCl溶液;③25 ℃ 0.1 mol·L-1KOH溶液;④25 ℃ 0.1 mol·L-1Ba(OH)2溶液。(1)、这些物质与25 ℃纯水相比,能促进水的电离的是(填序号,下同),能抑制水的电离的是 , 水电离的c(OH-)等于溶液中c(OH-)的是 , 水电离的c(H+)等于溶液中c(H+)的是。(2)、从②和③溶液中水的电离程度相等,进而可推出的结论是:同一温度下,时,水的电离度相等。四、实验探究题
-
23. 碘水中存在可逆反应:I2(aq)+I-(aq) I (aq),为测定该反应的平衡常数K进行如下实验。
实验i 测定平衡体系中I2和I 总浓度

实验ii 测定饱和碘水中I2浓度

已知: 。
(1)、碘量瓶是带磨口塞和水封槽的锥形瓶,盖上塞子后可以水封瓶口,常用于碘量分析本实验采用碘量瓶的目的是。(2)、滴定过程应使用滴定管。(3)、滴定过程,当溶液变为浅黄色时再加入淀粉溶液,滴定终点现象为。(4)、实验i和实验ii中I2浓度近似相等,则实验i剩余碘固体的质量实验ii(填“大于”、“小于”或“等于”)。(5)、实验测得平衡体系中c(I )=mol·L-1 , 平衡常数K=(列表达式即可)(6)、下列关于实验分析的说法正确的是___________(填标号)。A、实验i的碘量瓶在使用前未烘干会影响实验结果 B、实验i应精准控制加入 溶液的体积 C、实验ii吸取上层清液时,不慎吸入碘固体,则测得的K偏大 D、实验ii滴定终点时俯视读数,则测得的K偏大(7)、另外设计实验方案测定平衡常数K:取10.00 碘量瓶②中上层清液,加入10 萃取 并分液。用0.0050 溶液分别滴定水层和有机层、消耗 溶液的体积为 和 。试分析该方案是否可行,并说明理由。24. 某化学兴趣小组探究84消毒液(含10.5%NaClO和少量NaOH)与75%医用酒精能否反应,进行如下实验: (1)、将25mL无水乙醇配成75%医用酒精,下列仪器中不需要使用的有(填名称)。
(1)、将25mL无水乙醇配成75%医用酒精,下列仪器中不需要使用的有(填名称)。 (2)、实验Ⅰ的淀粉碘化钾试纸在3min时变蓝,21min后蓝色褪去,实验Ⅱ则在8min时变蓝,49min后褪色。
(2)、实验Ⅰ的淀粉碘化钾试纸在3min时变蓝,21min后蓝色褪去,实验Ⅱ则在8min时变蓝,49min后褪色。①实验中,使淀粉碘化钾试纸变蓝的物质是 , 而后碘被(填“氧化”或“还原”)导致蓝色褪去。
②对比实验Ⅰ和Ⅱ的现象可以说明乙醇被NaClO氧化,理由是。
③实验过程,测得实验Ⅰ中混合溶液的pH由12.38逐渐增大至12.80,说明乙醇与NaClO反应可能生成。
(3)、为了测定84消毒液与医用酒精1:1反应后溶液中剩余NaClO含量:取5.00mL反应后溶液(密度约1g·mL-1)于锥形瓶,加入过量KI溶液和适量硫酸,在冷暗处静置4-5min后,再加入少量淀粉指示剂,用0.1000mol·L-1Na2S2O3标准液滴定,消耗标准液体积为14.80mL。①滴定前,将锥形瓶置于“冷暗处”的目的是 , 写出NaClO与KI反应的离子方程式。
②滴定终点溶液的颜色是 , 84消毒液与医用酒精1:1反应后溶液中NaClO的质量分数=(结果保留3位有效数字;I2+2S2O =2I-+S4O )。
25. 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体,在10℃时反应制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
已知:2NaClO + (CNO)3H3 = (CNO)3Cl2Na + NaOH + H2O
回答下列问题:
(1)、仪器a的名称为恒压滴液漏斗,与分液漏斗相比其优点是。(2)、待装置B中出现现象时,可由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入 Cl2的理由是。(3)、反应结束后,装置B中的浊液经过滤、、干燥得粗产品。上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是。(4)、通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。反应原理: [(CNO)3Cl2]-+ H+ +2H2O = (CNO)3H3 + 2HClO, HClO + 2I- + H+ = I2 + Cl-+ H2O, I2 + 2S2O = S4O + 2I-
实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用 c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为 V mL。
①滴定终点现象为。
②该样品的有效氯含量表达式为 。(该样品的有效氯= ×100%)
26. 甘氨酸亚铁[(H2NCH2COO)2Fe]是一种复合补血营养剂。实验室用绿矾(FeSO4•7H2O)为原料制备甘氨酸亚铁,有关物质性质如下:甘氨酸(H2NCH2COOH)
柠檬酸
甘氨酸亚铁
易溶于水,微溶于乙醇,两性化合物
易溶于水和乙醇,有酸性和还原性
易溶于水,难溶于乙醇
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中缓慢加入200mL1.1mol•L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
(1)、实验I中:实验室配制绿矾溶液时,必须用到的玻璃仪器有。(2)、实验II中:生成沉淀的离子方程式为。(3)、实验III中:①检查装置A的气密性的方法是。②A中反应产生的气体是 , C中空气排净时,D中现象是。
③洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是(填标号)。
a.乙醇 b.热水 c.柠檬酸溶液
(4)、甘氨酸亚铁中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率(已经被氧化的Fe2+的质量与Fe2+总质量的比值)超过10.00%即不能再服用。实验室用Ce(SO4)2溶液对甘氨酸亚铁中的Fe2+进行滴定[假设样品中其他成分不与Ce(SO4)2反应],滴定过程发生如下反应:Ce4++Fe2+=Fe3++Ce3+。①称量6.0g甘氨酸亚铁样品,将其全部溶于稀H2SO4中,配制成250mL溶液。取10.00mL配制好的溶液于锥形瓶中,用0.10mol•L-1的Ce(SO4)2溶液滴定,以邻二氮菲为指示剂。当溶液由红色变为浅蓝色且半分钟之内不恢复原色,滴定达到终点。若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率(填“偏高”“偏低”或“不变”)
②滴定时消耗9.60mLCe(SO4)2溶液,则甘氨酸亚铁样品中Fe2+的氧化率为。
五、综合题
-
27. 设水的电离平衡线如图所示。
 (1)、若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到;(2)、将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为。28. H2O和H2O2在特殊条件下会出现某些特殊的性质。(1)、与常温常压的水相比,高温高压液态水的离子积会显著增大,其原因是。(2)、温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)的水称为超临界水。超临界水能够与氧气等氧化剂以任意比例互溶,由此形成了超临界水氧化技术。一定实验条件下,运用超临界水氧化技术氧化乙醇的结果如图-1、图-2所示,其中x为以碳元素计的物质的量分数,t为反应时间。
(1)、若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到;(2)、将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为。28. H2O和H2O2在特殊条件下会出现某些特殊的性质。(1)、与常温常压的水相比,高温高压液态水的离子积会显著增大,其原因是。(2)、温度、压强分别超过临界温度(374.2℃)、临界压强(22.1MPa)的水称为超临界水。超临界水能够与氧气等氧化剂以任意比例互溶,由此形成了超临界水氧化技术。一定实验条件下,运用超临界水氧化技术氧化乙醇的结果如图-1、图-2所示,其中x为以碳元素计的物质的量分数,t为反应时间。
①由图-1,乙醇氧化过程中存在中间产物,该中间产物的化学式为。
②由图-2,随温度升高,x(CO)峰值出现的时间提前,且峰值更高,其可能的原因是。
(3)、过氧化氢的电离方程式为H2O2⇌H++ 。研究表明,过氧化氢溶液中HO 的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图-3所示。
一定浓度的过氧化氢,随pH增大分解率增大的原因是。
(4)、半导体光催化剂在水中光照发生水光催化反应的原理如图-4所示(“h+”表示“空穴”),“价带”上发生的反应为2H2O+4h+=4H++O2↑。该光催化水分解的过程可描述为:在一定波长光线(hv)的照射下,。29. 对烟道气中的 进行回收再利用具有较高的社会价值。(1)、大气中 含量过高会导致雨水中含有(填化学式)而危害植物和建筑物。工厂排放的 尾气用饱和 溶液吸收可得到重要化工原料 ,反应的化学方程式为。由 过饱和溶液结晶脱水可制得 。写出该过程的化学方程式。(2)、 可用作食品的抗氧化剂。在滴定某葡萄酒中 残留量时,取 葡萄酒样品,用 的碘标准液滴定至终点,消耗 碘液。补全该滴定反应的离子方程式: ,;该样品中 的残留量为 (以 计)。(3)、一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16gS(s),该反应(选填“放出”或“吸收”)的热量为。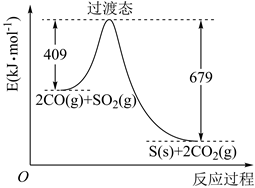 (4)、在绝对隔热恒容的密闭容器中,进行该反应的平衡常数表达式为 , 对此反应下列说法正确的是。
(4)、在绝对隔热恒容的密闭容器中,进行该反应的平衡常数表达式为 , 对此反应下列说法正确的是。a.若混合气体密度保持不变,则已达到平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量CO2 , 平衡常数保持不变
d.分离出少量S粉,正、逆反应速率均保持不变