高中化学人教版(2019)选择性必修1第二章第四节化学反应速率的调控
试卷更新日期:2021-08-10 类型:同步测试
一、单选题
-
1. 合成氨是人类科学技术发展史上的一项重大突破。其反应为:N2 (g)+3H2(g) 2NH3(g),该反应一定条件下自发。下列有关说法正确的是( )A、NH3分子是由极性键构成的非极性分子 B、该反应的ΔH<0,ΔS<0 C、用E表示键能,该反应的ΔH=6E(N-H)-E(N≡N)-3E(H-H) D、将生产的氨气分离出去,可以增大正反应速率同时提高反应物转化率2. 研究人员提出了一种基于Li元素的电化学过程来合成氨,其工艺路线如图所示,下列说法错误的是( )
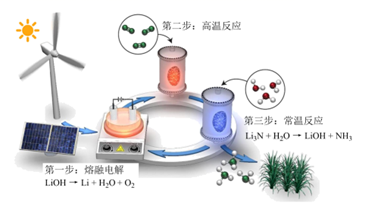 A、第一步每生成1mol氧气转移的电子数为4NA(NA为阿伏加德罗常数的值) B、第一步实现了能量转化:可再生能源→电能→化学能 C、第二步反应方程式为 6Li+N2 2Li3N D、该工艺的总反应为N2+3H2 2NH33. 下列有关说法正确的是( )A、△H>0、△S<0的反应在任何条件下都能自发进行 B、对于二氧化硫的催化氧化反应(△H<0),反应温度越低越好 C、合成氨生产中,为提高氢气的转化率,可增加氮气的量 D、使用催化剂可以提高工业生产中合成氨的产率4. 合成氨反应难以发生的根本原因是( )A、该反应是可逆反应 B、氮分子中存在氮氮叁键 C、该反应需要催化剂 D、氨气容易液化5. 已知:N2+3H2⇌2NH3△H<0.工业合成氨应选择的条件是( )A、高温、高压 B、低温、低压、催化剂 C、适宜的温度、高压、催化剂 D、低温、高压、催化剂6. 工业上用H2和N2合成氨的反应是放热反应,在氨的实际合成生产时温度常控制在700K左右,原因是( )A、高温有利于提高反应的转化率 B、高温可加快反应的限度 C、700K时反应催化剂活性最强 D、高温可加才可以自发向右进行7. 在合成氨时,可以提高H2转化率的措施( )A、延长反应时间 B、充入过量H2 C、充入过量N2 D、升高温度
A、第一步每生成1mol氧气转移的电子数为4NA(NA为阿伏加德罗常数的值) B、第一步实现了能量转化:可再生能源→电能→化学能 C、第二步反应方程式为 6Li+N2 2Li3N D、该工艺的总反应为N2+3H2 2NH33. 下列有关说法正确的是( )A、△H>0、△S<0的反应在任何条件下都能自发进行 B、对于二氧化硫的催化氧化反应(△H<0),反应温度越低越好 C、合成氨生产中,为提高氢气的转化率,可增加氮气的量 D、使用催化剂可以提高工业生产中合成氨的产率4. 合成氨反应难以发生的根本原因是( )A、该反应是可逆反应 B、氮分子中存在氮氮叁键 C、该反应需要催化剂 D、氨气容易液化5. 已知:N2+3H2⇌2NH3△H<0.工业合成氨应选择的条件是( )A、高温、高压 B、低温、低压、催化剂 C、适宜的温度、高压、催化剂 D、低温、高压、催化剂6. 工业上用H2和N2合成氨的反应是放热反应,在氨的实际合成生产时温度常控制在700K左右,原因是( )A、高温有利于提高反应的转化率 B、高温可加快反应的限度 C、700K时反应催化剂活性最强 D、高温可加才可以自发向右进行7. 在合成氨时,可以提高H2转化率的措施( )A、延长反应时间 B、充入过量H2 C、充入过量N2 D、升高温度二、填空题
-
8.
合成氨尿素工业生产过程中涉及到的物质转化过程如图1所示.

(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学化学方程式为
(2)图2为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数.
①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”).
②在相同温度、当压强由p1变为p3时,合成氨反应的化学平衡常数 (填“变大”、“变小”或“不变”).
(3)NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图3如下:NH3(g)与CO2(g)反应生成尿素的热化学方程式为 人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图4所示.阳极室中发生的反应依次为
(4)运输氨时,不能使用铜及其合金制造的管道阀门.因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+ , 该反应的离子方程式为
9.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g),一种工业合成氨,进而合成尿素的简易流程图如下:

(1)步骤Ⅱ中制氢气原理如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g) CO(g)+H2O(g)⇌CO2(g)+H2(g)
恒容容器中,对于以上两个反应,能加快反应速率的是
a.升高温度 b.充入He c.加入催化剂 d.降低压强
(2)天然气中的H2S杂质常用氨水作吸收液吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为 ,该反应的氧化产物为
(3)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
①如将CO2与H2 以1:3的体积比混合. 适当条件下合成某烃和水,该烃是 (填序号).
A.烷烃 B.烯烃 C.苯
②如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4 .
已知:CH4 (g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣890.3kJ/mol
H2(g)+O2(g)═H2O(l)△H2=﹣285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是
③已知CaCO3和BaCO3均为难溶于水的沉淀,某同学欲用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得Ca(OH)2和 Ba(OH)2在20℃时的溶解度(S)数据如下:Ca(OH)2:0.16g; Ba(OH)2:3.89g
则吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 .
(4)已知CO2+2NH3
 CO(NH2)2+H2O,若合成尿素CO(NH2)2的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素.
CO(NH2)2+H2O,若合成尿素CO(NH2)2的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素.三、综合题
-
10. 氨在化肥生产、贮氢燃煤烟气脱硫脱硝等领域用途非常广泛。从能量的变化和反应的快慢等角度研究反应:N2+3H2 2NH3。请根据有关知识,填写下列空白:(1)、为了加快反应速率,可以采取的措施有____________。A、使用催化剂 B、适当提高氮气的浓度 C、适当提高反应的温度 D、适当降低反应的温度(2)、从断键和成键的角度分析上述反应中能量的变化。根据下表数据,计算该反应生成1 mol NH3时放出kJ的热量。
化学键
H-H
N≡N
N-H
断开1mol键所吸收的能量
436 kJ
946 kJ
391 kJ
(3)、利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。该生物燃料电池的总反应方程式为N2+3H2 2NH3。
①其中,右室电极为燃料电池的极,电池工作时电路中每转移0.3 mol电子,标准状况下消耗N2的体积是。
②相比现有工业合成氨,该方法有哪些优点(任写两条)。
11. 氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。 (1)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。(2)、降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).(3)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.(4)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。12. 依据事实,写出下列反应的热化学方程式.(1)、在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为(2)、若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ(3)、已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
2NH3(g) ΔH=-92.4 kJ·mol-1。 (1)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。(2)、降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).(3)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.(4)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。12. 依据事实,写出下列反应的热化学方程式.(1)、在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为(2)、若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ(3)、已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .